Prof. Rafael - Química – Cinética Química
Lista de Exercícios
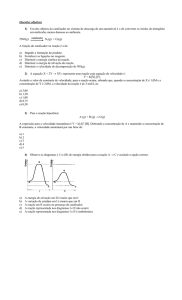
1) (UEPG) A respeito dos fatores que influenciam a cinética de reações químicas, assinale o que for correto.
01. A energia de ativação de uma reação é independente da ação de um catalisador.
02. A velocidade da reação aumenta com o aumento da superfície de contato entre os reagentes.
04. A velocidade da reação aumenta com o aumento da temperatura, devido à maior frequência de colisões
efetivas entre as moléculas dos reagentes.
08. Toda colisão com orientação adequada produz uma reação química.
2) (UFC – Adaptada) As reações químicas metabólicas são fortemente dependentes da temperatura do
meio. Como consequência, os animais de sangue frio possuem metabolismo retardado, fazendo com que
os mesmos se movimentem muito mais lentamente em climas frios. Isso os torna mais expostos aos predadores em regiões temperadas do que em regiões tropicais. Assinale a alternativa que justifica corretamente
esse fenômeno.
Identifique as alternativas falsas e torne-as verdadeiras
a) Um aumento na temperatura aumenta a energia de ativação das reações metabólicas, aumentando suas
velocidades.
b) Um aumento na temperatura aumenta a energia cinética média das moléculas reagentes, aumentando
as velocidades das reações metabólicas.
c) Em temperaturas elevadas, as moléculas se movem mais lentamente, aumentando a frequência dos choques e a velocidade das reações metabólicas.
d) Em baixas temperaturas, ocorre o aumento da energia de ativação das reações metabólicas, aumentando
suas velocidades.
e) A frequência de choques entre as moléculas reagentes independe da temperatura do meio, e a velocidade
da reação independe da energia de ativação.
3) (PUC-MG) A velocidade das reações é uma grandeza que apresenta uma grande importância prática.
Certas vezes, tentamos agir sobre ela para aumentá-la (aceleração da produção na indústria, cozimentos
dos alimentos numa panela de pressão, revelação instantânea das fotografias etc); outras vezes, para diminuí-la (diminuição da corrosão, conservação dos alimentos pelo frio etc).
Assinale a afirmativa INCORRETA:
a) Um complexo ativado é uma estrutura intermediária entre os reagentes e os produtos, com ligações intermediárias entre as dos reagentes e as dos produtos.
b) A energia de ativação é a energia mínima necessária para a formação do complexo ativado. Seu abaixamento determina o aumento da velocidade da reação.
c) Um catalisador é uma substância que aumenta a velocidade de uma reação, permanecendo inalterado
qualitativa e quantitativamente no final da reação.
d) A ação do catalisador é aumentar a energia de ativação, possibilitando um novo caminho para a reação.
4) (UFC-CE) Considere o gráfico a seguir.
Agora, assinale as corretas e some-as.
01. Trata-se de uma reação exotérmica.
02. São liberadas 10 kcal/mol.
04. A energia própria dos reagentes vale 60 kcal/mol.
08. Os produtos apresentam 10 kcal/mol de energia.
16. A energia de ativação da reação vale 60 kcal/mol.
32. A energia do complexo ativado vale 60 kcal/mol.
64. Essa reação é mais rápida do que uma outra reação, cuja energia de ativação vale 1 kcal/mol.
5) (UFPR) No diagrama a seguir, estão representados os caminhos de uma reação na presença e na ausência de um catalisador.
Com base nesse diagrama, é correto afirmar que:
01. a curva II refere-se à reação catalisada e a curva I refere-se à não catalisada.
02. se a reação se processar pelo caminho II, ela será mais rápida.
04 a adição de um catalisador à reação diminui seu valor de ΔH.
08. o complexo ativado da curva I apresenta a mesma energia do complexo ativado da curva II.
16. a adição do catalisador transforma a reação endotérmica em exotérmica.
Some os números dos itens corretos.
6) (UNIRIO - Modificada) Num laboratório, foram efetuadas diversas experiências para a reação:
2 H2(g) + 2 NO(g) → N2(g) + 2 H2O(g)
Com os resultados das velocidades iniciais obtidos, montou-se a seguinte tabela:
Baseando-se na tabela acima, escreva a que a lei de velocidade para a reação realizada.
7) (UEM) A uma dada temperatura, medidas experimentais da velocidade da reação abaixo mostraram
tratar-se de uma reação de primeira ordem em relação à concentração de S2O8 2– e também de primeira
ordem em relação a I– .
Considerando essas afirmações, assinale a(s) alternativa(s) correta(s).
01. A lei de velocidade da reação pode ser descrita por v = K · [S2O8 2–] · [I–].
02. Provavelmente, existem erros nas medidas experimentais, visto que os coeficientes obtidos são diferentes dos coeficientes da equação balanceada.
04. Se forem mantidas constantes a temperatura e a concentração de I –, a velocidade da reação duplicarse-á se a concentração de S2O8 2– for duplicada.
08. Uma elevação da temperatura irá alterar a velocidade da reação somente se a reação for endotérmica.
16. A adição de um catalisador ao sistema aumenta a velocidade da reação porque diminui a energia de
ativação para a formação dos produtos.
Some os números dos itens corretos.
8) (UEM) Sobre cinética química e os fatores que influenciam a velocidade de reações químicas, assinale
o que for correto.
01) Reações que envolvem sólidos tendem a prosseguir mais rapidamente se a área superficial dos sólidos
for diminuída. Isso pode ser feito diminuindo-se o tamanho das partículas dos sólidos.
02) Para reações que envolvem líquidos, o aumento na concentração de um dos reagentes leva a um aumento na velocidade da reação, pois, conforme se aumenta a concentração, aumenta-se também a frequência com a qual as moléculas se chocam. Isto é válido desde que o reagente em questão faça parte da lei de
velocidade.
04) O aumento da temperatura faz aumentar a energia das moléculas e, à medida que as moléculas movemse mais velozmente, elas se chocam com maior frequência e também com energia mais alta, ocasionando
um aumento na velocidade da reação.
08) Catalisadores são agentes que aumentam as velocidades das reações, afetando os tipos de colisões
(mecanismos) que levam à reação.
16) A velocidade de uma reação química é geralmente expressa em termos de variação de entalpia por
unidade de tempo.
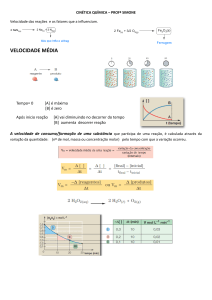
9) Seja a reação A → B + C. A variação na concentração de A em função do tempo é:
Determine a velocidade de consumo do reagente em, mol.L-1.min-1, no intervalo de 1 a 5 minutos. Mostre
os cálculos.
10) A reação de decomposição da amônia gasosa foi realizada em um recipiente fechado:
2NH3(g) → N2(g) + 3H2(g)
A tabela abaixo indica a variação na concentração de reagente em função do tempo.
Qual é a velocidade média, em molL-1h-1 de consumo do reagente nas duas primeiras horas de reação?
Mostre os cálculos.
11) Esboce os gráficos para uma reação exotérmica e endotérmica, em presença e ausência de catalisador.
Mostre a variação de entalpia, e energia de ativação, energia do complexo ativado da reação sem e com
catalisador, para cada gráfico. Coloque o significado para cada um dos eixos.
12) Considere o gráfico a seguir, que mostra a variação de energia de uma reação que ocorre na ausência
e na presença de catalisador:
a) Qual das duas curvas refere-se à reação não catalisada?
b) Qual a função do catalisador nesse processo?
c) Qual a energia do complexo ativado na reação catalisada?
d) Calcule o calor de reação, H, dessa reação.
e) O gráfico refere-se a um processo exotérmico ou endotérmico? Justifique sua resposta.