CINÉTICA QUÍMICA
1. Introdução
A Cinética Química estuda:
- a velocidade das reações;
- como a velocidade varia em função das diferentes condições;
- e os mecanismos de desenvolvimento de uma reação.
2. Velocidade de uma reação química
A velocidade de uma reação química pode ser definida como:
- o aumento na concentração molar do produto por unidade de tempo;
- ou o decréscimo na concentração molar do reagente por unidade de tempo.
A seguir, tem-se a representação gráfica do exemplo mais simples de uma reação:
(A B)
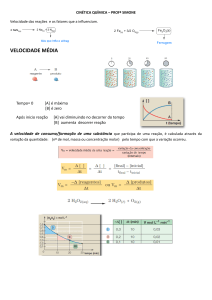
3. Determinação da velocidade média de uma reação (Vm)
[ X ]
Vm
t
Onde:
t = intervalo de tempo
[X] = variação da concentração de reagentes e produtos
É interessante atentar que:
- a velocidade dos reagentes é negativa, pois a concentração deles diminui ao
longo do tempo;
- a velocidade dos produtos é positiva, pois a concentração deles aumenta ao
longo do tempo;
Exemplo:
Seja a reação de decomposição da água oxigenada:
1
H 2 O2 H 2 O2
2
Essa reação envolve a decomposição de H2O2 e a formação de H2 e O2
Sendo assim, tem-se:
Gráfico da decomposição de H2O2:
Analisando os valores das velocidades médias de consumo de H2O2, percebe-se:
- velocidades médias não são constantes;
- valor máximo é encontrado no início da reação.
Conclusão:
- velocidade média diminui de acordo com a diminuição da concentração
Gráfico da formação de H2 e O2:
Seja a reação de decomposição da H2O 2:
1
H 2 O2 H 2 O2
2
Proporção: 2 mols : 2mols : 1 mol
Calculando as velocidades médias de decomposição do reagente e de formação dos
produtos no intervalo de tempo de 0 a 10 minutos:
Decomposição de H2O2: Vm 0,03mol L1
Formação de H2: Vm 0,03mol L1
Formação de O2: Vm 0,015mol L1
Dividindo as velocidades médias pelos coeficientes estequiométricos, obtém-se o
mesmo valor de velocidade média: Vm 0,03mol L1
Esse valor de velocidade média corresponde à velocidade média da reação.
4. Condições para que uma reação ocorra (Teoria das Colisões)
Para que ocorra uma reação, é necessário:
- Moléculas reagentes colidam entre si;
- Colisão ocorra com orientação favorável à formação do complexo ativado;
- A energia das moléculas que colidem entre si seja igual ou superior à energia de
ativação.
Colisão efetiva ou eficaz:
- É a que resulta em reação;
- O número total de colisões efetivas ou eficazes é muito pequeno comparado ao
número total de colisões.
Complexo Ativado:
- Estado intermediário (estado de transição) formado entre os reagentes e os
produtos;
- Em sua estrutura, existem:
- ligações enfraquecidas (presentes nos reagentes);
- e formação de novas ligações (presentes nos produtos).
- Para que ocorra a formação do complexo ativado:
- As moléculas dos reagentes devem apresentar:
- Energia suficiente;
- Colisão com geometria favorável.
- Essa energia é chamada energia de ativação (Eat)
Energia de Ativação (Eat)
Menor quantidade de energia que deve ser fornecida aos reagentes para a formação
do complexo ativado e, consequentemente, para a ocorrência da reação.
- Quanto menor for a energia de ativação de uma reação, maior será a sua
velocidade.
5. Fatores que afetam a velocidade de uma reação
Superfície de contato:
- Quanto mais pulverizado estão os reagentes, maior é a velocidade das reações;
- Pulverização aumenta o número de contato entre as moléculas reagentes;
- Reações entre gases ocorrem mais facilmente do que entre fragmentos sólidos
Temperatura:
- Aumento da temperatura aumenta a velocidade de uma reação porque:
- Aumenta a energia cinética (agitação) das moléculas reagentes;
- Possibilitando maior número de colisões efetivas;
- E a consequente formação de novas moléculas.
Pressão:
- Tem um efeito significativo nas reações envolvendo gases;
- O mesmo não ocorre nos sistemas líquidos e sólidos;
- Quando da reação participam gases:
- Aumento da pressão eleva a concentração destes por compressão
Luz:
-
-
A luz e outras radiações eletromagnéticas exercem efeito análogo ao da
eletricidade:
- Fornecem energia:
- Para que algumas moléculas consigam ultrapassar a barreira da
energia de ativação;
Exemplo: Fotossíntese e Fotólise
Natureza dos reagentes:
- Reações que não envolvem quebra de ligações:
- São muito rápidas à temperatura ambiente;
- Exemplo:
- Reações entre íons de carga contrária;
- Reações de transferência de elétrons em solução aquosa.
6. Catalisador e Inibidor
Catalisador:
- Substância que aumenta a velocidade de uma reação, sem sofrer qualquer
alteração em sua estrutura;
- Aumento da velocidade da reação é conhecido como catálise;
- O catalisador acelera a velocidade da reação:
- Alterando o mecanismo da reação:
- Provocando a formação de um complexo ativado de energia mais
baixa.
Inibidor
É uma substância que diminui a velocidade das reações:
- Formando um complexo ativado de alta energia de ativação;
- É consumido pela reação
Autocatálise:
- Catalisador é um dos produtos da própria reação;
- À medida que o catalisador vai se formando, a velocidade da reação vai
aumentando.
Ativadores do catalisador ou promotores:
- Substâncias que atuam no catalisador, aumentando a sua atividade catalítica;
Venenos de catalisador:
- Diminuem ou, até mesmo, destroem a ação do catalisador.
-
Catálise homogênea:
- catalisador e reagentes no mesmo estado físico;
1
(g)
- Exemplo: SO 2 (g) O2 ( g ) NO
2
SO 3 (g)
2
Catálise Heterogênea:
- catalisador e reagentes em estados físicos diferentes.
(s)
2NH 3 (g)
- Exemplo: NO 2 (g) 3H 2 ( g ) Pt
7. Equação Cinética ou Lei da Velocidade da Reação
A velocidade instantânea de uma reação é obtida através de uma expressão matemática
conhecida como:
Lei da Ação das Massas ou Lei Cinética
Para uma reação genérica homogênea:
aA bB cC dD
A velocidade instantânea é calculada pela expressão:
V = k [A]a [B]b
onde:
K = constante de velocidade
[A] e [B] = concentrações molares
a e b = ordens ou graus
Nas reações elementares (ocorrem em uma só etapa):
- As ordens são iguais aos próprios coeficientes
Nas reações complexas (não elementares):
- As ordens são iguais aos coeficientes da etapa mais lenta da reação, conhecida por
meio do mecanismo da mesma.
Exemplos:
I.
Reação Elementar: H 2 I 2 ( g ) 2HI
Lei da velocidade instantânea: V K[H 2 ] [ I 2 ]
II.
Reação complexa:
2NO N 2O2 ( EtapaLenta)
N 2O2 O2 2NO2 ( EtapaRápida)
2NO O2 2NO2 (Re açãoGlobal )
Lei da velocidade instantânea: V K[NO]2
EXERCÍCIOS DE FIXAÇÃO
1. (EsPCEx)
A tabela abaixo indica valores das velocidades da reação (v) em três experimentos e
as correspondentes concentrações em mol/L dos reagentes X e Y em idênticas
condições.
O processo químico é representado pela equação abaixo, na qual a, b e c representam
os seus coeficientes.
aX bY cZ
A equação da velocidade desse processo é:
a)
b)
c)
d)
e)
v k[ X ]2 [Y ]
v k[ X ]
v k[Y ]
v k[ X ][Y ]2
v k[ X ][Y ]
2. (EsPCEx)
As quantidades de energia envolvidas nos processos de transformação de um alceno
em um alcano, com e sem catalisador, encontram-se representadas no gráfico
abaixo.
Sobre esses processos de transformação, são feitas as seguintes afirmações:
1.
2.
3.
4.
A reação catalisada possui uma única etapa;
A variação de entalpia é igual a 32;
As reações são exotérmicas;
A reação não catalisada possui um complexo ativado.
É correto o que se afirma apenas em
a)
b)
c)
d)
e)
1e2
1e4
2e3
2e4
3e4
3. (EsPCEx)
Para cozinhar os alimentos mais rapidamente, uma cozinheira utiliza uma panela de
pressão com os alimentos imersos em água. Ao colocar a panela sobre o fogo,
sabemos que os alimentos são cozidos mais rapidamente porque
a) O aumento da pressão no interior da panela de pressão provoca um
decréscimo na temperatura de ebulição da água em seu interior;
b) Ponto de ebulição da água que envolve os alimentos aumenta.
c) A água em seu interior se expande, diminuindo a pressão.
d) Aumento da temperatura reduz a pressão no interior da panela.
e) As paredes da panela são espessas, o que a torna um recipiente adiabático
perfeito.
4. (EsPCEx)
No processo industrial da produção de uma substância F, onde a energia total dos
produtos é menor do que a da matéria-prima A, são necessárias várias etapas,
como descritas nas equações abaixo:
(I)
AB
B
C lenta
D E
(II)
(III) E A 2F
O gráfico “energia” versus “caminho da reação” que melhor representa o processo
global de produção de F é:
5. (EsPCEx)
Com base nas equações da questão anterior, são feitas as seguintes afirmações:
I.
E é o complexo ativado da reação
II.
A e B são apenas os reagentes do processo industrial.
III.
A expressão da velocidade é dada por v k[C ][ A]2
IV.
A equação global é 2 A C 2F D .
Está(ão) correta(s) apenas a(s) alternativa(s):
a)
b)
c)
d)
e)
II e III
I e IV
IV
III
II e IV
6. (EsPCEx)
O airbag, dispositivo de segurança usado em automóveis, é inflado pelo gás
nitrogênio, produzido segundo a reação:
6 NaN3 (s) 2Fe2O3 (s) 3Na2O2 (s) 4Fe(s) 9 N 2 ( g )
No caso da expansão desse equipamento se completar com 42,0 g de gás nitrogênio,
e da velocidade de consumo do nitreto ser de 20 mols/s, o tempo necessário para
a referida expansão será:
a)
b)
c)
d)
e)
0,025
0,075
0,09
0,05
0,06
7. (EsPCEx)
Em determinada experiência, a reação de combustão total do álcool etílico está se
processando numa velocidade de 1,0 mol/min. Portanto, a velocidade de
formação do CO2, nestas condições, em mol/min, é:
a)
b)
c)
d)
0,5
1,0
2,0
3,0
8. (EsPCEx)
Num laboratório, observou-se que a velocidade de formação dos produtos através da
reação
A( g ) 3B( g ) produtos
é independente da concentração de A e fica 8 (oito) vezes maior quando dobramos a
concentração de B.
Determine a expressão da velocidade da reação, admitindo-se que K é a constante de
velocidade específica:
v k[ A][ B]3
3
b) v k[ A]
c) v k[ A]
a)
d)
v k[B]3