CINÉTICA QUÍMICA – PROFª SIMONE
Velocidade das reações e os fatores que a influenciam.
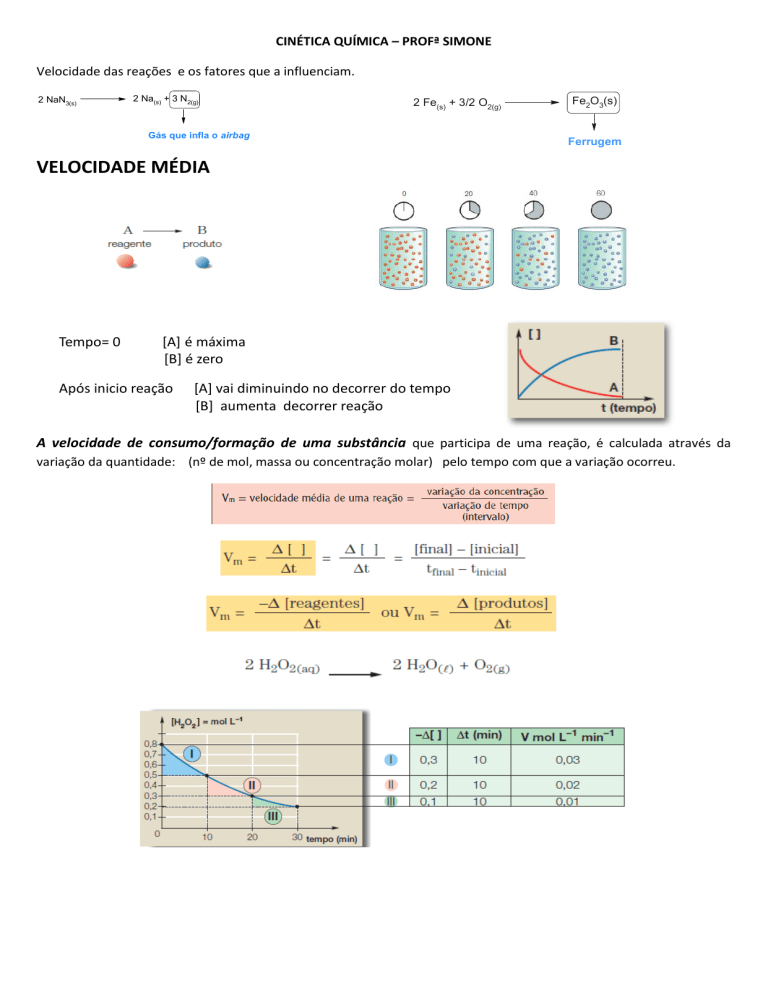
2 NaN3(s)
2 Na(s) + 3 N2(g)
2 Fe(s) + 3/2 O2(g)
Gás que infla o airbag
Fe2O3(s)
Ferrugem
VELOCIDADE MÉDIA
Tempo= 0
[A] é máxima
[B] é zero
Após inicio reação
[A] vai diminuindo no decorrer do tempo
[B] aumenta decorrer reação
A velocidade de consumo/formação de uma substância que participa de uma reação, é calculada através da
variação da quantidade: (nº de mol, massa ou concentração molar) pelo tempo com que a variação ocorreu.
TABELA
2H2O2(aq)
t= 0 min
→
Formados
formados
Formados
formados
Formados
formados
Formados
0,3mol/L
consumido
.
t=30min
formados
0,5 mol/L
consumido
.
t=20min
+ O2(g)
0,8 mol/L
consumido
.
t= 10 min
2H20(l)
0,1mol/L
consumido
.
CÁLCULOS DA VELOCIDADE DE CONSUMO E DE FORMAÇÃO:
VELOCIDADE MÉDIA DA REAÇÃO:
A+ B C+ D
Em que as letras minúsculas são os coeficientes (nº de mol) e as maiúsculas são as substâncias participantes da reação.
Vm
Exemplo:
VA
a
VB
b
VC
c
VD
d
Considere a equação abaixo:
N2 (g) + 3 H2 (g) 2 NH3 (g)
Sabendo que:[H2] inicial = 6 mol/L; [H2] final = 2 mol/L;
a) Qual a velocidade média da reação?
t = 20 min.
CONDIÇÕES PARA A OCORRENCIA DE UMA REAÇÃO:
Contato entre as partículas: (átomos, moléculas ou íons) dos reagentes.
Afinidade química: uma certa tendência natural para reagir.
Choques eficazes (colisões efetivas): a colisão entre as partículas dos reagentes deve ocorrer em
uma orientação favorável, para que as ligações existentes nos reagentes sejam rompidas.
Energia de ativação: para que uma reação aconteça, é necessário um mínimo de energia, além
daquela que os reagentes já apresentam.
No momento em que ocorre o choque em uma posição favorável, forma-se uma estrutura intermediária entre os
reagentes e os produtos denominada complexo ativado.
Complexo ativado estado intermediário (estado de transição) formado entre reagentes e produtos,
em cuja estrutura existem ligações enfraquecidas (presentes nos reagentes) e formação de novas
ligações (presentes nos produtos).
Para que ocorra a formação do complexo ativado, as moléculas dos reagentes devem apresentar energia
suficiente, além da colisão em geometria favorável. Essa energia denominamos energia de ativação (Ea).
Energia de ativação (Ea) é a menor quantidade de energia necessária que deve ser
fornecida aos reagentes para a formação do complexo ativado e, conseqüentemente, para a
ocorrência da reação.
Fatores que influenciam na velocidade de uma reação química
Reagentes sólidos: quanto mais fragmentado, maior será a
velocidade das reações
Quanto maior a superfície de contato entre os reagentes, ou seja, quanto mais pulverizado/fragmentado maior o
número de colisões entre as partículas reagentes. Isso faz com que aumente o número de colisões eficazes,
aumentando a velocidade da reação.
TEMPERATURA
Aumentado a temperatura, aumenta a energia cinética das moléculas reagentes (grau de agitação das
moléculas), o que proporciona um aumento no número de colisões e aumento do número de moléculas com energia
igual ou superior à energia de ativação, aumentado a velocidade da reação.
Exemplo:
Lavar roupas em água fria (demora mais para retirar manchas)
Lavar roupas em água quente (retira as manchas mais rapidamente)
CONCENTRAÇÃO
Aumentando a concentração (quantidade ou até mesmo a pressão de um gás) estamos aumentando o número de
choques entre as partículas reagentes, o que consequentemente aumenta a velocidade da reação.
Exemplo:
CATALISADOR
Catalisador é uma espécie química que promove o aumento da velocidade de uma reação através da diminuição da
energia de ativação. O catalisador participa temporariamente do processo, formando com os reagentes um complexo
ativado menos energético. Porém ao final da reação é completamente recuperado, sem sofrer alteração na sua
composição ou massa.
1. Um catalisador acelera a reação, mas não aumenta seu rendimento, isto é, ele produz a mesma quantidade de produto,
mas num período de tempo menor.
2. O catalisador não altera o ΔH da reação.
3. Um catalisador acelera tanto a reação direta quanto a inversa, pois diminui a energia de ativação de ambas.












