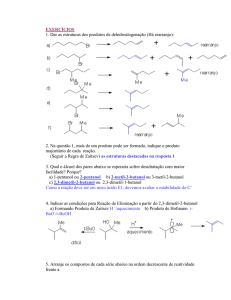
Universidade Federal de Ouro Preto
Reações de Substituição
Nucleofílica em Carbono Saturado
Aula 11
Flaviane Francisco Hilário
1
1 - Reação de Substituição Nucleofílica e
Reação de Eliminação
SUBSTITUIÇÃO
Grupo abandonador
ELIMINAÇÃO
2
2 - Reações de Substituição Nucleofílica
(SN)
Nu
+
Nucleophile
HO
+
CH3O +
CH3
R
R
X
Product
Alkyl halide
(substrate)
CH3
Cl
CH3CH2
Br
Nu
OH
CH3CH2
OCH3
X
+
Halide ion
+
Cl
+
Br
• Como são nucleófilos que substituem os halogênios, essas
reações são conhecidas como reações de substituição
nucleofílica.
3
2.1 – Tipos de mecanismos de SN
2.1.1 - Substituição Nucleofílica Bimolecular (SN2)
• Bimolecular = duas espécies estão envolvidas na etapa que
determina a velocidade da reação.
Velocidade = k . [haleto de alquila] . [nucleófilo]
Nu
+ R X
Nu
R
X
Nu R +
Produto de substituição
X
4
2.1.2 - Substituição Nucleofílica Unimolecular (SN1)
• Unimolecular = uma espécie está envolvida na etapa que
determina a velocidade da reação.
Velocidade = k . [haleto de alquila]
R+ +
R X
Nu
+
+ R
X
Nu R
Produto de substituição
5
Nucleófilos
Íon ou molécula neutra com pelo menos um par de elétrons
não ligante.
Íon hidróxido
H
O
+
Nucleophile
R
X
H
Alkyl halide
O
X
+
R
Alcohol
Leaving group
Molécula de água
H
O
H
Nucleophile
+
R
X
Alkyl halide
H
O+ R
+
X
H
Alkyloxonium ion
H2O
H
O
+
R + H3O +
X
6
Grupo abandonador
Base fraca que pode ser um íon ou uma molécula neutra relativamente
estável.
HO
H3N
+
+
CH3
CH3
Cl
Br
CH3
CH3
OH
+
NH 3
+
+
Cl
Br
7
2.1.1 - Substituição Nucleofílica Bimolecular – SN2
Velocidade relativa de várias reações SN2 de haletos de alquila
Haleto de alquila
classe
velocidade relativa
Metila
Primário
Primário
Secundário
Terciário
pequena demais
para ser medida
A velocidade de reação com um dado nucleófilo diminui com
o aumento do volume do haleto de alquila.
8
Mecanismo de reação SN2
AnInversão
inversion
configuration
deof
configuração
HO
H3C
H
+
C
Br
HO
C6H13
(R)-(–)-2-Bromooctane
Enantiomeric purity = 100%
CH3
C
CH3
Br
HC H
6 13
HO
C
H
C6H13
Br
+
(S)-(+)-2-Octanol
Enantiomeric purity = 100%
É sincronizado.
É uma reação concertada.
A configuração do produto é invertida quando comparada à
configuração do haleto de alquila quiral.
9
Inversão de Walden
Três ligações no mesmo plano
An
inversion
configuration
Inversão
de of
configuração
H3C
Cl
+
H
H3C
OH
+
SN2
H
cis-1-Chloro-3-methylcyclopentane
H 3C
H
H
H
Cl
OH
trans-3-methylcyclopentanol
Leaving group departs
from the top side.
H
Nucleophile attacks
OH from the bottom side.
Cl
10
Estado de transição
• Dura apenas 10-12s (tempo de uma vibração molecular).
11
Estrutura do substrato – SN2
Um grupo substituinte volumoso no haleto de alquila reduz
sua reatividade: impedimento estérico.
Reatividades relativas para haletos de alquila em uma reação
SN2
Haleto de metila > haleto de alquila 1ário > haleto de alquila 2ário > haleto de alquila 3ário
12
Velocidades relativas
Grupo
abandonador
13
Basicidade relativa dos íons haletos
Base mais fraca
Base mais forte
Característica de grupo abandonador
Melhor grupo
abandonador
Pior grupo
abandonador
Reatividade relativa em uma SN2
Mais reativo
Menos reativo
14
Nucleófilo – SN2
Espécies com carga negativa versus espécies neutras.
Base forte e melhor
nucleófilo
Base fraca e pior
nucleófilo
15
Efeito estérico sobre a nucleofilia
Base mais fraca
Base mais forte
Melhor nucleófilo
Pior nucleófilo
16
Solvente – SN2
Interações
íon-dipolo
entre um nucleófilo e a
água. – impedem o
nucleófilo de reagir.
SN2 é favorecida por SOLVENTE POLAR APRÓTICO (Ex.:
DMF - dimetilformamida, DMSO - dimetilsulfóxido).
17
Reversibilidade das reações SN2
18
Uma SN2 é reversível quando os grupos abandonadores são bases
de força semelhante.
19
2.1.2 - Substituição Nucleofílica Unimolecular – SN1
Ataque nucleofílico ao carbocátion
lento
Quebra
heterolítica
rápido
rápido
Transferência de próton
Quando o haleto de alquila é quiral, é obtido um par de
enantiômeros.
20
Etapa determinante
da velocidade
Carbocátion
intermediário
21
Estrutura do substrato - SN1
Haletos de alquila mais substituídos são mais reativos.
Velocidades relativas em uma SN1 de brometos de alquila com H2O
22
Estabilidade relativa de carbocátions
Reatividade relativa de haletos de alquila em uma SN1
Haleto de alquila terciário > haleto de alquila secundário > haleto de alquila primário
23
Estereoquímica da reação – SN1
24
25
H
26
Grupo abandonador
Mais reativo
Menos reativo
27
Rearranjo de carbocátion
28
Solvente – SN1
Estado de transição
Intermediário
solvente
molécula
Par iônico
íntimo
Par iônico
separado por solvente
Íons dissociados
SN1 é favorecida por SOLVENTE POLAR PRÓTICO (Ex.:
H2O, álcoois – CH3OH, CH3CH2OH.
29
3 - SN1 X SN2
• Experimentalmente sabe-se que alguns fatores influenciam
a velocidade das reações e, conseqüentemente, o
caminho (uni ou bimolecular).
• Fatores que influenciam o caminho de reação (uni ou
bimolecular):
– Estrutura do substrato
– Concentração e a reatividade do nucleófilo (somente
para SN2)
– Efeito do solvente
– Natureza do grupo abandonador
30
3.1.1 – Efeito do solvente
Solvente polar prótico
Solvente polar aprótico
Solvente polar prótico
• Ex.: ROH, H2O, RCOOH, NH3.
• Solvatam eficientemente tanto o cátion quanto o ânion.
31
EFEITO DO SOLVENTE
Solvente polar aprótico
•
•
Ex.: DMF, DMSO, DMA
Solvatam eficientemente os cátions e deixam livre os
ânions (nucleófilos).
32
Força
do
nucleófilo
Nucleófilos com átomo da mesma coluna em solventes
polares próticos: o melhor nucleófilo é o átomo que possui
maior raio atômico.
Nucleófilos pequenos são mais solvatados pelo solvente.
Os átomos maiores são mais polarizáveis.
33
Nucleófilos com átomo da mesma coluna em solventes
polares apróticos: a nucleofilicidade é igual à basicidade.
pKa Ácido Base
-9,0 H-Br
Br-
-10,0
H-I
I-
Nucleofilicidade
FCl-
basicidade aumenta
3,2 H-F
-7,0 H-Cl
34
3.1.2 – Natureza do grupo abandonador
O
O
• Carboxilatos
R
R
O-
O
O
• Sulfonatos
H3C
O
-
S
O
H3C
S
O
• Triflato
F
F
F
O
F
O
S
-
O
R
O
S
F
O
S
O
F
OCH2CH3
O
O
O
• Alconossulfonato
OCH3
O
-
R
S
OCH3
O
35
Em suma:
Fator
SN1
Substrato 3ário>2ário
(estabilidade do
carbocátion)
SN2
Metila>1ário>2ário
(impedimento estérico do
substrato)
Nucleófilo Base de Lewis fraca Base de Lewis forte
Molécula neutra
Solvente (hidrólise,
metanólise)
Solvente Polar prótico
Polar aprótico
GA
Bases fracas
Bases fracas
36
4 – Bibliografia
- SOLOMONS, G.; FRYHLE, C. Química Orgânica, vol. 1, 7 ed. Rio de
Janeiro: LTC, 2001.
- BRUICE, P. Química Orgânica, vol.1, 4 ed. São Paulo, Pearson, 2006.
37