Teoria da Ligação de Valência
Prof. Fernando R. Xavier
UDESC 2013
Princípios básicos...
• É a primeira teoria de ligação baseada no princípios
da mecânica quântica.
ĤΨ(x) = EΨ(x)
• Considera os orbitais atômicos individualizados para a formação de uma
ligação química em uma molécula.
• Pode ser considerada como a precursora da Teoria dos Orbitais Moleculares.
A molécula de H2
• Considere dois átomos de hidrogênio (Ha e Hb) separados onde a função
de onda Ψ(x) para ambos é dada por:
Ψ(x) = χA(1) χ B(2)
onde χA e χ
B
são os orbitais H1s dos respectivos átomos de hidrogênio e os
números 1 e 2 são cada um dos elétrons presentes nestes orbitais em
questão.
Ha
Hb
• Entretanto, quando os átomos Ha e Hb estiverem próximos, não há como
diferenciar espacialmente onde estarão cada um de seus elétrons. Desta
forma, sua distribuição é dada pela combinação linear das funções de
onda de cada um destes elétrons.
Ha
Hb
Ψ(x) = χA(1) χ B(2) + χA(2) χ B(1)
• Esta é a função de onda normalizada para a molécula de hidrogênio.
• A formação da ligação química pode ser descrita como o acréscimo da
probabilidade dos elétrons de cada átomo de hidrogênio estarem presentes
na região internuclear de Ha e Hb.
E formalmente...
• A interação construtiva dos termos χA(1)χB(2) + χA(2)χB(1) gera um aumento
da amplitude da função de onda global da região internuclear.
Ψ(Ha)
Ψ(Ha̶ Hb)
Ψ(Hb)
• Vale lembrar que o Princípio de Pauli deve ser respeitado,
ou seja, no momento da ligação os elétrons devem possuir
spins antiparalelos.
• Como a ligação ocorre segundo um eixo, temos uma ligação do tipo
sigma (σ).
Exemplos:
Interação do tipo s – s
z
Interação do tipo s – p
Interação do tipo p – p
z
y
z
y
x
y
x
x
Curva de energia potencial molecular
E
energia
d0
d
distância
internuclear
ε0
Curva de energia potencial molecular
E
energia
d0
d
distância
internuclear
ε0
Curva de energia potencial molecular
E
energia
d0
d
distância
internuclear
ε0
Moléculas diatômicas homonucleares
• Baseado na molécula de H2, a teoria de ligação de valência pode ser
expandida para outros sistemas eletrônicos.
• Orbitais de mesma simetria em átomos vizinhos podem parear elétrons e
formar múltiplas ligações.
Exemplo: A molécula de N2.
z
y
7N:
1s2 2s2 2p3 ou
[He] 2s2 2px1 2py1 2pz1
x
Sobreposições de orbitais:
z
z
y
z
z
y
y
y
x
Interação px - px
x
Interação py - py
p
z
z
y
y
x
Interação pz - pz
p
Fenômenos particulares
Promoção: ocorre quando um elétron é promovido a um orbital mais
energético durante a formação de uma ligação química.
• Obs.: A promoção é a acompanhada de um gasto energético porém após
as ligações químicas serem feitas a energia do sistema é amplamente
minimizada. (Não é um processo real, mas sim um fenômeno de
reorganização energética)
Exemplo: A promoção em um átomo de carbono.
6C:
1s2 2s2
2p2
promoção
px py
Estado fundamental
pz
6C:
1s2 2s1
2p3
px py
Estado excitado
pz
Elementos do segundo período ( Li até o Ne) obedecem relativamente bem
a regra do octeto porém, os períodos seguintes podem sofrer desvios.
A falha da regra do octeto
Existem casos em que a regra do octeto não se aplica, pois outros fenômenos
estão envolvidos na distribuição eletrônica das camadas de valência.
Expansão da camada de valência ou Hipervalência
Exemplos de átomos que sofrem este fenômeno:
P com 5 e- na camada de valência;
S com 6 e- na camada de valência;
Cl, Br e I com 7 e- na camada de valência;
Exemplos de moléculas:
O
O
O
H
P
H
O
O
S
O
O
– 1s2 2s2 2p6 3s2 3p3
16S
- 1s2 2s2 2p6 3s2 3p4
H
O
H
3s
15P
O
H
Cl
O
O
H
17Cl
O
3p
3d
– 1s2 2s2 2p6 3s2 3p5
• O fenômeno da hipervalência não é comum no segundo período pois estes
átomos são pequenos e não comportam mais do que 4 ligações.
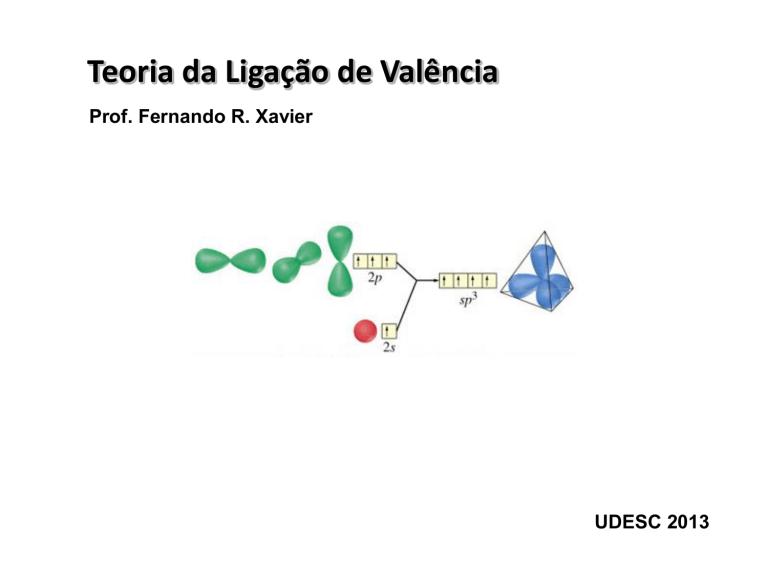
Hibridação: ocorre quando orbitais de um memo átomo se entrelaçam
para dar origem a novos orbitais híbridos).
Exemplo: Moléculas do tipo AB4 em que A é um elemento do grupo 14.
• Segundo a TLV teríamos a seguintes combinações lineares:
3 ligações do tipo χB + χA(2p)
Energias diferentes
1 ligação do tipo χB + χA(2s)
• Na prática, é sabido que as quatro energias de ligação A ̶ B são idênticas. Esta
equalização é resultado da hibridação.
• Desta forma, as combinações lineares das funções de onda são descritas por:
h = s + px + py + pz
h = s - px - py + pz
h = s - px + py - pz
h = s + px - py - pz
A união destas funções de onda (soma construtiva)
gera o sistema híbrido dito sp3.












