I.Estrutura Atômica
Compostos
Estrutura e Ligações em Moléculas
Orgânicas
Elementos
químicos
Átomos
• C, O e H
Cada elemento é caracterizado por:
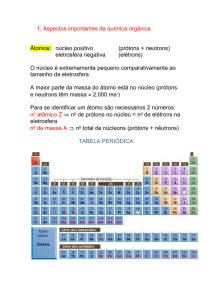
• Numero Atômico (Z), Z = prótons= elétrons (estado
fundamental).
I.Estrutura Atômica
Isótopos:
• Átomos de um mesmo elemento químico com massas
atômicas diferentes.
I.Estrutura Atômica
Camada de valência
Isótopo do carbono,
Teoria Estrutural da Química Orgânica
As premissas de August Kekulé:
a) Os átomos dos compostos
orgânicos podem formar um
numero fixo de ligações, a partir
de seus elétrons de valência.
b) Um átomo de carbono pode
utilizar um ou mais de seus
elétrons de valência para formar
ligações com outros átomos de
carbono.
Teoria Estrutural da Química Orgânica
Isômeros:
São compostos de formulas estruturais distintas, mas que
possuem a mesma formula molecular.
As propriedades físicas e químicas diferenciam entre os
isômeros constitucionais.
Ligações Químicas: A Regra do Octeto
Tipos de Ligações Químicas
Ligações Iônicas (ou eletrovalentes) – Transferência de
elétrons (atração eletrostática entre dois íons com cargas
opostas).
Ligações Covalentes – compartilhamento de elétrons.
Regra do Octeto – tendência para um átomo atingir a
configuração de estabilidade de um gás nobre (oito
elétrons, ou um duplete) na sua camada de valência mais
externa.
Exceções do octeto: Expansão com 10 ou 12 elétrons,
contração com 4 ou 6 elétrons, e os radicais e birradicais.
Estrutura de Lewis
Orbitais Atômicos e Moleculares
Funções de ondas (Ψ) são chamadas de orbitais.
Orbital - região do espaço de máxima probabilidade de se
encontrar um ou dois eletrons de uma molécula.
Estrutura de Lewis
Sobreposição de Orbitais
Orbital molecular ligante - Resulta da sobreposição de
dois orbitais da mesma fase. Podem ser representado
por σ (sigma) e π (pi).
Orbital molecular não-ligante - Resulta da sobreposição
de dois orbitais em fases opostas. Podem ser
representado por σ* (sigma) e π* (pi).
Combinação de orbitais
Atômicos
Sobreposição de Orbitais
Orbital Molecular do Hidrogênio
Ex, Molécula de H2
Estado de alta energia
(menos estabilidade)
Estado de baixa energia
(mais estabilidade)
Ligação Sigma (σ)
Ligação pi (π)
Consiste na sobreposição de orbital ao longo do eixo
internuclear. É considerada mais forte do que uma ligação
π (pi).
Formação da ligação: molécula H2
Formada pela sobreposição
orbitais p paralelos
Formação da ligação: molécula HF
Distribuição eletrônica dos
átomos
A
interpenetração
ocorre ao longo do eixo,
sendo
denominada
ligação sigma (σ) do tipo
s+s.
lado-a-lado
Representação dos Orbitais
Formação da ligação
A interpenetração ocorre ao longo do
eixo, sendo denominada ligação sigma (σ)
do tipo s+p.
de
dois
Formação da ligação: molécula F2
Formação da ligação: molécula O2
Distribuição eletrônica dos átomos
Representação dos Orbitais
Formação da ligação
A interpenetração ocorre ao
longo
do
eixo,
sendo
denominada ligação sigma (σ)
do tipo p+p.
Formação da ligação: molécula N2
Representação dos Orbitais
Representação dos Orbitais
Formação da ligação
Ocorre pela interpenetração de orbitais incompletos do tipo p
contidos em eixos paralelos. Ligação pi (π ) do tipo p+p.
Hibridização do Carbono
Consiste na fusão de orbitais atômicos incompletos, que se
transformam originando novos orbitais, em igual número. Esses
novos orbitais são denominados Orbitais híbridos.
Existem três tipos de hibridização, que são: sp3,sp2, sp.
a) Hibridização sp³: Ocorre
quando o carbono possui as
quatro ligações simples.
Exemplo CH4
Estado
Fundamental:
Estado Ativado
(Excitado):
Estado
Híbrido:
Hibridização do Carbono
Representação dos níveis de energia dos orbitais originais
e dos orbitais híbridos sp³ do átomo de carbono.
Hibridização do Carbono
Molécula do metano – CH4
σ
σ
σ
σ
Molécula do etano – C2H6
σ
σ
σ
σ
σ
σ
Hibridização do Carbono
b) Hibridização sp²: Ocorre quando o carbono possui uma
única ligação dupla. Exemplo C2H4
Resumo de Hibridização do Carbono
Hibridização do Carbono
c) Hibridização sp: Ocorre quando o carbono possui duas
ligações duplas ou uma ligação tripla. Exemplo C2H2
Carga Formal (CF)
Em que,
CF = V – (L + 1/2 S)
V: nº de elétrons de valência no átomo livre;
L: nº de elétrons de valência não ligante do átomo;
S: nº de elétrons de valência ligante do átomo.
Carga Formal (CF)
Carga Formal (CF)
Estrutura de Ressonância
Exemplo,
a) Determine a carga formal do nitrogênio do nitrometano
(CH3NO2 ).
Elétrons de Valência do Nitrogênio= 5
Elétrons envolvidos em estruturas de ressonância são
ditos deslocalizados.
Exemplo,
Elétrons ligantes do nitrogênio= 8
O
Elétrons não ligante do nitrogênio = 0
O
O
O
O
O
8
CF 5 (0 ) 1
2
b) Determine a carga formal para o átomo de oxigênio, com
uma única ligação no nitrometano
Elétrons de Valência do oxigênio= 6
Elétrons ligantes do oxigênio= 2
Elétrons não ligante do oxigênio = 6
2
CF 6 (6 ) 1
2
Estrutura de Ressonância
Estrutura de Ressonância
Molécula do Íon acetato
Híbrido de ressonância é um misto dos contribuintes
das estruturas de ressonância, diferem apenas na
localização de seus pares de elétrons livres e elétrons π.
Estrutura de Ressonância
Estrutura de Ressonância
Estrutura de Ressonância
Estrutura de Ressonância
Estrutura de Ressonância
Estrutura de Ressonância