Resumo de química – 12 de abril de 2017. (Apostila 1 e 2)
O que a Química estuda? A química estuda as propriedades, transformações e reações que
acontecem DENTRO da matéria.
CONSTITUIÇÃO DA MATÉRIA:
Átomo: Menor parte da matéria.
Molécula: Um conjunto de átomos, forma uma molécula. Exemplo: H2O (Dois átomos de
hidrogênio e um átomo de oxigênio, ou seja, o conjunto de 3 átomos, formou a molécula da
água).
Matéria: Conjunto de moléculas. Pode ser calculada em MASSA (quilogramas, gramas, etc.) e
VOLUME (Quilolitros, litros, etc.).
1. Uma parte da matéria é chamada de CORPO.
2. Quando uma matéria é modificada a fim de se tornar algo pronto, é chamado de
OBJETO.
EM TUDO HÁ QUÍMICA, não há exceções.
Gravidade: É a força que os corpos exercem uns sobre os outros. Exemplo: Gravidade da Terra
é 9,8.
Diferença de PESO e MASSA: Quando você vai medir seu “peso”, na verdade, você estará
medindo sua MASSA. O peso é o valor da massa multiplicado pela força gravitacional
(gravidade).
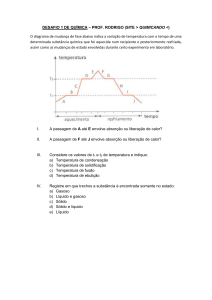
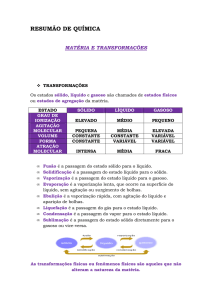
ESTADOS DA MATÉRIA: (Tentei fazer um esquema, mas não consegui, mals)
Sólido (moléculas extremamente juntas)
Possui uma forma, já que as moléculas estão
juntas
Líquido (moléculas separadas)
Gasoso (moléculas extremamente separadas)
Transformações:
SETA AZUL: FUSÃO: Passagem do estado sólido para o líquido (exemplo: gelo se
descongelando).
SETA ROXA: VAPORIZAÇÃO (Passagem do estado líquido para gasoso). Há três etapas:
Evaporação: Primeira etapa: Baixa energia – Água vai esquentando.
Ebulição: Segunda etapa: Mais energia – Água se evapora.
Calefação: Terceira etapa: MUITA energia – Água se evapora MUITO rápido.
SETA AMARELA: CONDENSAÇÃO (ou liquefação): Água no estado gasoso, se esfria e se torna
líquida.
SETA VERMELHA: SOLIDIFAÇÃO: Água no estado líquido vai congelando.
SETA PRETA: SUBLIMAÇÃO: Água no estado sólido se transforma em estado gasoso, SEM
PASSAGEM PRO ESTADO LÍQUIDO, muita energia (calor).
SETA VERDE: RESSUBLIMAÇÃO (ou sublimação): Passagem do estado gasoso para sólido, sem
passagem pro estado líquido.
PROPRIEDADES DA MATÉRIA:
Propriedades gerais:
INÉRCIA: Capacidade do corpo em permanecer em movimento ou em repouso
conforme a situação.
MASSA: Está ligada à inércia. Mede a resistência que tem um corpo.
IMPENETRABILIDADE: Duas matérias não podem ocupar o mesmo espaço ao
mesmo tempo.
DIVISIBILIDADE: Toda matéria pode ser dividida até chegar em um átomo,
porção menor de uma matéria.
COMPRESSIBILIDADE: Propriedade em que, sob outras forças, esta matéria
pode diminuir. (Ver na apostila, é complicado).
ELASTICIDADE: Propriedade em que um corpo pode se esticar ou comprimir e
depois ele voltará na sua forma original.
INDESTRUTIBILIDADE: Matéria não pode ser destruída, e sim, transformada.
(Exemplo: Transformação de madeira em cinzas, vai estar queimando a
madeira e formará outra matéria, que é a cinza).
Propriedades funcionais: Cada matéria se enquadra em um grupo com suas
características. (Não é importante, acho).
Propriedades específicas: DIVIDE-SE em 3 ramificações (Propriedades organolépticas,
físicas e químicas).
Propriedades organolépticas: Propriedades relacionadas aos SENTIDOS DO CORPO.
COR (visão), SABOR (paladar), ODOR (olfato), TEXTURA (tato).
Propriedades físicas: TRANFORMAÇÕES (físicas, “por fora”):
DUREZA: Resiste ao corte, ou seja, somente uma matéria mais dura pode “cortar”
outra. (Exemplo da apostila: Para que um piso não seja riscado por areia, é preciso que
ele tenha uma DUREZA SUPERIOR do que a areia).
DENSIDADE: Relação de massa e volume de uma matéria.
TENACIDADE: Resistência a um choque (impacto). Quanto mais tenaz, mais resistente.
BRILHO: Propriedade que reflete a LUZ em uma matéria. Quando uma matéria não há
brilho, não é necessariamente que ela seja opaca. (Ver na apostila se não entenderam,
é complicado).
Propriedades químicas: TRANFORMAÇÕES (químicas, “por dentro”): Reação de uma
matéria quando “se relaciona” com outra.
Apostila 2:
Substâncias e Misturas:
Substância Pura: Um tipo de matéria que apresenta a mesma composição, ou seja, composta
por partículas iguais. Para diferenciar uma substância pura da outra, basta saber as três
propriedades: TEMPERATURA DE FUSÃO, EBULIÇÃO e DENSIDADE.
Pode se dividir em dois grupos:
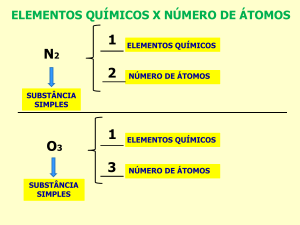
Simples: Formada por apenas um ÚNICO elemento químico. Exemplos: Oxigênio (𝑂2 ),
Hidrogênio (𝐻2 ).
Composta: Formada pela combinação de elementos químicos diferentes. Exemplos:
Água (𝐻2 O) e Gás Carbônico (𝐶𝑂2 ). A água é formada por dois átomos de hidrogênio e
um de oxigênio. O Gás Carbônico é formado por um átomo de carbono e dois átomos
de oxigênio.
Mistura: É a união de duas ou mais substâncias diferentes. Ela apresenta características físicas
(ponto de fusão, ponto de ebulição, densidade, tenacidade etc.) diferentes e variáveis. Além
disso, as misturas não têm composição definida.
Pode se dividir em dois grupos:
Mistura homogênea: Mistura de substâncias e elas ficam invisíveis a olho nu.
Exemplos: Água e sal (se forem bem misturados, o sal vai desaparecer), Água e álcool,
atmosfera (ninguém vê o oxigênio, hidrogênio, gás carbônico no ar). São chamadas de
MONOFÁSICAS (quando as substâncias se dissolvem e ninguém vê que está
misturado).
Mistura heterogênea: Mistura de substâncias em que elas não se separam, ou que elas
ficam visíveis a olho nu. Exemplo: Água e areia (embora forem misturadas, a água vai
mudar de cor), água e óleo (nunca misturarão), etc. São chamadas de POLIFÁSICAS
(pois possuem duas faces, ou seja, quando uma substância não se dissolve na outra).
Gráfico de substâncias puras:
(Sempre em escadinha, pois as
temperaturas de ebulição e fusão são constantes e fixas).
Gráfico de mistura:
(Os gráficos não são feitos por “escadinhas”, pois as
temperaturas de fusão e ebulição não são constantes nem fixas).
Processos de separação de misturas:
Modos para separação de misturas heterogêneas formadas por SÓLIDOS (apenas):
Catação: Processo em que se usa mãos ou pinça para catar grãos. Exemplo: Retirada
de feijão podre, seleção de feijão).
Ventilação: Uma corrente de ar passa pela mistura o que é mais leve, assim as partes
mais pesadas se separarão das mais leves.
Levigação (arraste): Água corrente passa sobre a mistura, levando o que é mais leve.
Exemplo: Garimpo.
Separação magnética: Separar minérios de ferros presentes em uma mistura. Uso de
ímã (geralmente, não sempre).
Peneiração: Passar a peneira para separar um sólido mais leve de um grosso. Exemplo:
Separar areia grossa da fina.
Flotação (flutuação): Uso da propriedade: DENSIDADE. Uso de um líquido de
densidade intermediária, ou seja, seja mais denso que um sólido e menos que outro.
Exemplo:
(Separação de areia e serragem por flotação, colocando
água para separá-los, conforme a densidade de cada um).
Modos para separação de misturas HETEROGÊNEAS com um componente SÓLIDO e outro
LÍQUIDO (ou gasoso):
Decantação (ou sedimentação): A mistura ficará em repouso e, a matéria mais densa
vai ficar no fundo e o menos denso ficará em cima. Exemplo: Processo para “filtrar” a
água do barro, como o barro é mais denso, ele ficará no fundo.
Centrifugação: Processo utilizado para acelerar o processo de decantação (anterior).
Usa um aparelho chamado centrífuga, que acelera o processo.
Filtração: Quando a mistura passa por um filtro poroso, as partículas maiores ficam
retidas.
Modos utilizados para separação de misturas HOMOGÊNEAS com um componente SÓLIDO e
outro LÍQUIDO:
Cristalização: Ferver o líquido, então o líquido evaporará e sobrará o sólido. (Processo
utilizado se você quiser SOMENTE o componente sólido, porque o líquido evaporará).
Destilação simples: Uso de um aparelho específico, em que o líquido passa por um
processo de ebulição e evapora, mas é guardado em um outro recipiente (onde é
resfriado) e então volta a ser líquido. (A diferença desse processo com o de
cristalização, é que esse você pode ter os dois componentes).
Modos utilizados para separação de misturas HOMOGÊNEAS com dois componentes
LÍQUIDOS:
Destilação fracionada: Os líquidos devem possuir temperaturas de ebulição
diferentes, pois um deles deve passar pelo processo de ebulição, enquanto o outro
ainda não evapora, por isso precisa de temperaturas de ebulição diferentes. Exemplo:
Obter subprodutos do petróleo.
Fenômenos FÍSICOS e QUÍMICOS:
Mudanças físicas: Mudanças de fases, não alteram a estrutura da matéria. Exemplo: Recortar,
amassar um papel. O papel continua tendo os mesmos elementos dentro dele, o que muda é o
formato, não a estrutura.
Exemplos:
Precipitação de chuvas – MUDANÇA DE FASES (gasoso para líquido – condensação).
Obtenção do sal por meio da água do mar – Processo de CRISTALIZAÇÃO, a estrutura
do sal não tinha se misturado com a da água, se a água for evaporada, restará
somente o sal.
Quebrar um vidro, embora o vidro tenha se repartido, não se mudou nada de dentro
(ou seja, a estrutura).
Evaporação do álcool – MUDANÇA DE FASES (Líquido para gasoso – vaporização).
Laminação do aço.
Mudanças químicas: Mudanças que transformam uma substância em outra, pois alteram a
estrutura da matéria. Exemplo: Pintar um papel. O papel não terá a mesma cor, portanto,
mudará sua estrutura.
Exemplos:
Queimadas – Transformação de madeira em cinzas, muda a estrutura.
Corrosão de uma chapa de ferro ou de um prego;
Ferrugem em metais;
Queima de fogos de artifício;
Amadurecimento de frutas;
Revelação de fotografia – mudará a cor, etc.
Combustão da gasolina, é a queima da gasolina, vai transformá-la em outro elemento.
As mudanças químicas podem ser reconhecidas por três dicas:
Liberação de gases;
Mudança de cor (como pintar um papel, ou pintar uma parede);
Formação de precipitado (quando se coloca um bicarbonato de sódio na água,
aparecerá bolhas. Ou quando se põe limão no leito, vai aparecer partículas).
As transformações e energia:
Normalmente, os fenômenos químicos liberam ou absorvem mais energia que os fenômenos
físicos, pois o fenômeno químico altera mais a estrutura da matéria.
A fotossíntese é um fenômeno químico, pois absorve o GÁS CARBÔNICO e o transforma em
OXIGÊNIO.
A chuva ácida é um fenômeno químico, porque substâncias químicas prejudiciais ao ser
humano se misturam ao vapor d’água, transformando e mudando a estrutura da chuva.
Se querem resolver exercícios, é só entrar nas provinhas dos dias:
14 de fevereiro de 2017 (apostila 1);
22 de março de 2017 (apostila 2).