QUÍMICA GERAL
UNIDADE 1: Introdução ao Estudo da Química
1. Aspectos Históricos
A
Ciência, como um conjunto organizado de conhecimentos, apresenta-se dividida em várias
disciplinas, entre elas a Química, que estuda a natureza da matéria, suas propriedades, suas
transformações e a energia envolvida nesses processos.
O termo química tem origem no latim “chimica”, palavra que deriva de “alchimia”, modificação da
expressão árabe “al kêmiyâ”, cujo significado é “grande arte dos filósofos herméticos e sábios da
Idade Média.”
É impossível dizer precisamente quando a química começou, na realidade, a idade da
química é a idade do mundo. Ela sempre existiu, no entanto, seu surgimento é atribuído à
descoberta do fogo, onde as condições de vida e segurança do homem primitivo foram aprimoradas.
Apesar de se ter conhecimento de manifestações químicas muito antes da Idade Média
(preparo do bronze e do vidro pelos egípcios, cerca de 3000 a.C.), foram os alquimistas (de 300 a
1400) que contribuíram de forma acentuada para o desenvolvimento do que constitui a ciência
Química.
Os alquimistas surgiram na Alexandria por espaço de três séculos. Por ordem de um
imperador, chamado Dioclesiano, por volta do ano de 292 d.C., os escritos sobre a alquimia foram
queimados. Os alquimistas ressurgiram no Oriente e lá, destacava-se, Abu Musa Jabir ibn Hayyan al
Surffi, conhecido como Geber. É do Oriente que veio “O Livro dos Segredos”, livro este, tomado
por base pelos ocidentais.
Na Idade Média, os alquimistas realizaram uma busca sem sucesso pela “pedra filosofal”
(substância que seria capaz de transformar qualquer metal em ouro) e pelo “elixir da longa vida”
(um tipo de infusão capaz de curar todos os tipos de doenças e proporcionar a vida eterna). Os
alquimistas não obtiveram sucesso em sua busca, mas introduziram e aperfeiçoaram técnicas de
metalurgia; sintetizaram várias substâncias, entre elas: medicamentos, ácidos e sais; isolaram outras
substâncias, além de terem identificado várias propriedades dos metais e registrado grande número
de experimentos em suas observações.
Com o surgimento da Iatroquímica, ou Química Medicinal, cujo desenvolvimento se deve
ao alquimista e médico suíço Theophrastus Bombastos von Hohenheim, mais conhecido como
Paracelsus, pioneiro na utilização de produtos químicos puros para tratar doenças, a química ganha
um novo significado.
A partir do século XVII, a ciência se transforma, tornando-se mais experimental e menos
filosófica, pois, multiplicavam-se as observações e as experiências; os fenômenos eram
classificados; procuravam-se vínculos entre esses fenômenos e eram elaboradas hipótese
explicativas.
Dentre os cientistas com esta nova proposta, destacava-se o francês Antoine Laurent
Lavoisier (1743 - 1794), com a publicação, em março de 1789 de seu Tratado Elementar de
Química, esta é considerada a certidão de nascimento da Química Moderna e por seu trabalho,
Lavoisier é considerado o pai da química que conhecemos hoje em dia.
Para saber mais sobre o tema, leia um dos livros:
CHAGAS, Aécio Pereira. Como se Faz Química: Uma Reflexão sobre a
Química e a Atitude do Químico. Campinas – SP: Unicamp, ISBN: 85268, 1992.
FELTRE, Ricardo. Química: Química Geral. São Paulo – SP: Moderna.
Vol. 1, 4ª ed., 1995, 467p.
Ou acesse o site: www.vestibular/historiadaquímica.com.br
1.1. A Importância da Química
Podemos dizer que tudo à nossa volta é química, pois todos os materiais que nos cercam
passaram ou passam por algum tipo de transformação. Assim, a química está presente nos produtos
de limpeza, nas roupas, nos alimentos, nos meios de transporte, nos remédios, em fim, tudo o que
nos cerca é química e até nos mesmos somos química.
Contudo, é comum ouvirmos comentários que depreciam essa ciência, relacionando-a a
desastres ecológicos, poluição, envenenamentos, entre outros. Estes fatos, infelizmente, encobrem
as importantes conquistas do homem através do conhecimento químico. Na verdade, o problema
não está na Química, mas no seu uso, ela em si, não é má nem boa, tudo depende de quem a utiliza,
pois ainda são muitos aqueles que, movidos por interesses pessoais, utilizam-na de forma
inadequada.
Mudar este papel não é apenas trabalho do químico, mas de toda a sociedade na busca pela
melhoria da qualidade de vida e a coexistência harmoniosa entre o homem e o meio ambiente.
2. Conceitos Fundamentais
A matéria é definida como tudo aquilo que tem massa e ocupa um lugar no espaço. Desta
forma, podemos dizer que tudo aquilo que existe é matéria, pois se existe, tem uma certa massa,
seja ela maior ou menor, se tem massa, ocupa um lugar no espaço. Uma porção limitada da matéria
forma um corpo, se este corpo se presta a um determinado fim, é chamado de objeto.
Existem vários tipos de objetos, constituídos por corpos e estes por tipos diversos tipos de
matéria. Os diferentes tipos de matéria são chamados de substâncias.
Veja os exemplos:
Um copo de vidro – o copo é um objeto (se presta a um determinado fim); a matéria, o tipo
de substância que forma o copo, é o vidro; se o copo for quebrado, um pedaço do vidro será um
corpo (uma porção limitada da matéria).
Uma cadeira de madeira – a madeira é a matéria que forma a cadeira; uma tábua é um corpo
feito de madeira (é uma porção limitada da matéria); a cadeira é um objeto (se presta a um
determinado fim);
Nesses exemplos, observamos que a matéria pode ser transformada em um corpo e um
corpo em um objeto, para que isto aconteça, é necessário que se gaste energia. Assim, podemos
conceituar energia como tudo aquilo que pode modificar a matéria, provocar ou anular movimentos
e ainda causar sensações. Suponha o exemplo de uma hidrelétrica:
A água represada possui energia potencial; quando as comportas são abertas, a água passa a
movimentar-se e sua energia potencial é transformada em energia cinética. A queda da água
provoca o movimento das turbinas, transformando a energia cinética em energia mecânica; o
movimento das turbinas converte a energia mecânica em energia elétrica, que é transportada por
fios até as nossas casas. Em nossa casa, a energia elétrica pode ser transformada em luminosa
(uma lâmpada acesa); calorífica (um ferro elétrico); mecânica (um ventilador); entre outras
formas.
Se você prestou atenção, em nenhum momento foi mencionado que a energia era criada ou
destruída, isto constitui o que chamamos de Princípio de Conservação da Matéria e Energia – a
matéria e a energia não podem ser criadas nem destruídas, apenas são transformadas de uma forma
em outra. Assim, quando queimamos o papel, não estamos destruindo o papel, ele está sendo
transformado em cinzas, fumaça e liberando energia na forma de calor, não está sendo destruído,
está sendo transformado de uma forma em outra.
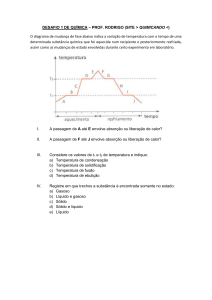
3. Fenômenos ou Transformações
Todo e qualquer acontecimento da natureza é chamado de fenômeno e pode ser classificado em:
Físico – não modifica a natureza do material, pois as entidades não são alteradas, ou seja, a
substância continua sendo a mesma. Como por exemplo:
O derretimento do gelo - é um fenômeno físico pois, o gelo é feito de água e quando
derretido, continua sendo água, porém sua forma de agregação foi modificada, pois passou
do estado sólido para o estado líquido.
A quebra de um material, ou quando rasgamos o papel - ele não deixa de ser o que era
antes, então, também constitui um fenômeno físico, pois a substância continua sendo a
mesma, apenas a sua forma foi modificada.
Químico – modifica a natureza do material, formando uma nova substância, pois as entidades
são alteradas. Os fenômenos químicos também são chamados de reações. Exemplos:
Quando queimamos o papel, ele será transformado em cinzas, fumaça e irá liberar energia
na forma de calor, isto constitui um exemplo de fenômeno químico, pois modificou a
natureza do material, formando uma nova substância. As entidades foram alteradas.
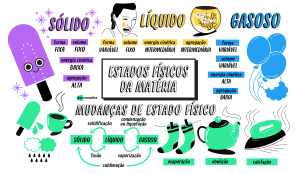
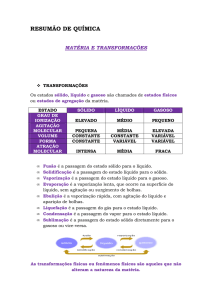
4. Estados Físicos da Matéria
Uma das propriedades da matéria facilmente observável, e de muita utilidade, é o estado
físico, ou fase de agregação. Conforme as condições em que se encontram, as substâncias podem se
apresentar na fase sólida, líquida ou gasosa.
O estado sólido pode ser reconhecido por ter forma rígida e volume constante, que muda
muito pouco com a alteração da pressão, pois as partículas se encontram compactadas numa rede
regular e não têm liberdade de movimento, têm apenas vibrações discretas, incapazes de alterar a
forma da substância.
O estado líquido apresenta volume constante, mas é um fluído, ou seja, toma a forma do
recipiente que o contém, não tem forma própria, pois os átomos e as moléculas estão dispostos ao
acaso, e não numa rede regular.
Num gás, a forma e o volume são variáveis, o gás se expande ou se contrai muito
facilmente, pois há muito espaço entre suas entidades. Veja a figura 1, ele mostra o arranjo das
entidades nos três estados de agregação da matéria.
Sólido
H2O(s)
Gasoso
Líquido
Δ
H2O(l)
Δ
H2O(g)
Figura 1: Representação dos estados de agregação da matéria - água (sólido, líquido e gasoso)
Na figura 1, onde observamos as características dos três estados de agregação,
exemplificamos a água, que muda de fase de acordo com o aquecimento, representado pelo símbolo
Δ. Veja na representação, o arranjo das moléculas de água nas diferentes fases e como este arranjo
explica as propriedades físicas que observamos na água ou em qualquer outra substância, de acordo
com a fase de agregação em que se encontram.
4.1. Mudança de Fase de Agregação
Imagine um bloco de gelo, se ele for colocado fora da geladeira, ele recebe energia na forma
de calor, pois a temperatura ambiente ( ~25ºC ), é uma temperatura suficiente para provocar uma
mudança de fase no gelo. A medida que o sólido é aquecido, a energia das partículas constituintes
vão aumentando e as entidades que formam o sólido passam a vibrar de forma cada vez mais forte,
até que conseguem quebrar a estrutura do sólido, assumindo a forma de um líquido.
Se o líquido continuar sendo aquecido, as entidades passaram a vibrar de tal forma até que
possam se livrar das forças de atração umas com as outras, e cada molécula fica afastada das demais
e movimenta-se com muita velocidade, é o estado gasoso.
Essas mudanças recebem denominações especificas, como mostra a figura 2.
Sublimação
Fusão
sólido
Vaporização
líquido
Solidificação
gasoso
Condensação
Ressublimação
Figura 2: Representação e denominações das mudançasdos de estado de agregação da matéria
De acordo com a figura 2, percebemos que um sólido pode receber calor e passar para o
estado líquido – é a fusão. Se o líquido continuar sendo aquecido, ele pode passar para o estado
gasoso – é a vaporização. Se o vapor for resfriado, ele passa do estado gasoso para o estado líquido
– é a condensação. Se o líquido for resfriado, ele passa para o estado sólido – é a solidificação. Se
ocorrer um aquecimento brusco, excessivo, o sólido pode passar diretamente para o estado gasoso
sem formação de líquido, esta mudança é denominada sublimação. De forma inversa (um
resfriamento brusco), pode transformar determinadas substâncias do estado gasoso para o sólido
sem que haja a formação de líquido, teremos então, uma ressublimação.
4.2. Substância Pura e Misturas: Diferença Prática
As substâncias apresentam propriedades chamadas de propriedades especificas –
propriedades que dependem do tipo de matéria. São exemplos de propriedades específicas: a
dureza, a maleabilidade, a ductilidade, a densidade, o calor específico, o ponto de fusão, o ponto de
ebulição, entre outras.
Quando a temperatura de fusão e a temperatura de ebulição de uma substância são
constantes, temos um comportamento que caracteriza uma substância pura. Portanto, durante a
mudança de estado físico de uma substância pura, a temperatura permanece constante,
caracterizando o ponto de fusão (PF - temperatura fixa e determinada, a certa pressão, onde o
sólido se funde) e o ponto de ebulição (PE – temperatura fixa e determinada, a certa pressão, onde
o líquido é vaporizado).
A quantidade de calor utilizada pela substância para que ocorra a mudança de estado, recebe
o nome de calor latente, é utilizada apenas para provocar a mudança de estado e não produz
aquecimento. O calor que provoca aumento de temperatura num corpo é chamado de calor sensível.
Para elevarmos em 1ºC a temperatura de 1g de água, necessitamos de 1 caloria, em outras palavras,
o calor específico da água é de 1cal/gºC.
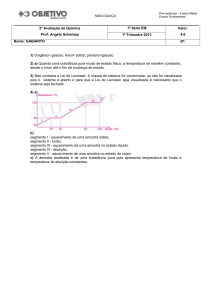
De acordo com a figura 3, observamos
que,
toda
substância,
em
temperaturas
inferiores ao ponto de fusão, apresenta-se no
T (ºC)
L+V
PE
estado sólido. O sólido pode receber calor
Líq
(sensível) até atingir o ponto de fusão. Durante
a fusão, a substância irá passar do estado
Vap
S+L
PF
sólido para o estado líquido sem que haja
Sól
mudança de temperatura (calor latente). Após
Tem (min)
o ponto de fusão, toda substância apresenta-se
no estado líquido. Se o líquido receber calor Figura 3: Representação do comportamento de uma
(sensível), pode atingir o ponto de ebulição.
substância
No ponto de ebulição, a substância irá passar do estado líquido para o estado gasoso em temperatura
constante (calor latente). Após o ponto de ebulição, toda substância se encontra no estado gasoso.
Vale lembrar que há uma diferença entre vapor e gás. Entende-se por vapor uma substância
que, na temperatura ambiente, encontra-se no estado sólido ou líquido e recebe calor até vaporizar.
Para voltar ao estado inicial (sólido ou
líquido), basta-se resfriar o vapor, é uma
Mistura
T (ºC)
Vap
condensação. Já um gás, é uma substância que
na temperatura ambiente, já se encontra no
PE
L+V
estado gasoso. Para passar para o estado líquido,
o gás deve ser resfriado e submetido a elevadas
condições de pressão, esse tipo de condensação
Líq
PF
S+L
Sól
recebe o nome de liquefação.
Tem (min)
Ao observarmos o comportamento de
uma
mistura
quando
submetida
a
um Figura 4: Representação do comportamento de uma
aquecimento, percebemos que ela não apresenta
mistura
um ponto de fusão e de ebulição constante, como mostra a figura 4. No entanto, há misturas que não
seguem essa regra. As misturas eutéticas apresentam temperaturas de fusão constante; as misturas
azeotrópicas apresentam temperatura de ebulição constante. Observe este comportamento e alguns
exemplos destes tipos de mistura na figura 5.
Misturas Eutéticas
T (ºC)
Misturas Azeotrópicas
Vap
PE
L+V
T (ºC)
Vap
L+V
PE
Líq
Líq
S+L
PF
PF S + L
Sól
Sól
Tem (min)
Tem (min)
Figura 5: Representação do comportamento de uma mistura eutética e de uma mistura azeotrópica
5. Substâncias
São os diferentes tipos de matéria. As substâncias são chamadas de puras porque apresentam
propriedades constantes e definidas, podendo ser classificadas em:
Simples – formadas por átomos de um único elemento químico. Ex: Cl2, O2, H2, He.
Compostas – formadas por átomos de mais de um elemento químico. Ex: NaCl, H2O.
Em algumas situações, átomos de um mesmo elemento, podem formar substâncias simples
diferentes, este fenômeno é chamado de alotropia. Veja os principais elementos que têm esta
capacidade e suas respectivas fórmulas alotrópicas nas figuras de 6 a 9:
Carbono
*
Diamante – é a substância Grafite: – é um sólido
Fulereno – é bem menos duro que o
mais dura da natureza e
mole; lubrificante e
diamante; solúvel em solventes
não conduz a eletricidade conduz a eletricidade.
orgânicos e utilizado no tratamento
do câncer.
Figura 6: Formas alotrópicas do carbono
Oxigênio
Oxigênio (O2) – inodoro e incolor, sendo o Ozônio (O3) – levemente azulado, poluente na
responsável pela vida animal e vegetal.
baixa atmosfera e utilizado como bactericida.
Figura 7: Formas alotrópicas do oxigênio
Fósforo
Fósforo branco (P4) – tem cheiro de alho, é Fósforo vermelho (Pn) – é um pó inodoro,
tóxico, forma cristais que fundem a 44ºC, na funde a 72ºC, não reage na presença da luz,
presença da luz, transforma-se em fósforo não é tóxico e queima em atmosfera de
vermelho.
oxigênio somente por aquecimento.
Figura 8: Formas alotrópicas do fósforo
Enxofre
Enxofre rômbico
Enxofre monoclínico
A substância simples enxofre apresenta-se como um sólido amarelo e pode ser encontrado
em estado livre (S8). É encontrado combinado a certos minerais na forma de sulfetos ou
sulfatos. É largamente utilizado na fabricação de ácidos, da pólvora e de inseticidas.
Figura 9: Formas alotrópicas do enxofre
6. Misturas
É a reunião de duas ou mais substâncias sem que haja reação entre elas. As misturas podem
ser classificadas em:
Homogêneas ou soluções – apresenta apenas uma fase, neste caso, a mistura apresenta
apenas uma característica ao longo de sua extensão, ou seja, apresenta apenas um
aspecto, não sendo possível distinguir seus componentes.
Heterogênea – apresenta mais de uma fase, apresenta mais de uma característica ao
longo de sua extensão, sendo possível distinguir os seus componentes, às vezes apenas
com o uso de microscópios.
Cada aspecto distinto de uma mistura que pode ser observado é chamado de fase. As
misturas podem ser: monofásicas, bifásicas, trifásicas e polifásicas.
Para saber mais sobre o tema, leia um dos livros:
FELTRE, Ricardo. Fundamentos da Química Geral. São Paulo – SP:
Moderna. Vol. Único, 3ª ed., rev. e ampl., 2004, 740p.
SARDELLA, Antônio. Curso Completo de Química. São Paulo – SP:
Ática. Vol. Único, 3ª ed., 2002, 751p.
RUSSEL, John B. Química Geral. São Paulo - SP: Makron, 2ª ed,
1994.