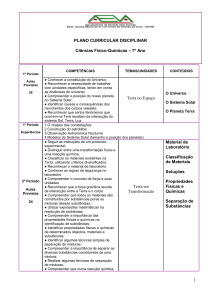
Transformações da matéria
2
A química é a ciência que estuda a matéria e suas transformações. Mas afinal o que é matéria? Por
definição, é tudo que tem massa e ocupa lugar no espaço. Portanto, a água, a terra, as árvores e o ar
são exemplos de matéria que podem ser distinguidos pela sua composição e pelas propriedades.
Substância “pura” e mistura
Na ciência, é necessário saber exatamente sobre o que estamos falando, por isso antes mesmo de
começar a estudar a matéria de um ponto de vista químico, precisamos saber algo sobre a sua
composição. Precisamos saber, também, se uma determinada “amostra” é uma única substância ou
é uma mistura de substâncias.
2.1. O que é uma amostra?
Na prática, é difícil distinguir entre uma substância e uma mistura sem a realização de
medidas em um laboratório. Por isso, vamos usar de um exemplo cotidiano para discutir esse
conceito.
Nas embalagens de diversos produtos, e por meio deles, o público em geral, não hesita em
descrever uma mistura complexa como a água mineral como "algo puro". A três anos atrás, a
revista Exame.com publicou a seguinte matéria:
“Água mais pura do mundo chega ao Brasil.
São Paulo - Chega ao Brasil neste mês a água Voss, considerada a mais pura do mundo.
Importada pela Casa Flora, a Voss brota naturalmente de uma fonte no sul da Noruega,
no deserto gelado, sob uma formação rochosa protegida do ar e de qualquer tipo de
contaminação externa. A marca possui quantidades reduzidas de minerais e
sódio......24/01/2012”
2.2. Considerando seus conhecimentos em química e o texto publicado na revista Exame.com, a
água Voss é pura como a propaganda tenta vender? Explique sua resposta.
2.3. Relacione os tipos de água as suas características:
1. Água destilada
( ) é a água para consumo humano cujos parâmetros microbiológicos,
2. Água doce
físicos, químicos e radioativos atendam ao padrão de potabilidade e
3. Água potável
que não causam riscos à saúde.
4. Água mineral
( ) é aquela proveniente de fontes naturais ou de fontes artificialmente
5. Água salgada
captadas que possua composição química ou propriedades físicas ou
físico-químicas distintas das águas comuns, com características que
lhe confiram uma ação medicamentosa.
( ) é a água obtida por meio da destilação (condensação do vapor da
água obtido pela ebulição ou pela evaporação) de água não pura.
( ) é a água encontrada em mares e oceanos.
( ) a água dos rios, lagos e a maioria dos lençóis subterrâneos, com
uma salinidade próxima de zero.
2.4. Quais das águas citadas acima é popularmente chamada de água pura? É a mesma
considerada pelos químicos? Qual é a diferença?
2.5. Á água é uma substância química? Se sua resposta for sim, quais as características que ela
tem para ser enquadrada como uma substância?
2.6. Afinal, o que é uma substâncias química?
Uma substância é uma forma de matéria que tem uma composição definida (constante) e
propriedades distintas. As substâncias diferem uma das outras na composição e podem ser
identificadas por seu aspecto, cheiro, sabor e outras propriedades. Já uma mistura é uma
combinação de duas ou mais substâncias em que estas conservam suas identidades distintas. As
misturas não têm uma composição constante.
2.7 Dê exemplo de cada um dos termos seguintes: (a) matéria, (b) substância e (c) mistura.
As misturas podem ser homogêneas ou heterogêneas. As homogêneas são completamente
uniforme no nível das partículas e consiste em uma ou mais substâncias na mesma fase. Estas
misturas são chamadas de soluções. Já as heterogêneas mostram mais de uma fase. Ás vezes a
distinção das fases não são perceptíveis sem o auxílio de um microscópio, por exemplo, o sangue,
aparentemente é homogêneo, mas com o auxílio de um microscópio é possível ver as células.
Qualquer mistura, homogênea ou heterogênea, pode ser criada e depois separada por meios
físicos em seus componentes puros sem alterar a identidade dos componentes. Assim, o açúcar pode
ser recuperado de uma solução em água por evaporação da água até à secura. A condensação do
vapor devolve-nos o componentes água.
2.8 Como você separaria as seguintes misturas:
a) água e sal de cozinha
d) água e óleo
c) ferro e área
Elementos e Compostos
As substâncias podem ser elementos ou compostos. Um elemento é uma substância que não pode
ser separada em substâncias mais simples por processos químicos. Atualmente foram identificados
cerca de 118 elementos. A maior parte deles ocorre naturalmente na Terra. Os outros foram criados
por cientistas por meio de processos nucleares.
2.9 Dê um exemplo de um elemento químico e um composto.
Por conveniência, os químicos utilizam os símbolos químicos com uma ou duas letras para
representar os elementos. A primeira letra é sempre maiúscula, mas as letras seguintes não.
Os átomos da maior parte dos elementos podem interagir uns com os outros para formar
compostos. O hidrogênio gasoso (H2) entra em combustão com oxigênio gasoso (O2) para formar
água, que é uma substância que tem propriedades diferentes dos seus precursores. Assim, a água é
um composto, uma substância química composta de átomos de dois ou mais elementos químicos
unidos, que possuem propriedades e composição química definidas.
Propriedades das substâncias químicas
Os químicos consideram que uma substância é uma porção de matéria com composição química
constante e propriedades bem definidas. Da mesma maneira como você consegue reconhecer um
amigo por um conjunto de suas características (a cor da pele, o timbre de voz, a forma do nariz, o
modo de andar, o jeito de falar, a cor e a textura dos cabelos, o porte físico etc.), os químicos
identificam as substâncias pelo conjunto de suas propriedades.
Por outro lado, as propriedades das misturas de substâncias dependem dos componentes e
da composição da mistura. Da mesma forma, como a doçura de um café depende da quantidade de
adoçante, bem como o tipo de adoçante.
Desta forma, o estudo das propriedades dos materiais ajuda a compreender as transformações que
ocorrem na natureza.
2.10. Então, o que é uma propriedade?
As substâncias têm propriedades características que permitem aos Químicos distingui-las
umas das outras. Por exemplo, duas das propriedades do etanol são: ser líquido à temperatura
ambiente e entrar em combustão sob determinadas condições. Essas duas propriedades são muito
diferentes entre si, pois o fato do etanol estar líquido, sólido ou gasoso não interfere na sua
composição. Já quando ele queima, ocorre uma transformação na sua constituição e são produzidos
outros materiais e energia.
2.11. Identifique o máximo de propriedades a temperatura ambiente das seguintes substâncias:
Substâncias
Propriedades
Diamante
Oxigênio
As propriedades das substâncias são as principais informações que interessam aos químicos,
pois é possível encontrar usos e aplicações para as substâncias. Para isso, é conveniente fazer
distinção entre propriedades físicas e químicas. As físicas podem ser observadas e medidas sem
alterar a composição de uma substância. São as caraterísticas observadas que não mudam a
identidade da substância. Elas podem ser intensivas ou extensivas. As intensivas são aquelas que
não dependem da massa da amostra, enquanto as extensivas dependem da quantidade de amostra.
2.12. Classifique as propriedades intensivas com a letra I e extensivas com a letra E?
( ) densidade
( ) pressão
( ) volume
( ) viscosidade
( ) temperatura
( ) ponto de fusão ( ) massa
( ) capacidade calorífica
( ) entalpia
( ) energia
As propriedades químicas, por outro lado, são propriedades qualificadas das substâncias, ou
seja, varia de substância para substância, seja ela simples ou compostas. Referem-se à capacidade
de uma substância de poder se transformar em outra.
Transformações físicas
A matéria que nos rodeia está em constante mudança, sofrendo inúmeras transformações. Uma
floresta em chamas, o gelo das calotas polares que funde, o açúcar que adoça o café, tudo isto são
exemplos de transformações que ocorrem todos os dias.
Considere, por exemplo, que amassemos uma lata de refrigerante de alumínio para descartá-lo
no lixo. Isto é uma transformação, pois a aparência, tamanho e formato da lata foram modificados.
Entretanto, a sua constituição continua sendo a mesma, ou seja, continua sendo formada por
alumínio.
2.13. Dê exemplos de transformações físicas que podem ocorrer nos seguintes materiais: numa
barra de ouro e no açúcar em pó.
Um metal que se transforma em fio, a construção de objetos de madeira, dissolução de açúcar
em água, a evaporação do álcool, são exemplos de mudanças de estado físico. Essas transformações
em que apenas a aparência é alterada e não há formação de novas substâncias são chamadas de
transformações físicas.
2.14. O sal de cozinha, consiste de um sólido cristalino com arranjo tridimensional de espécies
iônicas (Na+ e Cl–). Quando aquecido a 801°C, o sólido funde para formar um líquido desses íons.
Quando aquecido a 1430°C forma um vapor feito do par-iônico discreto com fórmula Na2Cl2.
a. Como são classificadas as transformações nestas duas temperaturas?
b. Os íons no sólido cristalino, na solução e no par-iônico Na2Cl2, são espécies químicas
diferentes? Qual o tipo de transformação ocorre em cada fase?
Dependendo da pressão e da temperatura em que se encontra a matéria, ela pode existir em
três estados físicos de agregação: sólido, líquido e gasoso. Ao receber ou perder certa quantidade de
calor a matéria pode sofrer uma mudança ou transição desse estado.
2.15. Observe o esquema a seguir e escreva sobre as linhas o nome das mudanças de fase entre
cada estado da matéria.
2.16. Indique qual transformação da matéria ocorre nos seguintes eventos:
a) Uma pedra de naftalina deixada no armário após uma semana. _________________________
b) Um copa com água deixada no sol.______________________________________________
c) O derretimento de um pedaço de chumbo quando aquecido._____________________________
d) Um pedaço de gelo seco (gás carbônico) exposto ao ar após algumas horas.________________
Outro estado da matéria, bem menos comum aqui na Terra, mas acredita-se que 99% de tudo
que existe no Universo esteja nesse estado, é o plasma. O plasma é um estados físicos da matéria
similar ao gás, porém suas partículas se encontram ionizadas (carregadas com cargas elétricas). A
presença dessas cargas torna o plasma eletricamente condutor, de modo que ele responde
fortemente a campos eletromagnéticos.
Transformações Químicas
São as transformações químicas, que sempre fascinaram a humanidade. A partir delas surgiram
diferentes processos e materiais que ajudaram o desenvolvimento da tecnologia e melhoria da vida
do ser humano no planeta.
2.17. Escreva sobre duas transformações químicas que ajudaram no desenvolvimento e melhoria
da vida no planeta?
As transformações químicas são definidas macroscopicamente como um processo no qual
novas substâncias são formadas. Do ponto de vista microscópico podem ser pensadas como um
rearranjo de átomos. Contudo, qualquer que seja o ponto de vista, a transformação química é
referida como uma reação química representada por uma equação química que tem a seguinte
forma:
Reagentes → Produtos
Uma maneira de comprovar a existência de uma transformação química é por meios da
comparação do estado inicial e final do sistema. Algumas evidências podem ser observadas,
permitindo verificar a ocorrência dessas transformações, como modificação na cor, cheiro, estado
físico e temperatura.
Confira a tabela com a descrição do sistema antes e depois da transformação:
Processo
Queima da Gasolina
Enferrujamento de um
prego
Estado Inicial
Estado Final
Gasolina: Líquido amarelado, com
cheiro característico
Oxigênio: Gás incolor
Gases Incolores
Prego: sólido rígido, com coloração
cinza
Oxigênio: gás incolor
Água: líquido incolor
Pó vermelho castanho
Em alguns casos, somente pela observação visual, não é possível identificar se houve uma
transformação. Por exemplo, quando misturamos soluções de ácido clorídrico e hidróxido de sódio,
ambas incolores. Após a mistura, o líquido resultante ainda é incolor, sem aparentar a formação de
um novo material. No entanto uma reação química acontece quando essas substâncias são
misturadas. Portanto é importante identificar e reconhecer os diferentes materiais que participam de
uma transformação.
2.18. Pense sobre as seguintes transformações da matéria e classifique-as como físicas ou
químicas: 1. bater claras de ovos; 2. magnetizar a agulha de uma bússola com ímã; 3. ferver
água; 4. dissolução de açúcar em água; 5. formação da ferrugem numa barra de ferro; 6.
fritura ou cozimento de um ovo; 7. pão mofado; 8. passagem de corrente elétrica pela água; 9.
produção de plásticos a partir do petróleo; 10. fabricação da coalhada a partir do leite.
Transformações
Físicas
Químicas


![Roteiro Mensal [3ª série] – Biologia – Química – Empreendedorismo](http://s1.studylibpt.com/store/data/000321355_1-fe20122337e00be7fc133cc291bfacca-300x300.png)