RESUMÃO DE QUÍMICA
MATÉRIA E TRANSFORMAÇÕES
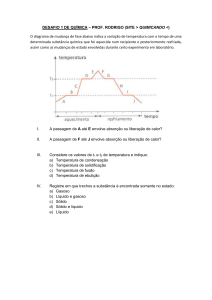
TRANSFORMAÇÕES
Os estados sólido, líquido e gasoso são chamados de estados físicos
ou estados de agregação da matéria.
ESTADO
GRAU DE
IONIZAÇÃO
AGITAÇÃO
MOLECULAR
VOLUME
FORMA
ATRAÇÃO
MOLECULAR
•
•
•
•
•
•
•
•
SÓLIDO
LÍQUIDO
GASOSO
ELEVADO
MÉDIO
PEQUENO
PEQUENA
CONSTANTE
CONSTANTE
MÉDIA
CONSTANTE
VARIÁVEL
ELEVADA
VARIÁVEL
VARIÁVEL
INTENSA
MÉDIA
FRACA
Fusão é a passagem do estado sólido para o líquido.
Solidificação é a passagem do estado líquido para o sólido.
Vaporização é a passagem do estado líquido para o gasoso.
Evaporação é a vaporização lenta, que ocorre na superfície do
líquido, sem agitação ou surgimento de bolhas.
Ebulição é a vaporização rápida, com agitação do líquido e
aparição de bolhas.
Liquefação é a passagem do gás para o estado líquido.
Condensação é a passagem do vapor para o estado líquido.
Sublimação é a passagem do estado sólido diretamente para o
gasoso ou vice-versa.
As transformações físicas ou fenômenos físicos são aqueles que não
alteram a natureza da matéria.
Nas transformações físicas, as partículas [átomos, moléculas ou íons]
que formam a matéria não são alteradas, são apenas agitadas,
desarrumadas, reordenadas etc. É o que acontece, por exemplo, nas
mudanças de estado físico.
As transformações químicas ou fenômenos químicos são aqueles
que alteram a natureza da matéria.
Nas transformações químicas, as propriedades da matéria são
alteradas, como é o caso da queima do carvão, que, depois de
queimado, não é possível ser recuperado [portanto, diz-se também que o
fenômeno é irreversível]. Essa é uma transformação, fenômeno ou
reação química.
+
→
+
Nessa transformação, as moléculas iniciais [reagentes] são rompidas, e
seus átomos se reagrupam para formar novas moléculas [produtos].
SUBSTÂNCIA PURA
Para a definição de substâncias puras recorre-se às chamadas
propriedades específicas, que são particularidades e exclusividades de
cada material, como, por exemplo, o ponto de ebulição, o ponto de
fusão, a densidade [ =
], o calor específico [quantidade de calor
necessária para aumentar em 1 °C a temperatura de 1 grama do
material] e a solubilidade [maior quantidade de massa que se pode
dissolver em dada quantidade de um líquido, a determinada
temperatura e pressão]. As medidas dessas propriedades específicas,
como têm valores fixos e constantes para cada material, são
denominadas constantes físicas.
Quando um material apresenta constantes físicas bem definidas e
invariáveis e não contém outros materiais, ele é denominado
substância pura.
MISTURA
O termo mistura refere-se à associação de duas ou mais substâncias,
em que cada substância que compõe a mistura é denominada
componente. As misturas não têm composição fixa, consequentemente
não apresentam constantes físicas definidas [como ponto de fusão,
ebulição etc.], como acontece com as substâncias puras.
No entanto, existem misturas especiais que se comportam como
substâncias puras, como é o caso da mistura eutética [ou,
simplesmente, eutético], que se funde/solidifica à temperatura
constante, e da mistura azeotrópica [ou, simplesmente, azeótropo],
que ferve/se condensa à temperatura constante.
As misturas podem ainda ser classificadas em:
•
Mistura homogênea: apresenta aspecto uniforme e propriedades
iguais em todos os seus pontos.
Ex.: água e açúcar.
As misturas homogêneas são também chamadas de soluções.
•
Mistura heterogênea: apresenta aspecto
propriedades variáveis de um ponto a outro.
não
uniforme
e
Ex.: água e óleo.
SISTEMA
O conceito de sistema material ou simplesmente sistema, visa reunir
em uma única ideia todos os tipos de materiais – tanto as substâncias
puras quanto as misturas.
Sistema é qualquer porção limitada de matéria que vai ser
submetida a um estudo.
Os sistemas materiais também se classificam em homogêneos e
heterogêneos, de acordo com os mesmos critérios utilizados para as
misturas.
A fase é cada uma das porções homogêneas de um sistema
heterogêneo, podendo ser contínua ou fragmentada. Assim, quanto ao
número de fases, os sistemas são classificados em:
•
Sistema monofásico: possui uma única fase [logo é um sistema
homogêneo].
•
Sistema polifásico: possui mais de uma fase [portanto, é sempre
um sistema heterogêneo].
Ex.:
O sistema água | óleo apresenta duas fases líquidas [a água e o óleo],
portanto é um sistema bifásico.
O granito tem três fases sólidas [o conjunto das regiões brilhantes, o
conjunto das regiões escuras e a massa acinzentada], portanto é um
sistema trifásico.
Fase é diferente de componente, podendo estar dividida em várias
porções.
O sistema pode ainda ser classificado quanto às variações de matéria e
energia:
•
Sistema aberto: troca matéria e energia com o meio ambiente.
Ex.: chaleira.
•
Sistema fechado/sistema quimicamente isolado: troca energia,
mas não troca matéria com o meio ambiente.
Ex.: ovo.
•
Sistema isolado/sistema fisicamente isolado:
matéria, nem energia como o meio ambiente.
Ex.: garrafa térmica.
não
troca