Resumo de química – Apostila 2 – 22 de março de 2017.
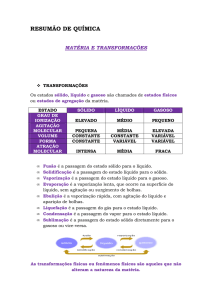
Substâncias e Misturas:
Substância Pura: Um tipo de matéria que apresenta a mesma composição, ou seja, composta
por partículas iguais. Para diferenciar uma substância pura da outra, basta saber as três
propriedades: TEMPERATURA DE FUSÃO, EBULIÇÃO e DENSIDADE.
Pode se dividir em dois grupos:
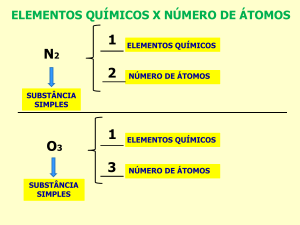
Simples: Formada por apenas um ÚNICO elemento químico. Exemplos: Oxigênio (𝑂2 ),
Hidrogênio (𝐻2 ).
Composta: Formada pela combinação de elementos químicos diferentes. Exemplos:
Água (𝐻2 O) e Gás Carbônico (𝐶𝑂2 ). A água é formada por dois átomos de hidrogênio e
um de oxigênio. O Gás Carbônico é formado por um átomo de carbono e dois átomos
de oxigênio.
Mistura: É a união de duas ou mais substâncias diferentes. Ela apresenta características físicas
(ponto de fusão, ponto de ebulição, densidade, tenacidade etc.) diferentes e variáveis. Além
disso, as misturas não têm composição definida.
Pode se dividir em dois grupos:
Mistura homogênea: Mistura de substâncias e elas ficam invisíveis a olho nu.
Exemplos: Água e sal (se forem bem misturados, o sal vai desaparecer), Água e álcool,
atmosfera (ninguém vê o oxigênio, hidrogênio, gás carbônico no ar). São chamadas de
MONOFÁSICAS (quando as substâncias se dissolvem e ninguém vê que está
misturado).
Mistura heterogênea: Mistura de substâncias em que elas não se separam, ou que elas
ficam visíveis a olho nu. Exemplo: Água e areia (embora forem misturadas, a água vai
mudar de cor), água e óleo (nunca misturarão), etc. São chamadas de POLIFÁSICAS
(pois possuem duas faces, ou seja, quando uma substância não se dissolve na outra).
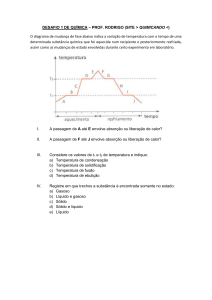
Gráfico de substâncias puras:
(Sempre em escadinha, pois as
temperaturas de ebulição e fusão são constantes e fixas).
Gráfico de mistura:
(Os gráficos não são feitos por “escadinhas”, pois as
temperaturas de fusão e ebulição não são constantes nem fixas).
Processos de separação de misturas:
Modos para separação de misturas heterogêneas formadas por SÓLIDOS (apenas):
Catação: Processo em que se usa mãos ou pinça para catar grãos. Exemplo: Retirada
de feijão podre, seleção de feijão).
Ventilação: Uma corrente de ar passa pela mistura o que é mais leve, assim as partes
mais pesadas se separarão das mais leves.
Levigação (arraste): Água corrente passa sobre a mistura, levando o que é mais leve.
Exemplo: Garimpo.
Separação magnética: Separar minérios de ferros presentes em uma mistura. Uso de
ímã (geralmente, não sempre).
Peneiração: Passar a peneira para separar um sólido mais leve de um grosso. Exemplo:
Separar areia grossa da fina.
Flotação (flutuação): Uso da propriedade: DENSIDADE. Uso de um líquido de
densidade intermediária, ou seja, seja mais denso que um sólido e menos que outro.
Exemplo:
(Separação de areia e serragem por flotação, colocando
água para separá-los, conforme a densidade de cada um).
Modos para separação de misturas HETEROGÊNEAS com um componente SÓLIDO e outro
LÍQUIDO (ou gasoso):
Decantação (ou sedimentação): A mistura ficará em repouso e, a matéria mais densa
vai ficar no fundo e o menos denso ficará em cima. Exemplo: Processo para “filtrar” a
água do barro, como o barro é mais denso, ele ficará no fundo.
Centrifugação: Processo utilizado para acelerar o processo de decantação (anterior).
Usa um aparelho chamado centrífuga, que acelera o processo.
Filtração: Quando a mistura passa por um filtro poroso, as partículas maiores ficam
retidas.
Modos utilizados para separação de misturas HOMOGÊNEAS com um componente SÓLIDO e
outro LÍQUIDO:
Cristalização: Ferver o líquido, então o líquido evaporará e sobrará o sólido. (Processo
utilizado se você quiser SOMENTE o componente sólido, porque o líquido evaporará).
Destilação simples: Uso de um aparelho específico, em que o líquido passa por um
processo de ebulição e evapora, mas é guardado em um outro recipiente (onde é
resfriado) e então volta a ser líquido. (A diferença desse processo com o de
cristalização, é que esse você pode ter os dois componentes).
Modos utilizados para separação de misturas HOMOGÊNEAS com dois componentes
LÍQUIDOS:
Destilação fracionada: Os líquidos devem possuir temperaturas de ebulição
diferentes, pois um deles deve passar pelo processo de ebulição, enquanto o outro
ainda não evapora, por isso precisa de temperaturas de ebulição diferentes. Exemplo:
Obter subprodutos do petróleo.
Fenômenos FÍSICOS e QUÍMICOS:
Mudanças físicas: Mudanças de fases, não alteram a estrutura da matéria. Exemplo: Recortar,
amassar um papel. O papel continua tendo os mesmos elementos dentro dele, o que muda é o
formato, não a estrutura.
Exemplos:
Precipitação de chuvas – MUDANÇA DE FASES (gasoso para líquido – condensação).
Obtenção do sal por meio da água do mar – Processo de CRISTALIZAÇÃO, a estrutura
do sal não tinha se misturado com a da água, se a água for evaporada, restará
somente o sal.
Quebrar um vidro, embora o vidro tenha se repartido, não se mudou nada de dentro
(ou seja, a estrutura).
Evaporação do álcool – MUDANÇA DE FASES (Líquido para gasoso – vaporização).
Laminação do aço.
Mudanças químicas: Mudanças que transformam uma substância em outra, pois alteram a
estrutura da matéria. Exemplo: Pintar um papel. O papel não terá a mesma cor, portanto,
mudará sua estrutura.
Exemplos:
Queimadas – Transformação de madeira em cinzas, muda a estrutura.
Corrosão de uma chapa de ferro ou de um prego;
Ferrugem em metais;
Queima de fogos de artifício;
Amadurecimento de frutas;
Revelação de fotografia – mudará a cor, etc.
Combustão da gasolina, é a queima da gasolina, vai transformá-la em outro elemento.
As mudanças químicas podem ser reconhecidas por três dicas:
Liberação de gases;
Mudança de cor (como pintar um papel, ou pintar uma parede);
Formação de precipitado (quando se coloca um bicarbonato de sódio na água,
aparecerá bolhas. Ou quando se põe limão no leito, vai aparecer partículas).
As transformações e energia:
Normalmente, os fenômenos químicos liberam ou absorvem mais energia que os fenômenos
físicos, pois o fenômeno químico altera mais a estrutura da matéria.
A fotossíntese é um fenômeno químico, pois absorve o GÁS CARBÔNICO e o transforma em
OXIGÊNIO.
A chuva ácida é um fenômeno químico, porque substâncias químicas prejudiciais ao ser
humano se misturam ao vapor d’água, transformando e mudando a estrutura da chuva.