BIOQUÍMICA EQ
2 LISTA DE EXERCÍCIOS
a
ESTUDO DIRIGIDO: PROTEÍNAS
1. Liste exemplos e funções de proteínas.
2. Desenhe uma ligação peptídica e indique os resíduos N e C-terminais.
3. Para o pentapeptídeo Glu-Met-Arg-Thr-Gly:
. (a) nomeie o resíduo carboxila terminal
. (b) indique os resíduos carregados em pH 7,0
. (c) dêacargalíquidaempH1,0
4. Diferencie as duas maiores estruturas periódicas de uma proteína: a alfa-hélice e a folha betapregueada. Descreva os padrões de pontes de hidrogênio e formas.
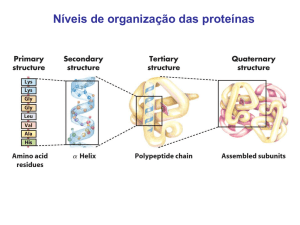
5. Descreva as estruturas primária, secundária, suprasecundária, terciária e quaternária das proteínas.
6. Desde que os aminoácidos servem como unidades fundamentais para as proteínas, o conhecimento
de suas estruturas e propriedades químicas é crucial para a compreensão de como as proteínas
executam suas atividades biológicas. Reúna cada aminoácido com a descrição mais adequada
de suas propriedades na lista abaixo. Algumas descrições podem usadas mais de uma vez. Os
aminoácidos são: Ala, Arg. Asn, Asp, Cys, Glu, Gly, His, Lys, Met, Phe, Pro, Ser, Trp, Tyr e
Val.
Propriedades dos grupos R:
. (a) Grupo R pequeno e polar contendo um grupamento hidroxila. Este aminoácido é importante no
sítio ativo de algumas enzimas.
. (b) Provoca menor impedimento estérico.
. (c) OgrupoRtempK=10,5,tornando-secarregadopositivamentenopHcelular.
. (d) Grupo R contendo enxofre neutro em todos os pHs.
. (e) Grupo aromático de natureza hidrofóbica e neutro em todos os pHs.
. (f) Hidrocarboneto saturado, importante em interações hidrofóbicas.
. (g) O único aminoácidotendo grupo R ionizável com pK próximo a 7,0. É um grupo importante no
sítio ativo de algumas enzimas.
. (h) O único aminoácido que tem alfa-amino grupo substituído. Influencia o dobramento
de proteínas, forçando uma curva na cadeia polipeptídica
. (i) O grupo R tem pK próximo a 4,0 e assim está carregado negativamente em pH 7,0.
. (j) Grupo R aromático, capaz de formar pontes de hidrogênio, tem pK perto de 10,0.
. (k) Forma interligações dissulfeto entre cadeias polipeptídicas, o pK de grupo funcional
será próximo a 8,0.
. (l) Grupo R com pK = 12,0, tornando-o carregado positivamente na faixa de pHs fisiológicos. Sua
carga positiva é importatnte em algumas proteínas por ligar grupos fosfato
carregados negativamente.
. (m) Quando este grupo polar não carregado é hidrolisado, este aminoácido converte-se em
outro aminoácido com um novo grupo R carregado negativamente em pH 7,0.
7. Indique a nomenclatura de uma única letra para os aminoácidos descritos no exercício anterior.
8. Grande parte das proteínas são insolúveis em água pura, mas dissolvem-se em soluções diluídas de
sais (salting-in). Entretanto, a elevaçao da concentração de salina pela adição de grande
quantidade de sais neutros a uma solução aquosa de proteínas causa a precipitação dessas
últimas. Este fenômeno é chamado de precipitação salina (salting-out). Por exemplo, a maioria
das proteínas é solúvel na presença de concentrações de (NH4)2SO4 de 0,1M, porém quando
essa concentração é aumentada para 3M elas tornam-se insolúveis e precipitam. Quando o
excesso de (NH4)2SO4 é removido, essas proteínas voltam a dissolver- se. Sugira uma
explicação molecular para a observação de altas concentrações salinas diminuírem a
solubilidade de proteínas.
9. O colágeno é a proteína mais abundante em mamíferos, tem composição em aminoácidos incomum.
Diferentemente de outras proteínas, o colágeno é muito rico em prolina e hidroxiprolina.
Como a hidroxiprolina não é um dos 20 aminoácidos comumente encontrado em proteínas, a
sua incorporação no colágeno pode ser explicada de duas maneiras: (1) a prolina é hidroxilada
por enzimas antes da incorporação ao colágeno, (2) a prolina é hidroxilada depois da
incorporação ao colágeno. Para testar essas hipóteses, os seguintes experimentos foram
realizados: quando 14C-prolina é administrada a um rato e o colágeno da cauda isolado,
encontra-se que esta proteína recém –sintetizada é radioativa; entretanto, se 14Chidroxiprolina é administrada ao animal, nenhuma radioatividade é encontrada no colágeno
recém-sintetizado. O que estes experimentos revelam sobre as duas hipóteses?
10.
Uma proteína só é biologicamente ativa quando está em sua forma tridimensional correta. As
proteínas são sintetizadas a partir de uma informação linear, isto é unidimensional, codificada
na sequência de bases nitrogenadas do DNA. Além disso, os ribossomos sintetizam sequências
lineares (unidimensionais) de aminoácidos. Em vista desses fatos, explique como proteínas
biologicamente ativas tendo estruturas tridimensionais precisas podem ser formadas nas
células.
11.
Os resíduos de aminoácidos Cys contribuem significativamente para estabilizar a estrutura de
proteínas através da construção de ligações covalentes entre seus os grupos R. Como ocorre
esta estabilização, equal o nome dado a ligação formada?
12.
Explique as funções fisiológicas da mioglobina e da hemoglobina em vertebrados