Colégio GEO Patos – (83).3421.2325
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
Série:
1ª série do ensino médio
Título:
Atomística
Aluna(o):
1. (Uema) Pesquisas científicas têm mostrado que desejar um
alimento específico nem sempre significa fome ou até mesmo
gula: o seu corpo pode estar querendo passar uma mensagem,
inclusive de carência de minerais.
Ter vontade de chupar gelo pode ser sinal de anemia e carência
de ferro (z 26); querer muito comer queijo, carência de cálcio
(z 20);
desejar
carne,
carência
de
zinco
(z 30);
chocolate, carência de magnésio (z 12), e, vontade por
doces, carência de cromo (z 24). Esses minerais apresentam
elétrons mais energéticos em seu estado fundamental que
constituem diferenças em relação à configuração eletrônica, à
classificação e à família a que pertencem.
Fonte: Texto adaptado do Jornal O ESTADO DO MARANHÃO,
caderno vida, publicado em: 30 ago. 2014.
a) Construa a configuração eletrônica para os elementos cálcio e
cromo, justificando as diferenças existentes.
b) Explique a que família pertencem esses elementos.
4. (Uem) Assinale o que for correto.
01) Os números quânticos de spin variam de a ,
passando por zero.
02) O número quântico magnético indica a energia do elétron no
subnível.
04) O número quântico principal indica a energia do elétron no
orbital.
08) O movimento do elétron ao redor do núcleo atômico gera um
campo magnético externo, e o movimento do elétron em
torno de seu próprio eixo gera outro campo magnético.
16) A região de máxima probabilidade de se encontrar o elétron
em um subnível s é uma região esférica.
5. (Ufrgs) O ferro é um dos mais importantes metais, utilizado
pelo homem desde a antiguidade.
São dadas as seguintes informações sobre o elemento ferro.
54
I. O ferro tem 4 isótopos estáveis naturais:
Fe, 56 Fe,
57
2. (Uel) Desde a elaboração dos modelos atômicos por Dalton,
Thomson, Rutherford e Bohr, cientistas como Murray Gell-Man
(EUA) e Georg Zweig (Alemanha) têm desvendado os segredos
subatômicos da matéria.
Assinale a alternativa que apresenta, corretamente, as
subpartículas que constituem as partículas atômicas conforme os
modelos de Gell-Man e Georg Zweig.
a) Quarks, léptons e bósons.
b) Elétrons, nêutrons e prótons.
c) Neutrinos e pósitrons.
d) Núcleo e eletrosfera.
e) Fótons.
3. (Ucs) Cardiologistas costumam recomendar a redução no
consumo de “sal de cozinha” para pessoas hipertensas porque
ele é a principal fonte de íons sódio da alimentação. De acordo
com dados da Organização Mundial da Saúde, a população
brasileira consome duas vezes mais sódio do que o valor
recomendado. Esse íon precisa estar em equilíbrio com o íon
potássio, caso contrário pode desencadear uma série de
doenças cardiovasculares. Além disso, o consumo excessivo do
sal de cozinha pode levar a uma menor absorção de íons cálcio,
podendo gerar problemas como osteoporose e raquitismo.
Tendo como referência o texto acima, assinale a alternativa
correta.
a) A configuração eletrônica de um átomo de sódio no estado
fundamental é igual à de um átomo de potássio, uma vez que
ambos possuem o mesmo número de elétrons no terceiro
nível de energia.
b) Átomos eletricamente neutros de sódio e potássio, ao
perderem um elétron de suas respectivas camadas de
valência, originam respectivamente íons Na e K que são
isoeletrônicos.
c) A configuração eletrônica de um átomo de cálcio no estado
fundamental pode ser representada de maneira simplificada
2
por [Kr] 4 s .
d) O elétron mais afastado do núcleo de um átomo de potássio
no estado fundamental apresenta número quântico principal
igual a quatro e número quântico secundário igual a zero.
e) Átomos eletricamente neutros de cálcio são menores do que
2
os respectivos íons Ca , uma vez que o número de prótons
nessas espécies difere de duas unidades.
Fe e
58
Fe.
II. O ferro pode ocorrer nos compostos na forma de cátions
Fe2 ou Fe3 .
III. O ferro pode apresentar formas alotrópicas diferentes, tais
como o Feα e o Fe γ .
Considerando os princípios químicos e
apresentadas, é correto afirmar que apenas
a) apenas o isótopo
56
informações
Fe é capaz de formar cátion Fe2 .
b) o Feα é formado pelos isótopos
Fe γ é formado pelos isótopos
2
as
54
57
Fe e 56 Fe, enquanto o
Fe e
58
Fe.
3
c) os cátions Fe
ou Fe
são originados de átomos de ferro
com diferentes números atômicos.
2
d) o Feα origina os cátions Fe
3
Fe
, e o Fe γ origina os cátions
.
e) os diferentes isótopos do ferro podem ser encontrados tanto
no Feα como no Fe γ .
6. (Ifsul) Considere que os átomos dos elementos X e Z
apresentam, respectivamente, os seguintes conjuntos de
números quânticos para seus elétrons de diferenciação:
Átomo X : n 4;l 0;m 0;s 1 2
Átomo Z : n 5;l 1;m 0;s 1 2
(Convenção do spin do
1º elétron 12)
Qual é a afirmativa correta?
a) O elemento X é um metal alcalino e o elemento Z é um gás
nobre.
b) Os números atômicos dos elementos X e Z são,
respectivamente, 30 e 51.
c) O elemento X possui 2 elétrons de valência e o Z possui 5
elétrons.
d) A fórmula do composto formado por átomos de X e Z é
XZ2 .
_____________________________________________________________________________________________________________________________ ___________________________
[email protected]
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
7. (Ufes) A água (H2 O) e o ácido sulfídrico (H2 S) possuem
algumas características em comum, por exemplo: os elementos
oxigênio e enxofre pertencem à mesma família na Tabela
Periódica; a molécula da água e a do ácido sulfídrico possuem a
mesma geometria. Porém, o ponto de fusão (PF) de cada um
desses dois compostos (H2 O e H2 S), nas
C.N.T.P., é
distinto: PF(H2 O) 0C e PF(H2S) 85C.
que o ponto de fusão (PF) do ácido sulfídrico.
b) Considerando que o primeiro elétron a ser preenchido em um
orbital possui spin negativo (Ms 12) e que a distribuição
2
4
eletrônica do elemento oxigênio é 1s 2s 2p , descreva o
conjunto dos quatro números quânticos para os quatro
elétrons do subnível 2p.
c) O ácido sulfídrico pode reagir com diversos compostos
metálicos formando espécies de sulfetos insolúveis em água.
Determine a fórmula mínima de um composto metálico que
contém 42,3% de cromo e 57,7% de cloro.
d) Calcule o volume ocupado, em
sulfídrico a
L, por 17,04 g de ácido
27,0C e 1,50 atm.
Dado: R 0,0820L atm K
1
Considere: S 1 2 e S 1 2.
01) Se um cátion divalente tem a configuração eletrônica
3s2 3p6 para o seu último nível energético, então o átomo
correspondente, no estado fundamental, tem Z 20.
02) O isótopo
a) Explique por que o ponto de fusão (PF) da água é maior do
2
9. (Uepg) Com relação à estrutura atômica e à distribuição
eletrônica, assinale o que for correto.
12 do Carbono (Z 6), no estado fundamental,
tem seu elétron de diferenciação com números quânticos:
n 2, 1, m 0, m=0, S 1 2.
04) Sendo C
(Z 17) e S (Z 16), então, o ânion cloreto
e o átomo de enxofre, no estado fundamental, são espécies
isoeletrônicas.
08) Um átomo no estado fundamental, com número atômico igual
a 33, apresenta 5 elétrons no último nível de sua
distribuição eletrônica.
16) Um átomo com 22 elétrons e A 48, no estado
fundamental, apresenta 26 prótons em seu núcleo.
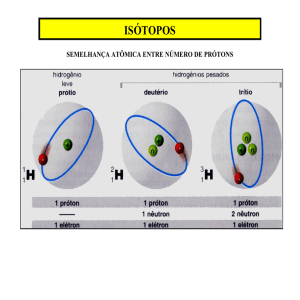
10. (Upe) Na II Guerra Mundial, as Forças Aliadas executaram
uma ação de guerra para resgatar uma garrafa de cerveja
contendo água deuterada (D2 O), que Niels Bohr deixou, por
engano, no seu laboratório.
Sobre esse tema, analise as afirmativas a seguir:
I. A ação militar justifica-se porque o deutério pode sofrer fissão
nuclear, sendo utilizado na confecção da bomba atômica.
II. A água deuterada e a água pura (H2 O) são substâncias
mol1
8. (Ita)
compostas constituídas pelos mesmos elementos químicos.
III. A garrafa com água deuterada, encontrada no laboratório de
Bohr, tem massa maior que uma garrafa idêntica contendo o
mesmo volume de água pura (H2 O).
Está CORRETO o que se afirma em
a) I, apenas.
b) I e II, apenas.
c) I e III, apenas.
d) II e III, apenas.
e) I, II e III.
Para uma molécula diatômica, a energia potencial em função da
distância internuclear é representada pela figura. As linhas
horizontais representam os níveis de energia vibracional
quanticamente permitidos para uma molécula diatômica. Uma
amostra contendo um mol de moléculas diatômicas idênticas,
na forma de um sólido cristalino, pode ser modelada como um
conjunto de osciladores para os quais a energia potencial
também pode ser representada qualitativamente pela figura. Em
relação a este sólido cristalino, são feitas as seguintes
proposições:
I. À temperatura de 0K, a maioria dos osciladores estará no
estado vibracional fundamental,
vibracional, n, é igual a zero.
cujo
número
quântico
II. À temperatura de 0K, todos os osciladores estarão no estado
vibracional fundamental, cujo número quântico vibracional,
é igual a zero.
III. O movimento vibracional cessa a 0K.
n,
IV. O movimento vibracional não cessa a 0K.
V. O princípio da incerteza de Heisenberg será violado se o
movimento vibracional cessar.
Das proposições acima estão CORRETAS
a) apenas I e III.
b) apenas II e III.
c) apenas I, IV e V.
d) apenas II, IV e V.
e) apenas II, III e V.
11. (Ufrgs) Abaixo são apresentadas as descrições de três tipos
de lâmpadas disponíveis no mercado, em que os elementos são
representados por números romanos.
1. As lâmpadas de vapor de I emitem uma luz amarelada e são
muito utilizadas em iluminação pública.
2. As lâmpadas halógenas apresentam uma maior eficiência
energética. Em algumas dessas lâmpadas, ocorre, no interior
do bulbo, uma série de reações que podem ser denominadas
ciclo do II.
3. As lâmpadas fluorescentes são carregadas internamente com
gases inertes à baixa pressão como o III. Nesse caso, o tubo
de vidro é coberto internamente com um material à base de IV
que, quando excitado com a radiação gerada pela ionização
dos gases, produz luz visível.
Os elementos I, II, III e IV podem ser, respectivamente,
a) sódio - nitrogênio - argônio - mercúrio
b) sódio - iodo - argônio - fósforo
c) flúor - fósforo - nitrogênio - sódio
d) mercúrio - nitrogênio - criptônio - potássio
e) flúor - iodo - mercúrio - sódio
12. (Udesc) Há 130 anos nascia, em Copenhague, o cientista
dinamarquês Niels Henrick Davis Bohr cujos trabalhos
contribuíram decisivamente para a compreensão da estrutura
atômica e da física quântica. A respeito do modelo atômico de
Bohr, assinale a alternativa correta.
a) Os átomos são, na verdade, grandes espaços vazios
constituídos por duas regiões distintas: uma com núcleo
pequeno, positivo e denso e outra com elétrons se
movimentando ao redor do núcleo.
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
b) Os elétrons que circundam o núcleo atômico possuem energia
quantizada, podendo assumir quaisquer valores.
c) É considerado o modelo atômico vigente e o mais aceito pela
comunidade científica.
d) Os saltos quânticos decorrentes da interação fóton-núcleo são
previstos nesta teoria, explicando a emissão de cores quando
certos íons metálicos são postos em uma chama (excitação
térmica).
e) Os átomos são estruturas compostas por um núcleo pequeno
e carregado positivamente, cercado por elétrons girando em
órbitas circulares.
b) O ferro
2
2
6
2
6
2
6
26 Fe : 1s 2s 2p 3s 3p 4s 3d
O cálcio (z = 20): família IIA ou grupo 2.
2
2
6
2
6
2
20 Ca : 1s 2s 2p 3s 3p 4s
O zinco (z 30) : família IIB ou grupo 12.
2
30 Zn : 1s
O magnésio
deste elemento nos alimentos e bebidas industrializados vem
crescendo e preocupando autoridades da área da saúde. Com
isso, em 2011, um acordo que prevê a redução voluntária de
níveis de sódio em alimentos processados vendidos em
restaurantes e supermercados foi firmado com as Associações
Brasileiras das Indústrias de Alimentos (Abia), de Massas
Alimentícias (Abima), de Trigo (Abitrigo) e de Panificação e
Confeitaria (Abip). Mas, segundo os dados de pesquisa realizada
pelo Instituto Brasileiro de Defesa do Consumidor (Idec), diversos
fabricantes de alimentos estão descumprindo o acordo para
redução de sódio firmado com o governo em 2011.
Disponível em: <http://oglobo.globo.com/economia/defesa-doconsumidor/industria-de-alimentos-descumpre-acordo-dereducao-de-sodio-mostra-teste-do-idec-13561902>
[Adaptado]
Acesso em: 22 ago. 2014.
Sobre o assunto tratado acima, é CORRETO afirmar que:
01) o raio do átomo neutro de sódio é maior que o raio do átomo
neutro de cloro.
02) o raio do átomo neutro de sódio é maior que o raio do
respectivo cátion.
04) um indivíduo que consome dois pratos de feijoada contendo,
no total, 11,7 g de cloreto de sódio estará ingerindo
quantidade superior à recomendada para ingestão diária de
sódio.
08) ao adicionar sal de cozinha na água para cozimento de uma
porção de macarrão, ocorre uma reação de oxirredução, na
qual são produzidos sódio na forma metálica (reduzida) e
cloro na forma de gás (C 2 ).
16)
a
configuração
eletrônica
do
íon
cloreto
é
1s2 2s2 2p6 3s2 3p6 .
32) o cloreto de sódio é um composto que por dissociação libera
o cátion sódio e o ânion cloreto.
64) o cloreto de sódio será mais solúvel em 200 mL de óleo de
soja do que em 200 mL de uma bebida refrigerante.
2s2 2p6 3s2 3p6 4s2 3d10
(z 12) : família IIA ou grupo 2.
2 2 6 2
12Mg : 1s 2s 2p 3s
13. (Ufsc) A Organização Mundial de Saúde recomenda a
ingestão de, no máximo, 2 g de sódio por dia, mas o brasileiro
consome, em média, mais do que o dobro desta quantidade. O
sódio está atrelado à regulação da pressão sanguínea e, em
excesso, sobrecarrega o sistema circulatório, causando
problemas renais e cardiovasculares. Apesar de o sal de cozinha
(NaC ) ser a principal fonte de consumo de sódio, a presença
(z 26) : família VIIIB ou grupo 8.
O cromo pertence à família VIB ou grupo 6.
2
2
6
2
6
2
4
24 Cr
: 1s 2s 2p 3s 3p 4s 3d
24 Cr
: 1s2 2s2 2p6 3s2 3p6 4s1 3d5 (mais estável)
Resposta
[A]
da
questão
[A] Correta. Os modelos desenvolvidos pelos cientistas Murray GellMan (EUA) e Georg Zweig (Alemanha) levaram a constatação da
existência de subpartículas atômicas: quarks, léptons e bósons.
[B] Incorreta. John Joseph Thomson, James Chadwick e Eugen
Goldstein, desenvolveram os modelos de elétrons, nêutrons e
prótons.
[C] Incorreta. Os modelos de neutrinos e pósitrons foram
desenvolvidos por Wolfgang Pauli, Paul Dirac e Carl David
Anderson.
[D] Incorreta. O modelo de núcleo e eletrosfera foram apresentados
por Ernest Rutherford e Niels Bohr.
[E] Incorreta. O modelo de fótons foi desenvolvido por Gilbert N.
Lewis.
Resposta
[D]
da
questão
Resposta
da
questão
a) Configurações eletrônicas do cálcio e do cromo:
20 Ca :
1s2 2s2 2p6 3s2 3p6
1:
4s2
19 K : 1s
2
2s2 2p6 3s2 3p6
4s1
camada
de
valência
4s1
n 4 (número quântico principal)
0 (número quântico sec undário ou azimutal)
Resposta
08 + 16 = 24.
da
questão
n4
24 Cr
: 1s2 2s2 2p6 3s2 3p6 4s2 3d4
24 Cr
: 1s2 2s2 2p6 3s2 3p6
4s1
3d5
5 elétrons
1 elétron
na camada mais energéticos
de valência
n4
(configuração mais está vel)
4:
1
1
ou .
2
2
Verificou-se que o momento magnético associado ao movimento de um
elétron numa órbita é função apenas do número quântico; esse
momento magnético do momento angular de órbita é dado pela
expressão:
2 elétrons
na camada
de valência
2 elétrons
mais energéticos
3:
O elétron mais afastado do núcleo de um átomo de potássio no
estado fundamental apresenta número quântico principal igual a
quatro e número quântico secundário igual a zero:
Os números quânticos de spin assumem valores
Gabarito:
2:
μ
( 1)B;
onde B é uma constante denominada
magnéton de Böhr.
Os níveis de energia de um átomo são organizados em conjuntos
chamados camadas eletrônicas, isto é, uma camada é um conjunto
de subníveis energéticos quantizados (apresentam energia
constante).
O movimento do elétron ao redor do núcleo atômico gera um campo
magnético externo, e o movimento do elétron em torno de seu próprio
eixo gera outro campo magnético.
A região de máxima probabilidade de se encontrar o elétron em um
subnível s é uma região esférica.
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
5
p (pois, s 0, p 1, d 2, f 3)
camada principal:
subcamada:
1
0
1
Assim,
5
elétron 1
2
teremos que o átomo Y
possui o elétron de diferenciação
5p
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5
nº atômico: 53
pertence ao 5º período da família 7A (família do halogênios).
Resposta
da
questão
5:
[E]
Análise das afirmações:
[A] Incorreta. Todos os isótopos do ferro são capazes de formar
2
cátion Fe .
[B] Incorreta. Ferro alfa: ferro puro com arranjo cúbico de corpo
centrado.
Ferro gama: ferro puro com arranjo cúbico de face centrada.
[A] Incorreta. O elemento X é metal alcalino terroso e Y um
halogênio.
[B] Incorreta. Os números atômicos serão 20 e 53, respectivamente.
[C] Incorreta. O elemento X possui 2e na C.V e Y possui 7e na
C.V.
[D] Correta. O elemento X pertence a família 2A pode doar 2e e Y,
da família 7A, recebe 1e cada, formando o composto: XZ2 .
Resposta
da
questão
7:
a) O ponto de fusão da água é maior do que do ácido sulfídrico,
pois a água apresenta o grupo OH, que faz ligações ou pontes de
hidrogênio. Estas interações intermoleculares são mais intensas
do que o dipolo-permanente presente no ácido sulfídrico.
b) Teremos:
2 2
4
1s 2s 2p
2p4
1 0 1
2
3
[C] Incorreta. Os cátions Fe
ou Fe
são originados de átomos
de ferro com os mesmos números atômicos (Z = 26).
[D] Incorreta. Tanto o Feα como o Fe γ originam os cátions
Fe2 e Fe3 .
[E] Correta. Os diferentes isótopos do ferro podem ser encontrados
tanto no Feα como no Fe γ .
Resposta
[D]
da
questão
6:
n 4 (camada principal
0 (subcamada)
X:
m0
ms 1
2
camada principal: 4
subcamada: s (pois, s 0, p 1, d 2, f 3)
0
Segundo elétron: n = 2;
de
cloro:
Cr42,3%C
57,7%
42,3 57,7
52 35,5
0,8 1,6 ( 0,8)
1
2
Fórmula mínima: CrC 2 .
d) Teremos:
H2S 34,08
mH2SO4 17,04 g
T 27 273 300 K
10 elétron 1
2
Assim, teremos que o átomo X possui o elétron de diferenciação:
4s2 . Portanto, sua distribuição eletrônica, será:
2 2 6 2 6
2
1s 2s 2p 3s 3p 4s
nº atômico: 20
pertence ao 4º período da família
1; m 1; s 1 2.
1; m 0; s 1 2.
Terceiro elétron: n = 2; 1; m 1; s 1 2.
Quarto elétron: n = 2; 1; m 1; s 1 2.
c) Composto metálico que contém 42,3% de cromo e 57,7%
Primeiro elétron: n = 2;
2A
n 5
1
Y: m 0
ms 1
2
(metais alcalinos terrosos).
P 1,50 atm
R 0,0820 atm L mol1 K 1
m
R T
M
17,04
1,50 V
0,0820 300
34,08
V 8,20 L
P V
Resposta
[D]
da
questão
8:
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
Para localizarmos uma partícula com a ajuda de um fóton, deve
haver uma colisão entre os dois. Um fóton de comprimento de onda
possui um momento
ph ,
(h = constante de Planck) sendo
que uma fração qualquer do momento do fóton será transferida para
a partícula no instante da colisão. Logo, ao determinarmos a posição
da partícula com uma precisão x produzimos uma incerteza
no seu momento equivalente a
incertezas é igual a
p h .
O produto dessas
p x h h.
Esta dedução estabelece um limite na precisão com que a posição e
o momento de uma partícula podem ser determinados
simultaneamente. Utilizando argumentos mais elaborados podemos
obter a equação precisa do princípio da incerteza:
p x h
4
.
A determinação exata e simultânea da posição e do momento é
requisito necessário para descrevermos a trajetória de uma partícula.
Logo, pode-se inferir que há um limite par a precisão com que
podemos conhecer a trajetória da mesma.
Fonte: Química um curso universitário, Mahan e Myers.
Explorando um sistema massa-mola para representar as moléculas
diatômicas oscilando, vem:
V(x) k
Energia
potencial
E
k
Resposta
da
questão
9:
01 + 02 + 08 = 11.
[01] Correta. O cátion divalente perdeu 2 elétrons, assim o átomo
neutro,
possui
a
seguinte
configuração
eletrônica:
2 2 6 2 6
2
1s 2s 2p 3s 3p 4s , portanto, Z 20.
[02] Correta. O átomo de carbono, possui a seguinte configuração
eletrônica:
2 2 2
6 C 1s 2s 2p
O elétron de diferenciação será:
1
0
n 2,
1, m 0, S 1/ 2
[04] Incorreta. Átomos isoeletrônicos possuem a mesma quantidade
de elétrons, o íon cloreto possui 18e e o átomo neutro de
enxofre, possui 16e .
17 1 18e
17 C
16 S 16e
[08] Correta.
2 2 6 2 6 2 10
3
33 X 1s 2s 2p 3s 3p 4s 3d 4p
deveria possuir
2
1
O último nível (4) possui 5 elétrons.
[16] Incorreta. Um átomo no estado fundamental possui o mesmo
número de prótons e elétrons, portanto, se possui 26 prótons
x2
2
26 elétrons.
2
x
p
2 2m
Energia
total
De acordo com a mecânica clássica, no estado de mais baixa
energia (0 K), x = 0 e p = 0. Isto é incompatível com o princípio da
incerteza.
Sendo assim, fazendo:
2
2
x
p
2
2m
p x h
4
frequência angular de oscilação.
Ek
Resposta
da
questão
10:
[D]
Análise das afirmativas:
[I] Incorreta. O deutério pode sofrer fusão nuclear. A água pesada é
utilizada no resfriamento de reatores nucleares.
[II] Correta. A água deuterada e a água pura (H2O) são
substâncias compostas constituídas pelos mesmos elementos
químicos, ou seja, hidrogênio e oxigênio. A diferença está na
quantidade de nêutrons. O hidrogênio leve ou prótio não tem
nêutron, o deutério tem um nêutron.
[III] Correta. A garrafa com água deuterada, encontrada no
laboratório de Bohr, tem massa maior que uma garrafa idêntica
contendo o mesmo volume de água pura (H2O).
1
2
1H 1; 1 D
k
m
2; 16
8 O 16
H2O 18
Emínima (ponto zero)
h
4
Análise das proposições:
[I] Incorreta. À temperatura de
D2O 20
0K, todas as moléculas estarão no
mesmo estado vibracional fundamental, cujo número quântico
vibracional, n, é igual a zero.
[II] Correta. À temperatura de
0K, todos os osciladores estarão no
estado vibracional fundamental, cujo número quântico
vibracional, n, é igual a zero, pois a energia mínima será
atingida.
[III] Incorreta. O movimento vibracional não cessa a 0K, senão o
princípio
[V] Correta. S o movimento vibracional cessar, poderemos medir a
posição e o momento da molécula ao mesmo tempo e isto viola o
princípio da incerteza.
de
incerteza
de
Heisenberg
será
h
Emínima (ponto zero) 4 .
[IV] Correta. O movimento vibracional não cessa a
0K.
violado
Resposta
da
questão
11:
[B]
Teremos:
[1] As lâmpadas de vapor de sódio emitem uma luz amarelada e são
muito utilizadas em iluminação pública.
[2] As lâmpadas halógenas apresentam uma maior eficiência
energética. Em algumas dessas lâmpadas, ocorre, no interior do
bulbo, uma série de reações que podem ser denominadas ciclo
do iodo (família 7A - halogênios).
[3] As lâmpadas fluorescentes são carregadas internamente com
gases inertes à baixa pressão como o gás nobre argônio. Nesse
caso, o tubo de vidro é coberto internamente com um material à base
de fósforo que, quando excitado com a radiação gerada pela
ionização dos gases, produz luz visível.
Resposta
da
questão
12:
[E]
A partir das suas descobertas científicas, Niels Böhr propôs cinco
postulados:
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br
www.colegiogeopatos.com.br
Educar: arte de tecer um futuro de boas escolhas.
_____________________________________________________________________________________________________________________________ ___________________________
1º) Um átomo é formado por um núcleo e por elétrons
extranucleares, cujas interações elétricas seguem a lei de
Coulomb.
2º) Os elétrons se movem ao redor do núcleo em órbitas circulares.
3º) Quando um elétron está em uma órbita ele não ganha e nem
perde energia, dizemos que ele está em uma órbita discreta ou
estacionária ou num estado estacionário.
4º) Os elétrons só podem apresentar variações de energia quando
saltam de uma órbita para outra.
5º) Um átomo só pode ganhar ou perder energia em quantidades
equivalentes a um múltiplo inteiro (quanta).
Resposta
da
questão
13:
01 + 02 + 04 + 16 + 32 = 55.
[01] Correta. O raio dos átomos aumentam da direita para a esquerda
na tabela periódica nos períodos, pois os elementos com menor
carga nuclear possuem maior raio.
[02] Correta. O cátion é o átomo que perdeu elétron, portanto ocorre
contração da camada de valência diminuindo seu raio.
[04] Correta.
58,5 g de NaC
11,7 g de NaC
x 4,6 g de Na
23 g de Na
x
A quantidade será mais que o dobro da quantidade
recomendada (2g).
[08] Incorreta. Ocorrerá a dissociação iônica do sal:
NaC (s) Na(aq)
C (aq)
[16] Correta. O íon cloreto apresenta um elétron a mais que o átomo
de cloro, assim a distribuição eletrônica ocorre com 18 elétrons.
1s2 2s2 2p6 3s2 3p6
17 C
[32] Correta. A reação será:
NaC (s) Na(aq)
C (aq)
[64] Incorreta. O cloreto de sódio é um composto iônico, portanto, se
dissolverá melhor em compostos polares como o refrigerante (devido
a presença de água) do que no óleo que é um composto apolar.
________________________________________________________________________________________________________________________________________________________
www.quimicasolucionada.com.br