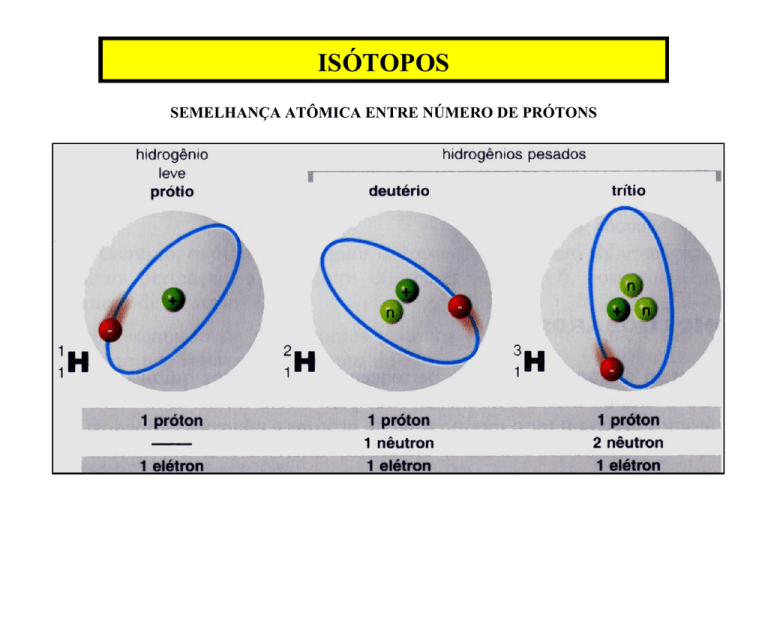
ISÓTOPOS
SEMELHANÇA ATÔMICA ENTRE NÚMERO DE PRÓTONS
ISÓBAROS
SEMELHANÇA ATÔMICA ENTRE NÚMERO DE MASSA
ISÓTONOS
SEMELHANÇA ATÔMICA ENTRE NÚMERO DE NÊUTRONS
ISOELETRÔNICOS
SEMELHANÇA ATÔMICA ENTRE NÚMERO DE ELÉTRONS
FALHA NO MODELO DE RUTHERFORD
TEORIA DO ELETROMAGNETISMO
▲Toda partícula com carga elétrica submetida
a uma aceleração origina a emissão de uma
onda eletromagnética
▲O elétron em seu movimento orbital está
submetido a uma aceleração centrípeta e,
portanto, emitirá energia na forma de onda
eletromagnética
▲Essa emissão, pelo princípio da conservação
da energia, faria com que o elétron perdesse
energia cinética e potencial
▲O elétron entraria em espiralhamento,
caindo progressivamente sobre o núcleo do
átomo, fato que não acontece
TRAJETÓRIA SEGUNDO RUTHERFORD
EFEITO ESPIRALHAMENTO DO ELÉTRON
O ÁTOMO DE BÖHR ( 1913 )
ELÉTRONS GIRAM AO REDOR DO NÚCLEO EM ÓRBITAS FIXAS E CIRCULARES
TEORIA QUÂNTICA
OS ELÉTRONS POSSUEM ENERGIA DEFINIDA PELA ÓRBITA ESTACIONÁRIA
AS ÓRBITAS DA ELETROSFERA
SETE CAMADAS ELETRÔNICAS OU NÍVEIS DE ENERGIA
▲Quanto mais perto do núcleo
estiver o elétron, menor será sua
energia
▲O estado de energia em que um
elétron se encontra é denominado
estado fundamental
SALTOS ELETRÔNICOS
ELÉTRONS EXCITADOS OU ATIVADOS
▲Quando um átomo recebe energia o elétron salta para uma camada mais externa
▲Os elétrons de um átomo excitado tendem a voltar para as camadas de origem
▲Devolução de energia sob a forma de onda eletromagnética ( fóton )
FOGOS DE ARTIFÍCIO
EFEITO DEVIDO AO CALOR DO FOGO E AO TIPO DE SUBSTÂNCIA
ESCALA DE CORES
EMISSÃO LUMINOSA CARACTERÍSTICA DE CADA ÍON METÁLICO
INCANDESCÊNCIA
ORIGEM TÉRMICA / TRANSIÇÃO RÁPIDA
QUIMIOLUMINESCÊNCIA
ORIGEM QUÍMICA / TRANSIÇÃO LENTA OU RÁPIDA
BIOLUMINESCÊNCIA
ORIGEM METABÓLICA / TRANSIÇÃO RÁPIDA
FLUORESCÊNCIA
ORIGEM NÃO TÉRMICA / TRANSIÇÃO RÁPIDA
FOSFORESCÊNCIA
ORIGEM NÃO TÉRMICA / TRANSIÇÃO LENTA
QUESTÃO 40
CADERNO DE EXERCÍCIOS /// PÁGINA 10
A substância simples bromo é formada por moléculas diatômicas ( Br 2 ) com massas
moleculares 158 , 160 e 162 e somente essas. Com essa informação, podemos
concluir que o elemento bromo é formado pelos isótopos:
a) 79Br , 80Br , 81Br .
b) 79Br e 81Br , somente.
c) 79Br e 80Br , somente.
d) 80Br e 81Br , somente.
e) 158Br , 160Br , 162Br .
QUESTÃO 42
CADERNO DE EXERCÍCIOS /// PÁGINA 10
( Puc ) A , B , C têm números de massa consecutivos. B é isótopo de A , e A é isótono
de C . B tem 21 nêutrons, e C tem 22 prótons. Determine os números atômicos e de
massa de A , B e C .
QUESTÃO 67
CADERNO DE EXERCÍCIOS /// PÁGINA 14
( Uerj ) O selênio é um elemento químico essencial ao funcionamento do organismo,
e suas principais fontes são o trigo, as nozes e os peixes. Nesses alimentos, o selênio
está presente em sua forma aniônica Se2- . Existem na natureza átomos de outros
elementos químicos com a mesma distribuição eletrônica desse ânion. O símbolo
químico de um átomo que possui a mesma distribuição eletrônica desse ânion está
indicado em:
Dado: Se ( Z = 34 )
a) 36Kr
b) 35Br
c) 33As
d) 52Te
QUESTÃO EXTRA 01
MODELO ATÔMICO DE BÖHR
( Ufrj ) A figura a seguir foi proposta por um ilustrador para representar um átomo
de lítio ( 3Li ) no estado fundamental, segundo o modelo de Rutherford-Bohr .
Constatamos que a figura está incorreta em relação ao número de:
a) nêutrons no núcleo.
b) partículas no núcleo.
c) elétrons por camada.
d) partículas na eletrosfera.
e) prótons por camada.
GABARITO
AULAS 03 + 04
● Questão 40
● Questão 42
● Questão 67
● Questão Extra 01
Alternativa [B]
Características: 20A40 /// 20B41 /// 22C42
Alternativa[A]
Alternativa [C]












