Universidade Técnica de Lisboa
Instituto Superior Técnico
2º Relatório de Química Orgânica
Trabalho 2
SEPARAÇÃO E PURIFICAÇÃO DE
COMPOSTOS ORGÂNICOS
Grupo:
Eduardo Fonseca, nº 62837
Ana Filipa Afonso, nº 66174
Mestrado Integrado em Engenharia Biomédica
Professora Amélia Santos Seabra
2
Índice
Índice……………………………………………………………………………………………..2
1. Resumo………………………….……….………………………………..
2. Procedimento Experimental………………………………………………
3. Equações utilizadas…………..
4.Resultados e Respostas às Questões Adicionais………………………
5. Discussão dos Resultados.…………………………………………………………
6. Conclusão……………………
7. Bibliografia………………………………………………………………………………
Maio 2009
3
1. Resumo
Este trabalho laboratorial teve como principal objectivo a separação e purificação de
três compostos orgânicos [1]. A p-toluidina, o ácido benzóico e o naftaleno, foram extraídos e
depurados a partir de uma mistura de 150 mL, contendo cerca de 2 g de cada composto
dissolvidos em clorofórmio.
O procedimento experimental efectuou-se em duas sessões em que se realizaram
correspondentemente a extracção e purificação dos compostos, através de diversas técnicas
de destilação, decantação e de várias reacções químicas [1]. Este procedimento visava
essencialmente a manipulação dos reagentes e produtos conforme as suas propriedades
ácidas ou básicas, específicas da estrutura de cada um [1].
No final do trabalho determinaram-se os pontos de ebulição e a massa (necessária
para o cálculo dos rendimentos das extracções) dos compostos extraídos. Estes dados serviram
de parâmetros de análise do grau de pureza dos compostos obtidos e da eficiência e eficácia
das extracções. Os pontos de fusão e a massa medidos foram respectivamente 42,5 0C e 0,986
g para a p-toluidina, 86,3 0C e 0,53 g para o naftaleno e 118 0C e 1,605 g para ácido benzóico.
2. Procedimento Experimental [1]
O trabalho laboratorial foi dividido em duas sessões, tal que na primeira realizou-se a
separação da p-toluidina, do ácido benzóico e do naftaleno [1]. Esta iniciou-se com a medição
de 150 mL da mistura previamente preparada pela professora, para uma ampola de
decantação [1]. A mistura era uma solução de 2 g de cada composto dissolvidos em
clorofórmio. Procedeu-se então á separação do ácido benzóico através da adição de 30 mL de
uma solução aquosa de NaOH a 3 M [1]. O NaOH é uma base que quando na mistura reage
com o ácido benzóico (3), formando uma fase orgânica constituída pela p-toluidina e o
naftaleno em solução com o clorofórmio e uma fase aquosa formada pelo sal (C6 H5 COONa) e
água. Agitou-se bem e deixou-se repousar, de modo a facilitar a realização da reacção. Sendo a
fase aquosa mais densa do que a fase orgânica, procedeu-se á decantação, retirando a fase
aquosa para um erlenmeyer. Este processo foi repetido com o intuito de separar a maior
quantidade possível de ácido benzóico e obter um rendimento de extracção máximo.
De seguida procedeu-se á extracção da p-toluidina presente na fase orgânica
resultante da separação do ácido benzóico. Para tal juntou-se 30 mL de uma solução aquosa
de HCl a 3 M á ampola de decantação [1]. O HCl ao possuir propriedades ácidas fortes reage
facilmente com a p-toluidina básica (4) formando um sal amina na fase aquosa
(CH3C6H4NH3Cl) e uma fase orgânica contendo o naftaleno em solução com o clorofórmio. Tal
Maio 2009
4
como na separação do ácido benzóico, agitou-se bem e deixou-se repousar, permitindo a fácil
decantação da fase aquosa para um novo erlenmeyer, devido às diferenças de densidades.
Repetiu-se também todo o processo com o objectivo de maximizar o rendimento da extracção.
De salientar o facto de esta separação ter causado mais complicações do que anterior devido à
difícil formação de 2 fases bem definidas e limpas, teve inclusive que se agitar a solução, após
a adição de HCl, com uma vareta de maneira a homogeneizar e limpar devidamente as duas
fases.
Seguidamente, passou-se ao tratamento da fase orgânica restante contendo o
naftaleno impuro [1]. Primeiro secou-se juntando sulfato de magnésio anidro á fase orgânica,
sendo posteriormente o seu conteúdo filtrado, num funil com filtro de pregas, para um balão
de 250 mL [1]. Procedeu-se então a uma destilação do clorofórmio, visto este ter um ponto de
ebulição menor que o naftaleno (61,7 0C <218 0C), num evaporador rotativo até sobrarem
cerca de 2 mL de solução.
Figura 1: Evaporador Rotativo Büchi B-491
Esta destilação é realizada a pressão reduzida com uma trompa que suga o ar
formando vácuo no balão, o que possibilita destilar a uma temperatura e pressão muito
menores, neste caso a 430C e a cerca de 600 mmHg. A rotação do balão tem como principal
funcionalidade o impedimento de formação de bolhas de ar neste ao longo da destilação. Após
a obtenção dos 2 mL de solução pretendidos, estes foram colocados num erlenmeyer a
arrefecer em gelo, para em seguida se filtrar com um funil de Buchner de modo a extrair o
nafataleno em estado sólido.
Maio 2009
5
Figura 2: Filtração a Vácuo do Naftaleno num Funil de Buchner
Continuando o procedimento experimental, adicionou-se cerca de 100 mL de HCl a 3
M ao erlenmeyer contendo a fase aquosa constituída pelo ácido benzóico (5). Este processo foi
realizado até a fase aquosa precipitar e atingir um pH ácido, avaliado por um medidor
universal. Para uma melhor precipitação do ácido benzóico arrefeceu-se em gelo, sendo de
seguida filtrado com um funil de Buchner [1]. Obteve-se assim o composto no estado sólido
sendo este devidamente guardado e identificado num frasco.
Figura 3: Frasco Contendo o Ácido Benzóico Extraído
Para obtenção da p-toluidina sólida procedeu-se de forma análoga. Primeiro
precipitou-se a fase aquosa contendo o sal de p-toluidina através da reacção (6) resultante da
adição de uma solução de NaOH a 3 M. Após o pH estabilizar a um valor básico, arrefeceu-se
em gelo e seguidamente filtrou-se num funil de Buchner lavando-se com um pouco de água
gelada. O produto obtido foi igualmente guardado num novo frasco com a devida
identificação.
Maio 2009
6
Durante a segunda sessão o objectivo era proceder à purificação dos três compostos
previamente extraídos na primeira sessão. Tal, não aconteceu devido á falta de tempo, tendo
sido apenas realizada a purificação do ácido benzóico. Efectuou-se então a recristalização do
ácido benzóico através da dissolução com um mau solvente, neste caso 20 mL de água.
Primeiro colocou-se o composto obtido num erlenmeyer de 250 mL com regularizadores de
ebulição, ao qual se adicionou água suficiente para cobrir o sólido. Aqueceu-se tudo numa
placa eléctrica (Junex) e esperou-se até a água entrar em ebulição e todo o soluto ficar
totalmente dissolvido, não contando com os regularizadores [1]. Em seguida adicionou-se um
pouco de carvão activado, com o intuito de absorver todas as impurezas que coloram o
composto, e deixou-se a mistura a refluxo durante cerca de dois minutos, tempo suficiente
para o carvão activado actuar. Posteriormente filtrou-se a solução a quente através de um
funil com camisa de água aquecido com um bico de Busen.
Figura 4: Funil Aquecido com Camisa de Água
Esta filtração foi realizada de modo a que não houvesse recristalização e segundo
todas as normas de segurança e manuseamento. De seguida recolheu-se o filtrado para um
erlenmeyer quente, não permitindo a precoce cristalização do composto. Colocou-se tudo a
arrefecer em gelo para uma mais eficaz precipitação e por fim filtrou-se a vácuo com um funil
de Buchner. O ácido benzóico sólido obtido foi guardado num frasco identificado [1].
Entretanto, ao longo deste procedimento foram medidas as massas e os pontos de
fusão de todos os compostos obtidos na sessão anterior. O ponto de fusão do ácido benzóico
purificado e a sua massa tiveram que ser medidos num período de tempo extra laboratorial de
maneira a que a secagem de água proveniente da filtração do produto a vácuo fosse
devidamente realizada.
Maio 2009
7
Figura 5: Medidor de Pontos de Fusão Büchi 530
3. Equações Utilizadas
- 𝑀𝑎𝑠𝑠𝑎 𝑜𝑏𝑡𝑖𝑑𝑎 = 𝑀𝑎𝑠𝑠𝑎 𝑑𝑜 𝐶𝑜𝑚𝑝𝑜𝑠𝑡𝑜 𝑐𝑜𝑚 𝑜 𝐹𝑟𝑎𝑠𝑐𝑜 − 𝑀𝑎𝑠𝑠𝑎 𝑑𝑜 𝐹𝑟𝑎𝑠𝑐𝑜 (1)
-𝜂
=
𝑚𝑎𝑠𝑠𝑎 𝑜𝑏𝑡𝑖𝑑𝑎
𝑚𝑎𝑠𝑠𝑎 𝑖𝑛𝑖𝑐𝑖𝑎𝑙
(2) [2]
- C6 H5 COOH + NaOH (aq) ⇆ C6 H5 COONa (aq) + H2 0 (3) [2]
- C7 H9 N + HCl (aq) → C6 H10 NCl (aq) (4) [2]
- C6 H5 COONa (aq) + HCl (aq) → C6 H5 COOH (s) + NaCl (aq) (5) [2]
- C7 H10 NCl + NaOH (aq) → C6 H9 N (s) + NaCl (aq) + H2 O (l) (6) [2]
Maio 2009
8
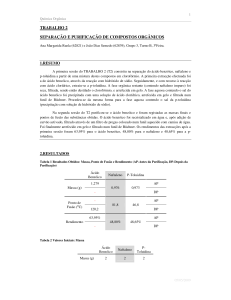
4. Resultados e Respostas às Questões Adicionais
1. Calcule o rendimento da separação dos 3 compostos. Registe os seus pontos de
fusão e comente o seu grau de pureza.
No cálculo do rendimento da separação dos 3 compostos, são necessários os valores
das respectivas massas, apresentados na tabela 1:
Tabela 1: Valores das Massas dos 3 Compostos Utilizados
Composto
Massa Inicial
(g)
Ácido Benzóico
Naftaleno
P-toluidina
2,000
2,000
2,000
Massa do
Composto com
o Frasco (g)
73,036
71,007
72,421
Massa do
Frasco (g)
Massa obtida
(g) (1)
71,431
70,477
71,435
1,605
0,530
0,986
O valor do rendimento é obtido através da equação (2). Deste modo, podemos calcular
o rendimento para os diferentes compostos tal como se segue:
𝜂=
𝑚𝑎𝑠𝑠𝑎 𝑜𝑏𝑡𝑖𝑑𝑎 𝑑𝑒 á𝑐𝑖𝑑𝑜 𝑏𝑒𝑛𝑧ó𝑖𝑐𝑜
𝑚𝑎𝑠𝑠𝑎 𝑖𝑛𝑖𝑐𝑖𝑎𝑙 𝑑𝑒 á𝑐𝑖𝑑𝑜 𝑏𝑒𝑛𝑧ó𝑖𝑐𝑜
𝑚𝑎𝑠𝑠𝑎 𝑜𝑏𝑡𝑖𝑑𝑎 𝑑𝑒 𝑛𝑎𝑓𝑡𝑎𝑙𝑒𝑛𝑜
𝑖𝑛𝑖𝑐𝑖𝑎𝑙 𝑑𝑒 𝑛𝑎𝑓𝑡𝑎𝑙𝑒𝑛𝑜
𝜂 = 𝑚𝑎𝑠𝑠𝑎
𝜂=
× 100 =
1,605 𝑔
2,000 𝑔
= 80,25 % (2)
0,530 𝑔
× 100 = 2,000 𝑔 = 26,50 % (2)
𝑚𝑎𝑠𝑠𝑎 𝑜𝑏𝑡𝑖𝑑𝑎 𝑑𝑒 𝑝−𝑡𝑜𝑙𝑢𝑖𝑑𝑖𝑛𝑎
𝑚𝑎𝑠𝑠𝑎 𝑖𝑛𝑖𝑐𝑖𝑎𝑙 𝑑𝑒 𝑝−𝑡𝑜𝑙𝑢𝑖𝑑𝑖𝑛𝑎
× 100 =
0,986 𝑔
2,000 𝑔
= 49,30 % (2)
Os pontos de fusão obtidos ao longo deste trabalho experimental encontram-se na
tabela que se segue:
Tabela 2: Valores dos Pontos de Fusão dos 3 Compostos Utilizados
Composto
Ácido Benzóico
Naftaleno
P-toluidina
Ponto de Fusão (teórico)
(°C) [3]
121-123
80
43
Ponto de Fusão (obtido) (°C)
118
86,3
42,5
Maio 2009
9
Com base na tabela, verificamos que os valores obtidos para os pontos de fusão dos 3
compostos encontram-se próximos dos valores teóricos dos mesmos. Deste modo, concluímos
que o grau de pureza das substâncias é relativamente elevado, apesar dos seus rendimentos
de extracção não perfazerem 100%.
Para além dos resultados apresentados, obtivemos também a massa de ácido benzóico
após a sua purificação, como se pode constatar na seguinte tabela:
Tabela 3: Massa do Ácido Benzóico após a sua Purificação
Composto
Massa do Frasco (g)
Ácido Benzóico
20,088
Massa do Composto
no momento após a
Purificação com o
Frasco (sem
evaporação da água)
(g)
21,215
Massa do Composto
após evaporação da
água com o Frasco
(g)
21,008
Analisando a tabela podemos constatar a importância da evaporação da água após a
purificação e interpretar a pureza do ácido benzóico calculando através da diferença da massa
extraída e da massa obtida após purificação, a quantidade de impurezas.
Assim:
Massa extraída de ácido benzóico = 1,605 g (2)
Massa obtida após purificação:
- Antes da secagem = 21,215 g - 20,088 g = 1,127 g (2)
- Após a secagem numa estufa a vácuo = 21,008 g - 20,088 g = 0,92 g (2)
Quantidade de impurezas após a secagem do composto:
1,605 g – 0,92 g = 0,685 g de impurezas
Maio 2009
10
2. Mostre os mecanismos das reacções.
O primeiro processo que consiste na separação do Ácido Benzóico é descrito pelas
seguintes equações:
a) C6 H5 COOH + NaOH (aq) ⇆ C6 H5 COONa (aq) + H2 0 [2]
b)C6 H5 COONa (aq) + HCl (aq) → C6 H5 COOH (s) + NaCl (aq) [2]
c) C6 H5 COOH (s) + H2 0 (l) → C6 H5 COOH (aq) [2]
calor
Na equação a), onde se verifica a extracção do Ácido Benzóico por reacção com uma
solução com uma base forte, Hidróxido de Sódio (NaOH) e formação de um sal, C6H5COONa e
de água.
O mecanismo de reacção que traduz esta equação é o seguinte [2]:
Figura 6: Mecanismo de reacção relativo a extracção do Ácido Benzóico
Por outro lado, a equação b), refere-se à precipitação da fase aquosa contendo o sal
formado na reacção anterior com uma solução de Ácido Clorídrico (HCl). Nesta, o sal reage
com o Ácido Clorídrico formando Ácido Benzóico e Cloreto de Sódio (NaCl).
O mecanismo de reacção que traduz esta equação encontra-se representado de
seguida [2]:
Figura 7: Mecanismo de reacção relativo à precipitação do Ácido Benzóico
Maio 2009
11
O segundo processo referente à separação da P-toluidina é descrito pelas duas equações
que se seguem:
a) C7 H9 N + HCl (aq) → C6 H10 NCl (aq) [2]
b) C7 H10 NCl + NaOH (aq) → C6 H9 N (s) + NaCl (aq) + H2 O (l) [2]
A equação a), descreve a extracção da P-toluidina por acção do Ácido Clorídrico (HCl).
Nesta, o composto reage com o Ácido Clorídrico formando o sal C6H10NCl.
O mecanismo de reacção referente a esta equação é o seguinte [2]:
Figura 8: Mecanismo de reacção relativo à extracção da P-toluidina
Por fim, a equação b), refere-se à precipitação da fase aquosa contendo o sal formado
anteriormente com uma solução de uma base forte, Hidróxido de Sódio (NaOH). Nesta, os
produtos de reacção são a P-toluidina, o Cloreto de Sódio (NaCl) e a água.
O mecanismo de reacção referente a esta equação encontra-se apresentado de
seguida [2]:
Figura 9: Mecanismo de reacção relativo à precipitação da P-toluidina
Maio 2009
12
5. Discussão dos Resultados
Perante a análise dos valores medidos e apresentados no ponto 4 deste relatório,
iniciamos a discussão dos resultados através do estudo dos rendimentos de extracção
obtidos. Assim podemos concluir que tanto para o ácido benzóico como para a p-toluidina,
separados na primeira sessão, foi calculado respectivamente os rendimentos de 49,3 % e
80,25 %, o que indicia uma eficácia de separação bastante razoável. Apesar de os valores
serem razoáveis, estes não foram de 100 %, tal pode ser explicado devido ao facto de
existirem perdas naturais de produto ao longo dos métodos do procedimento
experimental e claro, é preciso ter sempre em conta o erro relativo de 0,1 g das balanças.
De salientar as perdas de precipitado, que ficou no erlenmeyer antes de se efectuar a
filtração a vácuo com o funil de Buchner.
No caso do naftaleno, determinou-se um rendimento bastante baixo, cerca de
26,5 %, o que transparece uma eficácia de separação muito reduzida. Isto pode ser
compreendido, tendo em conta, para além das possíveis perdas e dos erros relativos das
máquinas, o facto de o naftaleno ter sido o último composto a ser extraído. O que significa
que a mistura de naftaleno em clorofórmio sofreu uma série de reacções necessárias á
separação dos outros compostos, antes da sua própria extracção. Estas reacções podem
ter interferido com o naftaleno em solução, provocando perdas significativas deste, apesar
de tal não ser muito provável devido ao carácter neutro (em termos de pH) do mesmo. De
referir que existe uma sequenciação do rendimento calculado em consequência da ordem
de extracção. Mais detalhadamente, o primeiro composto (ácido benzóico) a ser separado
da solução em clorofórmio, possui o rendimento mais elevado, seguido do composto
separado no meio (p-toluidina) e finalmente do último composto a ser separado
(naftaleno).
No âmbito da análise dos pontos de fusão medidos, podemos constatar que foram
obtidos valores bastante próximos dos valores teóricos (tabela 2) para todos os compostos
[3]. Os valores mais próximos dos esperados foram os da p-toluidina e do ácido benzóico,
o que aponta para um grau de pureza dos compostos bastante elevado. Já o mais
discrepante foi o do naftaleno, cerca de 6,3 0C acima do previsto, o que apesar de menor,
também indicia um grau de pureza alto. Aqui também tem que se ter em conta o erro
relativo da máquina e o facto de a fusão se realizar rapidamente, sendo por isso necessária
atenção redobrada para medir no termómetro a temperatura de fusão certa.
Em relação á purificação do ácido benzóico, salientamos a importância da secagem
de água, após a filtração a vácuo num funil de Buchner, visto que esta interfere na massa
pura obtida. O valor calculado de massa pura não foi muito elevado, cerca de 0,92 g,
menos de 50 % da massa inicial (2 g). Como não existem parâmetros de comparação, não
podemos afirmar que o valor obtido é aceitável ou não. Se não for, tal pode ser entendido,
novamente pelos erros relativos das máquinas e pelo facto de durante a incubação a
vácuo para a evaporação de água, de sublimado ácido benzóico para a tampa do frasco,
perdendo-se assim massa pura. De referir ainda que ao longo da dissolução do composto e
da evaporação de água efectuada no inicio da sessão 2, ter sido adicionada demasiada
Maio 2009
13
água ao soluto, o que levou a uma demorada evaporação e a uma consequente falta de
paciência da nossa parte, pode ter levado á perda de algum ácido benzóico não dissolvido.
6. Conclusão
Em suma, os resultados obtidos ao longo deste trabalho experimental, permitem
concluir que o procedimento e os métodos utilizados são fidedignos e relativamente
eficientes. Isto pode ser comprovado respectivamente pelo elevado grau de pureza dos
compostos obtidos e pela extracção e purificação razoavelmente eficazes. Tal pode ser
explicado pela curta duração da aula laboratorial que não permite a calma e devida
realização de métodos mais demorosos.
Para finalizar, salientamos que da nossa parte o trabalho correu bem e como
esperado. Foi-nos possível separar e purificar os compostos sem muitos percalços e
dificuldades, sendo também medidos valores não muito obtusos. Como tal afirmamos que
foi um trabalho experimental realizado com sucesso.
7. Bibliografia e Referências:
“Quimica Orgânica Laboratório” – Dulce Simão, José do Rosário Ascenso e Maria
Amélia Seabra [1];
“Química Orgânica”, acetatos aulas teóricas, Parte I, 2º semestre 2008/2009 –
Dulce Simão [2]
“The Chemical Database” - http://ull.chem++istry.uakron.edu/erd/ [3]
Maio 2009