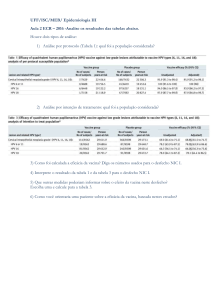
Estudo transversal ou survey ou inquérito ou cross sectional
Definição: Estudo observacional de um grupo de indivíduos em um único momento; Permite conhecer a
distribuição de características de uma população em uma determinada época (descritivo); Permite investigar
associações entre fatores de exposição e desfechos (analítico)
No geral, o grupo é escolhido aleatoriamente a partir de uma característica comum – geográfica, demográfica
ou ocupacional - a quem quero inferir meus resultados.
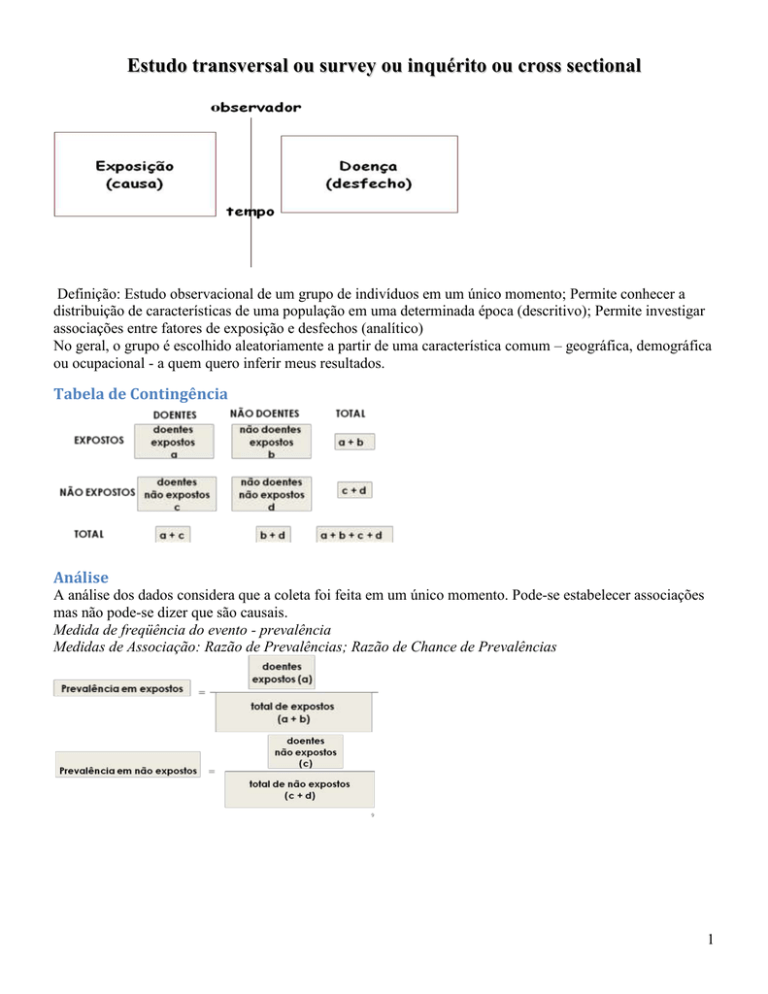
Tabela de Contingência
Análise
A análise dos dados considera que a coleta foi feita em um único momento. Pode-se estabelecer associações
mas não pode-se dizer que são causais.
Medida de freqüência do evento - prevalência
Medidas de Associação: Razão de Prevalências; Razão de Chance de Prevalências
1
Para cada não fumante com DC há dois fumantes com a doença
A prevalência de DC em fumantes é o dobro da prevalência em não fumantes.
RP>1 – exposição é fator de risco
RP<1 – exposição é fator de proteção
RP=1 exposição não influência a prevalência do desfecho
Ameaças à validade interna
1. VIESES
Ocorrem por erros sistemáticos do estudo, distorcendo a relação entre exposição e desfecho (o viés não existe
na base populacional, depende da condução do estudo)
Vieses de seleção – erro na forma de selecionar os participantes
Vieses de informaçao – erro na forma de medir/coletar as variáveis (aferiçao)
Influência da Temporalidade
• Exposição desfecho
• Doenças crônicas – qual 1º?
• Mudança de hábitos pós-diagnóstico
Viés de sobrevida seletiva
• > sobrevida – super-representada
• < sobrevida – sub-representada
2. CONFUNDIMENTO
Ocorre quando os resultados de uma associação entre exposição e desfecho podem ser imputados, total ou
parcialmente, a um terceiro fator não levado em consideração; este terceiro fator é o fator de
confundimento.
A variável de confundimento está sempre associada à exposição e ao desfecho, podendo mascarar um efeito
existente ou ser responsável por um efeito inexistente.
O confundimento é um fenômeno que ocorre na base populacional e pode ser previsto e controlado.
É um outro fator que, independente da exposição, é risco ou proteção para o desfecho
2
Controle da validade interna
Vieses: Não há como resolver na análise. A condução do desenho do estudo deve ser cuidadosa para evitálos. Pode-se avaliar a direção e a magnitude do viés e as possíveis influências no resultado.
Confundimento: Pode-se controlar a análise (tentando ajustar o resultado)
Análise estratificada
Análise multivariada
Regressão linear
Regressão logística
Inferência estatística e precisão do estudo
p-valor Qual probabilidade de um resultado, a partir de uma amostra aleatória, acontecer ao acaso?
Para haver significância estatística: O p-valor deve ser inferior a 0,05 (5%) ou outro valor pré-fixado pelo
investigador
Intervalo de confiança Qual a faixa de valores do resultado, numa probabilidade de 95%?
Para haver significância estatística: o IC de uma razão não pode incluir o 1
Vantagens:
•
Facilidade de execução com baixo custo relativo
•
Simplicidade analítica
•
Capacidade de geração de hipóteses
•
Alto potencial descritivo (planejamento em saúde)
Desvantagens:
•
•
Vulnerabilidade a vieses
Baixo poder analítico (em geral, inadequado para
testar hipóteses causais)
3
Estudo de coorte
Observa-se um determinado grupo de pessoas através do tempo e Comparam-se as expostas a um
determinado fator de risco/proteção e as não expostas objetivando estabelecer possíveis associações entre a
exposição e o desfecho nos dois grupos
Finalidades
Avaliação de etiologia; Avaliação da história natural da doença; Estudo de impacto de fatores prognósticos –
marcadores; Estudo de intervenções diagnósticas; Estudo de intervenções terapêuticas/preventivas
Desenhos – Subtipos
Concorrente (follow-up)
Concorrente (follow-up): A observação e o estudo têm início ao mesmo tempo
-
fixa
-
dinâmica
4
Não-concorrente (coorte histórica)
Não-concorrente (coorte histórica): A observação começa com a exposição mas o estudo só têm início
quando o desfecho já ocorreu
- fixa
Análise
Obs: é baseada na mesma tabela de contingência exemplificada a cima
Medida de freqüência do evento - incidência
Medidas de Associação: Risco Relativo
In (incidência na população total)= a+c/a+b+c+d
Risco Relativo = incidência de casos em expostos sobre incidência de casos em não expostos =
(a/a+b)/(c/c+d)
Quantas vezes a incidência da doença é maior em expostos em relação a não expostos
Quantas vezes maior é a probabilidade de um exposto adoecer, em relação ao não exposto
RR=2. Para cada não exposto doente há dois expostos doentes – FATOR DE RISCO
RR= 0,5. Para cada não exposto doente há 0,5 exposto doente – FATOR DE PROTEÇÃO
RR=1. Para cada não exposto doente há um exposto doente – exposição não é fator de risco nem de
proteção
Inferência estatística e precisão do estudo
São iguais ao estudo transversal, p<0,05 e IC 95% que não contenha o 1.
Medidas de efeito
Lembrando que...
Ie (incidência em expostos)= a/a+b
Iē (incidência em não expostos)=c/c+d
1. Risco Atribuível (RA) - Quantos casos a mais da doença decorreram do fator?
RA = Ie-Iē
5
É o número de casos entre expostos atribuídos exclusivamente à exposição. Só pode ser utilizada em
estudos de coorte ou estudo experimentais, onde se pode estimar de forma mais precisa a incidência da
doença
2. Risco Atribuível Percentual (RAP) - Proporcionalmente, em quanto foi aumentada a incidência da
doença?
RAP= (Ie-Iē / Ie )*100
É o percentual de casos expostos atribuídos exclusivamente à exposição
Ameaças à validade interna
Vieses: O viés é um erro sistemático oriundo da estratégia adotada no desenho ou na condução do estudo.
Podem ser:
• de seleção
Quando indivíduos têm diferentes probabilidades de serem incluídos/perdidos na amostra do estudo,
no que se refere à exposição, em referência à população de estudo. A verdadeira associação
exposição/desfecho pode ser distorcida.
• de informação ou classificação ou aferição
Erro sistemático de mensuração de um evento (exposição ou desfecho), quando os resultados podem
ser imputados à maneira como as variáveis são conceituadas ou medidas.
Confundimento: ocorre quando os resultados de uma associação entre dois fatores podem ser imputados,
total ou parcialmente, a um terceiro fator não levado em consideração; este terceiro fator, que está presente
na base populacional, é a variável de confundimento.
A variável de confundimento é um fator de risco (ou proteção) para o desfecho, independente da exposição.
Está sempre associada à exposição e ao desfecho, podendo mascarar um efeito existente ou ser responsável
por um efeito inexistente.
A existência de fatores de confundimento torna os grupos não-comparáveis.
Controle da validade interna
Vieses: Não há como resolver na análise. A condução do desenho do estudo deve ser cuidadosa para evitálos. Pode-se avaliar a direção e a magnitude do viés e as possíveis influências no resultado.
Confundimento: Pode-se controlar
No desenho (tentando evitar) – restrição e pareamento
Na análise (tentando ajustar o resultado)
• estratificação
• análise multivariada
Vantagens
Estabelece relação temporal entre exposição e doença
Produz medidas diretas de risco
Permite exame de exposições raras
Permite exame de vários desfechos
Bom poder analítico
Desvantagens
•
•
•
•
Necessidade de acompanhamento completo – tempo e custo
Vulnerável a perdas
Necessidade de indivíduos e/ou dados disponíveis
Não é eficiente para estudo de desfechos raros
6
Caso Controle
Parte do conjunto de casos já diagnosticados da doença em estudo; Ao mesmo tempo seleciona outro grupo:
controle – não afetado pelo agravo em estudo; Compara-se os dois grupos em relação aos fatores de
exposição para se obter informações acerca da relação causa efeito.
Tipos de Casos
Incidentes
mais demorado
maior custo
Prevalentes
difícil determinar se a característica em estudo está relacionada ao prognóstico ou à sua causa
influência da duração da doença (estão vivos e ainda doentes)- mistura de fatores etiológicos e
prognósticos
modificação de hábitos por causa da doença
Fonte de casos
Base hospitalar
registros médicos: hospitais, consultórios, seguradoras…
registros de doenças
Inquéritos de base populacional
mais caros
evita-se vieses de seleção devido a caracteristicas de serviços
Definição dos Controles
Os controles devem ser vistos como uma amostra da população que produziu os casos uma vez que são
selecionados para estimar a frequência da exposição nessa população
Hospitalar
Vantagens
Facilidade de identificação
Maior disponibilidade
7
Sujeitos aos mesmos fatores de seleção que fizeram com que os casos procurassem determinados
serviços de saúde – evita viés de seleção
Mais cooperativos – diminui viés de não participação
Cuidados
Atenção – um hospital pode ser referência para uma doença e não para outra – populações diferentes !
Cuidado ao selecionar as doenças dos controles hospitalares – exposição nos controles (os controles
têm maior probabilidade de serem expostos a múltiplos fatores de risco que a população em geral).
Escolher mais de uma doença para a seleção dos controles
População em geral
• Pode-se obter um controle aleatoriamente na população, mas isso dificulta e encarece o estudo;
Vizinhos
• Escolher um vizinho é uma alternativa mais fácil, porém anula algumas associações, como com
fatores associados ao local de moradia, saneamento, por exemplo.
Parentes e companheiros
Associação
Se a proporção de expostos ao fator for:
– maior entre os casos – é possível que se trate de um fator de risco
– maior entre os controles - é possível que se trate de um fator de proteção
Análise
Odds Ratio = (a/c)/(b/d)
Quando a doença é rara, a razão de chance de doença (OR) e o risco relativo (RR) são semelhantes
Odds Ratio
Quantas vezes maior é a chance de um doente ser exposto, em relação ao não doente
OR = 2 - a chance de um doente ser exposto é duas vezes a chance de um não doente ser exposto
OR = 0,5 - a chance de um doente ser exposto é a metade da chance de um não doente ser exposto
OR = 1 - a chance de um doente ser exposto é a mesma chance de um não doente ser exposto
Inferência estatística e precisão do estudo
São iguais ao estudo transversal, p<0,05 e IC 95% que não contenha o 1.
Ameaças à validade interna
Vieses
Viés de Seleção
Quando o grupo de controles não é composto por uma amostra representativa da população que deu origem
aos casos.
Os casos têm maior probabilidade de serem expostos do que a população de estudo, pela seleção?
Os controles têm maior probabilidade de serem expostos do que a população de estudo, pela seleção?
8
Viés de informação
Erro sistemático de aferição de um evento, quando os resultados podem ser imputados à maneira como as
variáveis são conceituadas ou medidas.
Viés de informação não diferencial
Definição inadequada das variáveis: seja quanto ao que deve ser considerado “caso” de doença ou de
“exposição” ao fator de risco, seja quanto à conceituação precisa das demais variáveis. Ex: má definição de
consumo de cafeína
Baixa validade dos instrumentos de coleta de dados (instrumento não apropriado para a mensuração). Ex: Má
calibração da balança.
Maior ênfase na procura dos dados em um dos grupos ou em determinados segmentos da população. Ex:
BPN maior cuidado na aplicação do questionário.
Viés de memória: quem tem um evento traumático tem maior tendência a se lembrar dos acontecimentos. Ex:
filho nasce com baixo peso e mãe lembra mais o consumo de café.
Confundimento
Ocorre quando os resultados de uma associação entre dois fatores podem ser imputados, total ou
parcialmente, a um terceiro fator não levado em consideração;
este terceiro fator é a variável de confundimento.
a variável de confundimento é um fator de risco (ou proteção) para o desfecho, independente da exposição.
a variável de confundimento está sempre associada à exposição e ao desfecho, podendo mascarar um efeito
existente ou ser responsável por um efeito inexistente.
Ex: Baixo Peso e cafeína – Confundimento: fumo; pré-natal; renda.
Controle de confundimento
Delineamento
PAREAMENTO
• Parear significa alocar controles (sujeitos) semelhantes aos casos para comparação;
RESTRIÇÃO
9
•
Seleção de casos e controles considerando o atributo de interesse. Ex: sexo feminino, faixa etária
especifica
Análise
• Através da estratificação
• Através da regressão logística
Vantagens
•
•
•
úteis quando se está diante de uma doença de baixa incidência e longo período de latência;
permitem a avaliação de diferentes fatores que possam estar atuando separada ou conjuntamente na
etiologia da doença;
Requerem, comparativamente, um número menor de indivíduos. Mais barato e mais rápido que
coorte.
Desvantagens
As informações se referem a eventos passados. Validação da informação é difícil ou impossível;
As taxas da doença em expostos e não expostos não podem ser determinadas: não podem estimar
taxas de incidência diretamente;
Não é adequado para avaliação de efeito terapêutico ou profilático de medicamentos – casos tenderão
sempre a utilizar mais medicamentos;
Apenas um desfecho por estudo.
10
Estudos de Intervenção
São estudos em que o investigador determina o fator a que os indivíduos serão expostos:
O investigador realiza uma intervenção
Exposição = intervenção
•um fator de proteção (vacina, ação educativa...)
•um tratamento (medicamento, cirurgia...)
Fármaco
ou vacina
em estudo
Intervenção
População
de estudo
Amostra
(critérios de
elegibilidade)
Alocação
randomizada
t0
Fármaco padrão
ou Placebo
Desfecho
(+)
Desfecho
(-)
t’
Desfecho
(+)
Controle
Desfecho
(-)
ENSAIOS CLÍNICOS RANDOMIZADOS (Randomized Controled Trials - RCT):
São estudos experimentais – o investigador introduz e controla/modula a exposição
São estudos prospectivos (sempre)
Parte-se de um único grupo de pessoas (definidas por critérios de elegibilidade) que são “alocadas” de forma
aleatória a dois grupos diferentes:
Experimental – recebe a intervenção em teste
Controle – não recebe a intervenção
(pode receber: nada, placebo ou tratamento padrão)
POPULAÇÃO:
•Critérios de elegibilidade
•Podem ser mais estritos – garantem maior adesão, menos perdas (ensaios exploratórios - eficácia)
•Podem ser mais abertos – garantem maior generalização (ensaios pragmáticos - efetividade)
RANDOMIZAÇÃO:
É a alocação aleatória dos indivíduos aos grupos de comparação, geralmente realizada através de uma tabela de
números aleatórios.
Garante a comparabilidade dos grupos – todos os indivíduos têm a mesma probabilidade de estar no grupo
exposto ao fator profilático ou terapêutico em teste ou ao grupo controle.
Garante a seleção não enviesada dos participantes – não há auto-seleção nem interferência do investigador
Sucesso depende de:
1. Geração adequada de um seqüência imprevisível (porém reprodutível)
•Ocultamento (concealment) – desconhecimento da seqüência de randomização até o momento da alocação - É
importante para evitar manipulações da alocação que podem comprometer a comparabilidade dos grupos.
•Num ensaio clínico bem conduzido, a decisão de incluir ou não um paciente no estudo deve anteceder a sua
randomização. Os participantes e a equipe de campo não sabem, com antecedência, a que tratamento a próxima
pessoa será alocada.
2. Tamanho da amostra
11
Caso o tamanho da amostra seja insuficiente, os grupos podem não ficar comparáveis, sendo necessário controlar
fatores de confundimento
TIPOS DE INTERVENÇÃO:
•Fármacos
•Vacinas
•Procedimentos cirúrgicos
•Estilo de vida – dieta, atividade física
•Via de administração e dose
•Grupos de comparação – mais de um procedimento sendo avaliado
•Escolha da comparação – fármaco ou procedimento padrão, placebo
•Ensaio aberto ou cegado
MASCARAMENTO - Ensaios abertos (open trial) vs. ensaios cegos ou mascarados (blind or masked):
A intervenção e a verificação dos resultados podem ser dissimuladas, com o uso de placebos e técnicas de
mascaramento, para não influenciar o indivíduo, os profissionais examinadores, o avaliador.
Procedimento simples (só o paciente)
Procedimento duplo cego (paciente e equipe de campo)
Procedimento triplo cego (paciente, equipe de campo e responsável pela análise dos dados)
PLACEBO:
•Técnica especial de mascaramento (cegamento)
•Os pacientes do grupo controle recebem um tratamento similar em formato, gosto, doses, via de administração
porém sem função farmacológica ou terapêutica.
•Os pacientes ficam “cegados” em relação à exposição (não sabem se é a intervenção em teste ou uma
intervenção inócua biologicamente)
•O placebo permite melhor definição do efeito da intervenção teste, mas nem sempre pode ser usado.
•Retira a subjetividade do paciente (por também estar sendo “tratado” – efeito placebo) e do investigador
DESFECHO EM ENSAIOS CLÍNICOS:
•Evento clínico – caso de doença, óbito, recaída, internação, capacidade funcional
•Evento biológico – tamanho do tumor, número de lesões
•Evento laboratorial – contagem de células, parâmetros bioquímicos
AMEAÇAS À VALIDADE INTERNA:
Confundimento
É um outro fator que, independente da exposição, é risco ou proteção para o desfecho
Viés de seleção
erro na seleção dos participantes do estudo
é minimizado pela escolha aleatória dos participantes, mas pode ocorrer: perda seletiva e não-cooperação
Viés de informação
erro na coleta dos dados do estudo
pode ocorrer quando o desfecho é aferido diferentemente nos 2 grupos de comparação, mas é minimizado se
houver mascaramento
ANÁLISE DOS RESULTADOS:
Quanto ao tipo
Análise por intenção de tratamento – para manutenção dos grupos tal qual foram formados pela randomização
Análise por protocolo - com os que de fato completaram o tratamento
A ÉTICA NO ENSAIO CLÍNICO:
Questões:
•garantia de que a relação risco/benefícios do tratamento proposto é favorável.
•conhecimento por parte do paciente das possibilidades de intervenção
•só fazer uso de placebo na ausência de tratamentos convencionais
•inclusão ao acaso dos participantes do estudo nos grupos exposto e controle
•Uso de termo de consentimento informado
Fluxograma de participação
12
Fluxograma de participação
Avaliados quanto à
elegibilidade (n=)
Recrutamento
Randomizados
Alocação
Seguimento
Análise
Alocados para intervenção
em teste (n)
Receberam/ não intervenção
(n) (dar razões)
Total de excluídos (n)
s/ critérios inclusão (n)
Recusa (n)
Outras razões (n)
(n)
Alocados para intervenção
convencional ou placebo (n)
Receberam/ não a intervenção
(n) (dar razões)
Perda seguimento (razões) (n)
Descontinuidade (razões) (n)
Perda seguimento (razões) (n)
Descontinuidade (razões) (n)
Aferição do desfecho
Aferição do desfecho
Analisados (n)
Excluídos da análise (razões) (n)
Analisados (n)
Excluídos da análise (razões) (n)
COMO SABER SE O TRATAMENTO VALEU A PENA? ATRAVÉS DO CÁLCULO DA MEDIDA DE
ASSOCIAÇÃO:
Tabela de Contingência:
Grupo
Caso
Não caso
Total
Expostos
a
c
a+c
b
d
b+d
a+b
c+d
a+b+c+d
(grupo
Não expostos
experimental)
(grupo controle)
Total
13
MEDIDA DE ASSOCIAÇÃO - RISCO RELATIVO:
Ie=
(ou RT)
Ine=
(ou Rc)
Casos entre
expostos
a
Total de expostos (casos e não
casos)
a +b
____________________
Casos entre
não
expostos
c
Total de não expostos (casos e não
casos)
c+d
Ex: RR = 16/150 = 0,11 = 0,47
35/150 0,23
Exposição é fator de proteção
COMO CONHECER A EFICÁCIA DO TRATAMENTO? ATRAVÉS DO CÁLCULO DAS MEDIDAS DE EFEITO:
•Quantos casos a menos da doença ocorreram com o tratamento?
•Proporcionalmente, em quanto foi reduzida a incidência da doença?
•Quantas pessoas preciso tratar para evitar um caso da doença?
•Redução absoluta do risco
•Redução relativa do risco
•Número necessário para tratar
As medidas de efeito encontradas indicam em que medida o efeito observado se deveu à exposição
1) Redução Absoluta do Risco - RAR.
A RAR é a diferença entre a incidência de casos entre os controles e a incidência de casos entre os tratados
RAR = Ine - Ie
RAR = Rc - Rt
Descreve a magnitude da mudança em termos absolutos
Ex: Pacientes com psicose, em tratamento para evitar recaída.
Risco de recaída terapia padrão (Rc)= 40% ou 0,4
Risco de recaída com terapia nova (Rt) =30% ou ou 0,3
Redução absoluta do risco (RAR)= 40–30 = 10%
Ocorreram 10 casos a menos a cada 100 pacientes tratados.
2) Redução Relativa do Risco (RRR)
Traduz o percentual da redução da incidência de casos no grupo tratado, comparado com a incidência de
casos no grupo controle.
RRR= Incidência de Casos no Grupo Controle (Rc) - Incidência de Casos no Grupo Tratado (Rt) / Incidência de
Casos no Grupo Controle (Rc) * 100.
RRR = (Ine – Ie / Ine) * 100 = RAR / Ine * 100
Ex: Pacientes com psicose, em tratamento para evitar recaída.
Redução absoluta do risco (RAR)= 40–30 = 10%
Redução relativa do risco (RRR) = (40-30)/ 40 *100 = 25%
A redução de recaída pelo tratamento novo foi 25%
14
RAR = 40% - 30%
Pacientes
com sicose
Recaída
Recaída
Sim
Não
Expostos
(tratamento
30
70
100
Não expostos
(tratamento
padrão)
40
60
100
Total
70
130
200
Total
=
10%
RRR = 10%/40% = 25%
Trat novo vs padrão
experimental)
3) Número Necessário Para Tratar (NNT)
O NNT traduz o número de pacientes que são necessários tratar para evitar um caso (de doença, morte, etc).
Medida de custo/benefício
NNT = 1/ (Ine – Ie) = 1 / RAR (utilizar o RAR em sua forma decimal).
Ex: NNT = 1 / 0,10= 10
preciso tratar 10 pacientes com psicose com com terapia nova para evitar um caso de recaída.
MEDIDAS COMPARATIVAS:
•Em alguns ensaios clínicos, simplesmente comparam-se os resultados do grupo tratamento e do grupo controle,
sem calcular medidas de associação:
•Variáveis dicotômicas – comparação de proporções
•Variáveis contínuas – comparação de médias, medianas
•O teste de significância será realizado de acordo com o tipo de variável
VANTAGENS DA RCT:
O tratamento e os procedimentos são decididos a priori e uniformizados na sua aplicação.
Os grupos (de estudo e controle) têm grande chance de serem comparáveis em termos de variáveis de
confundimento (se o tamanho da amostra for grande).
A cronologia dos acontecimentos é determinada sem equívocos: existe a certeza de que o tratamento é
aplicado antes de aparecerem os efeitos.
A qualidade dos dados sobre a intervenção e os efeitos pode ser de excelente nível, já que é possível proceder
à sua coleta no momento em que os fatos ocorrem.
Os resultados são expressos em coeficientes de incidência, a partir dos quais são calculadas as medidas de
associação.
Muitos desfechos clínicos podem ser investigados simultaneamente.
Alta credibilidade como produtor de evidências científicas.
DESVANTAGENS DA RCT:
Por questões éticas, muitas situações não podem ser experimentalmente investigadas, como os efeitos de
viroses na gravidez sobre recém-nascidos.
Exigência de população estável e cooperativa: para evitar grandes perdas de seguimento e recusas de
participar.
Grupo investigado pode ser altamente selecionado, não-representativo, devido à múltiplas exigências quanto
às características de inclusão e exclusão dos participantes no estudo.
Alguns participantes deixam de receber um tratamento potencialmente benéfico, ou são expostos a um
procedimento maléfico.
Impossibilidade de ajustar o tratamento (dose, duração, etc.) em função das necessidades de cada indivíduo.
Requerem estrutura administrativa e técnica de porte razoável estável, bem preparada e estimulada, para
levar a bom termo um projeto complexo, minucioso e usualmente caro.
15
Análise de Sobrevida
QUE DESENHO DE ESTUDO?
Coorte
No geral, dinâmica
CARACTERÍSTICAS:
Estudo de dados relacionados ao tempo até a ocorrência de um determinado evento de interesse.
O tempo inicial e o tempo final do estudo são pré-definidos.
Mas podem não ser iguais para todos os participantes do estudo – o que é mais usual.
Estimar a sobrevida de um grupo populacional desde um determinado tempo T até a ocorrência de algum
evento (doença, morte...)
Verificar em um conjunto de indivíduos, vivos em um determinado tempo T, quantos sobreviverão a um tempo
T + T.
tempo
Indivíduos seguidos
Ocorrência do evento
T
T + T
Exemplos:
• Qual a probabilidade de um paciente sobreviver por mais de dois anos após o diagnóstico de insuficiência
cardíaca chagásica estágio D da ACC/AHA
•
Qual o risco de um paciente diagnosticado com IC chagásica estágio D vir a falecer em até 90 meses após o
diagnostico?
•
Qual o tempo mediano de sobrevida?
QUE EVENTOS PODEMOS ANALISAR?
Morte, cura, recrudescimento de uma doença pós-terapia, desmame, etc...
O evento ou fenômeno é considerado como uma falha, por representar em geral uma experiência negativa.
DADOS CENSURADOS:
O dado é censurado para um indivíduo quando não se conhece o status do desfecho durante o tempo do estudo.
Causas de censura:
- Estudo termina
- Perda do seguimento (mudou-se...)
- Morte (ou outro evento) por outras causas
FUNÇÃO DE SOBREVIDA – S(T):
S(t) - Probabilidade do indivíduo sobreviver além de um determinado tempo t.
S(t) = 1 para T = 0
S(t) = 0 para T =
• Qual a probabilidade de um paciente sobreviver por mais de dois anos após
o diagnóstico IC chagásica grau B?
Exemplo:
1.
23 indivíduos portadores de IC são acompanhados
2.
Entram no estudo em momentos diferentes
3.
Total de tempo de acompanhamento: 240 meses
4.
Dois estágios: C e D
5.
No momento 0 (entrada de cada paciente no estudo), a sobrevida é de
100%, todos estão vivos 6.
S(t) = 1 para T = 0
7.
Se acompanharmos o grupo por um longíssimo tempo, a sobrevida
chegará a 0%, todos terão morrido
8.
S(t) = 0 para T =
9.
7. Se acompanharmos por +/- tempo curto, teremos um percentual sobreviventes entre 0 e 100.
16
FUNÇÃO DE SOBREVIDA - ESTIMAÇÃO DE KAPLAN-MEIER:
É uma abordagem para estimar a função de sobrevida
Os tempos observados da coorte definem os valores de t em relação aos quais a sobrevida é avaliada
A estimação de KM é uma estimação de tábua de vida
Com números de tempos (t=intervalos) igual ao número de eventos na coorte.
Assegura que os degraus são os menores possíveis
Os problemas com os abandonos são minimizados
• Incorpora à análise os indivíduos que saíram do estudo (final do tempo de acompanhamento) e sobreviveram
– incorporado à população exposta ao risco no tempo imediatamente anterior à saída desses indivíduos.
• Permite que cada indivíduo contribua com seu tempo total e exato de seguimento.
• Neste método, as variáveis devem ser analisadas isoladamente ou por estratificação.
Exemplo:
1)
2)
• Qual a probabilidade de um paciente diagnosticado com IC estágio D
semanas do diagnostico? E de um paciente em estágio C?
• Qual a mediana de sobrevida para cada um dos estágios?
sobreviver após 23
3)
Me ans and Medians for Surviva l Time
a
estágio
D
C
Overall
Estimate
22.708
67.864
43.233
Std. Error
4.385
18.315
10.087
Mean
95% Confidence Interval
Lower Bound Upper Bound
14.114
31.303
31.967
103.760
23.462
63.003
Estimate
23.000
44.000
27.000
Std. Error
11.427
19.399
4.909
Median
95% Confidence Interval
Lower Bound Upper Bound
.603
45.397
5.978
82.022
17.379
36.621
a. Estimation is limited to the largest survival time if it is censored.
17
TESTE DE IGUALDADE DAS DISTRIBUIÇÕES DA SOBREVIDA - LOG RANK:
Exemplo:
Overall Comparisons
Log Rank (Mantel-Cox)
Chi-Square
5.700
df
1
Sig.
.017
Tes t of equality of s urvival dis tributions for the different levels of
estágio Estágio da IC.
Para avaliar se as curvas são estatisticamente equivalentes, ou seja, se a sobrevida do grupo C é diferente do
grupo D, utiliza-se o método de comparação de curvas de sobrevida pelo teste log-rank.
FUNÇÃO DE RISCO - HAZARD FUNCTION:
Se a cada instante morrem muitas pessoas, no final do tempo T + T menos pessoas sobreviveriam, assim a
sobrevivência depende do potencial instantâneo de ocorrência do evento, denominado “Hazard Function”.
Quanto maior a Hazard Function menor a sobrevida e vice-versa.
Exemplo:
• Qual o risco de um paciente diagnosticado com IC estágio D vir a falecer em 23 semanas após o diagnostico?
E de um paciente em estágio C?
• Qual a mediana de sobrevida para cada um dos estágios?
Sobrevida = probabilidade (0 - 1)
Hazard = taxa (medida de densidade de incidência)
(0 - )
18
H (t)
S(t)
REGRESSÃO DE COX (HR):
Estima o efeito conjunto de variáveis individuais na mortalidade, e portanto na sobrevida dos indivíduos.
Interpretação da hazard ratio:
HR = 1 (não há relação entre a exposição e o tempo de sobrevida)
HR= 5 (os indivíduos expostos têm uma Hazard 5 vezes a harzard dos não expostos)
HR= 0,2 ou 1/5 (os indivíduos expostos têm uma hazard 1/5 da hazard dos não expostos - a exposição é
protetora)
MÉTODOS DE ANÁLISE DE SOBREVIDA:
1- Kaplan- Meier - análise bivariada ou estratificada: Calcula a probabilidade de sobrevida acumulada.
2- Regressão de Cox - análise multivariada (regressão múltipla): Permite avaliar o impacto de vários
fatores prognósticos no tempo de ocorrência do desfecho.
Exemplo:
Em um estudo de sobrevida pós-cirurgia para câncer de mama, foi avaliada a sobrevida em meses.
Figura 1 – comparação entre o grupo com linfonodo negativo e positivo
Figura 2 – comparação entre grupo > 40 anos e até 40 anos
19
Problema 1
Testes diagnósticos
•Paciente chega com queixa de “dor aguda no joelho” e aponta para o joelho direito, que se encontra edemaciado.
•Em pacientes que apresentam quadro agudo de dor e edema articular, a identificação (diagnóstico) e o tratamento
precoce da artrite séptica podem reduzir morbidade e mortalidade.
•Será que este paciente tem artrite séptica?
•O que pode me ajudar a responder esta questão?
O QUE É UM TESTE DIAGNÓSTICO?
Exames realizados em laboratório ou imagem (hemograma completo, bioquímica do líquor, RX, ultrasonografia)
Conjunto de sinais e sintomas
Anamnese
Questionários
O QUE ESTES ESTUDOS MOSTRARAM?
•Dor articular
•Sensibilidade: 85% (IC95% 78%-90%)
•História de edema articular
•Sensibilidade: 78% (IC 71%-85%),
•Febre
•Sensibilidade: 57% (IC 52%-62%)
•Contagem leucocitária sangue –
•Sensibilidade de 75% e especificidade 55%
•Contagem leucocitária líquido sinovial –
•Sensibilidade de 50% e especificidade de 88%
DE ONDE VEIO ESTA INFORMAÇÃO?
•Como avaliar se um teste diagnóstico é bom?
•Quais as características que um teste deve ter?
•Estudos de teste diagnóstico – como são feitos?
Margaretten et al. Does this adult patient have septic arthritis? JAMA. 2007;297(13):1478-88
OBJETIVO: Avaliar a acurácia do exame clínico/anamnese e exames laboratoriais rápidos para o diagnóstico de
artrite bacteriana.
MÉTODOS: Comparação de sinais clínicos e laboratoriais de 6242 pacientes, usando como padrão ouro a cultura
sinovial ou hemocultura.
CARACTERÍSTICAS DO TESTE:
• Teste positivo na presença da doença
• Teste positivo na ausência da doença
• Teste negativo na presença da doença
• Teste negativo na ausência da doença
Diagnosticada a partir de outro teste: o Padrão Ouro
20
AVALIAÇÃO DO DESEMPENHO DE UM TESTE DIAGNÓSTICO:
Possíveis Resultados de um Teste Diagnóstico para Identificar status Doença:
DOENÇA(padrão-ouro)
PRESENTE
TESTE
AUSENTE
TOTAL
+
a
Verdadeiro
positivo
b
Falso
positivo
a+b
-
c
Falso
negativo
d
Verdadeiro
negativo
c+d
TOTAL
a+c
b+d
a+b+c+d
Possíveis Resultados de um Teste Diagnóstico para Identificar status Doença
DOENÇA(padrão-ouro)
PRESENTE
TESTE
AUSENTE
+
a
Verdadeiro
positivo
b
Falso
positivo
-
c
Falso
negativo
d
Verdadeiro
negativo
TOTAL
a+c
b+d
Possíveis Resultados de um Teste Diagnóstico para Identificar status Doença
DOENÇA(padrão-ouro)
PRESENTE
TESTE
AUSENTE
+
a
Verdadeiro
positivo
b
Falso
positivo
-
c
Falso
negativo
d
Verdadeiro
negativo
TOTAL
a+c
b+d
21
AVALIAÇÃO DO DESEMPENHO DA LEUCOMETRIA NO DIAGNÓSTICO DE ARTRITE SÉPTICA:
SENSIBILIDADE (S):
Artrite séptica diagnosticada por cultura do líquido sinovial (teste ouro)
Leucometria
sinovial
PRESENTE
AUSENTE
+
8
Verdadeiro positivo
17
Falso positivo
-
8
Falso negativo
123
Verdadeiro negativo
16
130
Total
Sensibilidade= 8/16=50%
É a proporção de verdadeiros positivos entre todos os doentes.
Expressa a probabilidade de um teste dar positivo na presença da doença
Avalia a capacidade do teste identificar a doença quando ela está de fato presente
S
a
ac
ou
VP
VP FN
Indica o percentual de doentes detectados pelo teste
ESPECIFICIDADE (E):
Artrite séptica diagnosticada por cultura do líquido sinovial (teste ouro)
Leucometria
sinovial
PRESENTE
AUSENTE
+
8
Verdadeiro positivo
17
Falso positivo
-
8
Falso negativo
123
Verdadeiro negativo
16
140
Total
É a proporção de verdadeiros negativos entre todos os sadios.
Expressa a probabilidade de um teste dar negativo na ausência da doença.
Avalia a capacidade de o teste afastar a doença quando ela está ausente.
• Indica o percentual de sadios detectados pelo teste
E
d
ou
bd
VN
FP VN
INDICADORES DO DESEMPENHO DO TESTE - SENSIBILIDADE X ESPECIFICIDADE:
•Um teste muito sensível raramente deixará de diagnosticar indivíduos com a doença.
•Um teste muito específico raramente classificará como doente um indivíduo sem a doença.
22
Sensibilidade
Especificidade
Verdadeiros
Negativos
(d)
Verdadeiros
Positivos
(a)
Total
de sadios
(b+d)
Total
de doentes
(a+c)
PARA QUE USAR UM TESTE SENSÍVEL?
• Rastreamento de doenças
•
Quando a penalidade de deixar um doente sem diagnóstico é muito alta
•
Início do processo diagnóstico - afastar hipóteses diagnósticas
PARA QUE USAR UM TESTE ESPECÍFICO?
• Para confirmar um diagnóstico
• Quando a penalidade de considerar um sadio como positivo é muito alta
Problema 2:
•O paciente chega com a queixa de dor no joelho e traz um resultado de líquido sinovial:
•Contagem de leucócitos > 50.000
•Qual a probabilidade de que este paciente tenha realmente artrite séptica?
Ou seja:
•Qual a probabilidade de um resultado positivo pertencer realmente a um paciente doente?
•Qual a probabilidade de um resultado negativo pertencer realmente a um paciente sadio?
•A probabilidade de predizer a doença, dado os resultados do teste diagnóstico, é o valor preditivo do teste.
VALOR PREDITIVO:
•Depende das características do teste e da prevalência da doença na população.
Probabilidade pré-teste:
•É a prevalência da doença no grupo em questão.
P=
a+c
a+b+c+d
•Exprime a probabilidade de haver a doença, antes de se fazer o teste (pode ser atribuída pelo médico).
Probabilidade pós-teste:
•É o valor preditivo.
Avaliação do desempenho de um teste diagnóstico:
Possíveis Resultados de um Teste Diagnóstico para Identificar status Doença
DOENÇA(padrão-ouro)
PRESENTE
TESTE
+
TOTAL
a
Verdadeiro
positivo
c
Falso
negativo
AUSENTE
b
Falso
positivo
d
Verdadeiro
negativo
TOTAL
a+b
c+d
a+b+c+d
23
Possíveis Resultados de um Teste Diagnóstico para Identificar status Doença
DOENÇA(padrão-ouro)
PRESENTE
TESTE
AUSENTE
a
Verdadeiro
positivo
c
Falso
negativo
+
-
TOTAL
b
Falso
positivo
d
Verdadeiro
negativo
a+b
c+d
TOTAL
a+b+c+d
VALOR PREDITIVO POSITIVO (VPP):
É a proporção de verdadeiros positivos entre todos os indivíduos com teste positivo.
Expressa a probabilidade de um paciente com o teste positivo ter a doença.
VPP
a
ab
ou
VP
VP FP
Artrite sépitica diagnositicada por cultura do líquido sinovial (teste ouro)
PRESENTE
8
+
Verdadeiro
positivo
Leucometria
sinovial
-
8
Falso negativo
AUSENTE
17
Falso positivo
123
Verdadeiro
negativo
25
VPP=8/25=32%
131
VPN=123/131=94%
VALOR PREDITIVO NEGATIVO (VPN):
É a proporção de verdadeiros negativos entre todos os indivíduos com teste negativo.
Expressa a probabilidade de um paciente com o teste negativo não ter a doença.
VPN
d
cd
ou
VN
VN FN
Artrite séptica diagnosticada por cultura do líquido sinovial (teste ouro)
PRESENTE
Leucometria
sinovial
8
+
Verdadeiro
positivo
-
8
Falso negativo
AUSENTE
17
Falso positivo
123
Verdadeiro
negativo
25 VPP=8/25=32%
131 VPN=123/131=94%
VALOR PREDITIVO:
•Quanto mais sensível o teste, melhor seu VPN, isto é, maior a segurança de que um paciente com resultado
negativo não tenha a doença.
•Quanto mais específico o teste, maior seu VPP, ou seja, maior a segurança de que um indivíduo com resultado
positivo tenha a doença.
•Quanto maior a prevalência da doença, maior o VPP e menor o VPN.
•Quanto menor a prevalência da doença, maior o VPN e menor o VPP.
VALOR PREDITIVO - RESUMINDO:
VPP:
Mede a probabilidade de um teste positivo ser de um doente
Mede a probabilidade pós- teste
Quanto maior a prevalência maior o VPP
Quanto maior a especificidade, maior o VPP
24
VPN:
Mede a probabilidade de um teste negativo ser de um sadio
Quanto menor a prevalência, maior o VPN
Quanto maior a sensibilidade, maior o VPN
CONTRABALANÇO ENTRE SENSIBILIDADE E ESPECIFICIDADE NO DIAGNÓSTICO DE DM USANDO VARIÁVEL
CONTÍNUA):
Nível glicêmico sensibilidade especificidade 1-especificidade
70
98.6
8.8
91.2
80
97.1
25.5
74.5
90
94.3
47.6
52.4
100
88.6
69.8
30.2
110
85.7
84.1
15.9
120
71.4
92.5
7.5
130
64.3
96.9
3.1
140
57.1
99.4
0.6
150
50
99.6
0.4
160
47.1
99.8
0.2
170
42.9
100
0
180
38.6
100
0
190
34.3
100
0
200
27.1
100
0
COMO DETERMINAR O PONTO DE CORTE?
Medidas Contínuas
Valor de Corte para Teste Positivo
Proporção
Sadios
Doentes
VN
VP
FN FP
Glicemia de jejum
Valor de Corte para teste positivo
Proporção
Doente
VN
Proporção
Sadio
Sadio
Doente
VN
TP
VP
Aumento da especificidade
Diminuição da sensibilidade
FN
FP
FN
Glicemia de Jejum
FP
Glicemia de Jejum
Aumento da sensibilidade
Diminuição da especificidade
25
CURVA ROC:
Acurácia da glicose sanguínea 2h pós prandial como teste diagnóstico para DM – Fletcher. Epidemiologia Clínica 3a
ed pg 61
120
100
80
60
40
20
0
0
20
40
60
80
100
Acurácia do teste: área sob a curva de ROC
ACURÁCIA OU VALIDADE:
É a proporção de acertos de um teste diagnóstico, ou seja, a proporção entre os VP e VN em relação aos
resultados possíveis.
É a soma dos resultados verdadeiros sobre o total: A =
a+d
a+b+c+d
teste
positivo
teste
negativo
TOTAL
Doentes
Não doentes
TOTAL
a
b
a+b
c
d
c+d
a+c
b+d
a+b+c+d
ARTICULANDO AS INFORMAÇÕES:
•Não existe teste diagnóstico com sensibilidade e especificidade = 100 %
•O clínico não pode se basear em apenas um teste para diagnosticar uma doença.
TESTES MÚLTIPLOS:
Os testes múltiplos aumentam a qualidade do diagnóstico.
Podem ser feitos:
•
em paralelo
•
em série
Testes em paralelo (“ou”):
São utilizados:
• quando há urgência de um diagnóstico
• quando os testes disponíveis tem
baixa sensibilidade ou dificuldade de acesso
• faz aumentar a sensibilidade e diminuir a especificidade (corre-se o risco de tratar pacientes que não têm a
doença)
• faz aumentar o VPN e diminuir o VPP
Testes em série (“e”):
São utilizados quando não há urgência, quando o teste é invasivo ou caro
•
deve-se usar primeiro o de maior sensibilidade / mais barato / menos invasivo.
•
o teste mais específico só é realizado se o anterior for positivo
•
faz aumentar o VPP
26
Revisão Sistemática e Meta-análise
REVISÃO TRADICIONAL X REVISÃO SISTEMÁTICA:
•Abrangente (vários enfoques)/ superficial
•Busca bibliográfica segundo critério do autor
•Seleção dos artigos segundo critério do autor
•Extração dos dados de forma não explicitada
•Sumarização heterogênea
•Análise não quantitativa
•Busca bibliográfica segundo critérios definidos
•Seleção dos artigos segundo critérios de
inclusão/exclusão e critérios de qualidade
•Extração dos dados de forma padronizada
•Sumarização dos dados em forma de tabelas e
gráficos
•Análise (medida sumário)**
•Focada (hipótese) /aprofundada
REVISÃO SISTEMÁTICA:
Revisão de estudos através de uma estratégia que limita o viés na reunião sistemática, avaliação crítica e
síntese de todos os estudos relevantes sobre um tópico específico.
META-ANÁLISE**:
Análise que combina e integra os resultados de estudos independentes, considerados homogêneos. Tem como
propósito explicar possíveis inconsistências entre eles e calcular uma medida-sumário de seus resultados.
ETAPAS (DE UMA REVISÃO SISTEMÁTICA OU META-ANÁLISE):
a) Formular a pergunta (a partir de hipóteses):
H (artigo 2): o baixo peso ao nascer aumenta o risco de distúrbios metabólicos na vida adulta
H: (artigo 3)atividade física na escola reduz obesidade em adolescentes.
b) Definir critérios de inclusão e de exclusão de estudos (a partir da hípótese)
Desenho: ensaios clínicos, estudos observacionais
Participantes: sexo, idade, características clínicas
Exposição: dose, duração
Desfecho: doença, morte, cura, tempo
Tipo de artigo incluído na revisão
H (Artigo 2): o baixo peso ao nascer aumenta o risco de distúrbios metabólicos na vida adulta
H (Artigo 3) - atividade física na escola reduz obesidade em adolescentes.
c) Identificação de estudos
•Bases eletrônicas (através de palavras-chave):
•Medline
•Embase
•Lilacs
•Cochrane
•Referências bibliográficas de artigos
•Especialistas, congressos, simpósios
•Busca manual de artigos
d) Seleção de estudos
•segundo critérios de inclusão/exclusão
•pela avaliação da qualidade do estudo
Identificação dos estudos – busca:
Fluxograma de seleção de estudos:
27
Avaliação de qualidade:
e) Extração da informação
•formulário para extração de dados
•mínimo de 2 investigadores
(Recomendação do International Committee of Journal Editors)
•Instrumentos específicos (checklists):avaliar itens metodológicos e validade:
•CONSORT (Consolidated Standards of Reporting Trials) – www.consort-statement.org
•STROBE (STrengthening the Reporting of OBservational studies in Epidemiology) - ww.strobe-statement.org
•STARD (Towards Complete and Accurate Reporting of Studies on Diagnostic Accuracy) - www.consortstatement.org/Initiatives/newstard.htm
f) Análise:
•escolha da medida de associação (RR, OR, DIFERENÇA)
•construção de tabelas* / gráficos **
•explorar fontes de heterogeneidade
•cálculo de medida-sumário**
g) Interpretação dos resultados
•força da evidência
•relevância para pacientes: benefícios x riscos
Apresentação de tabelas:
28
Cálculo de medida-sumário:
META-ANÁLISE:
•O efeito da intervenção / tratamento é calculado como uma média ponderada dos efeitos de cada estudo.
•Os pesos são o inverso da variância do efeito do tratamento/intervenção de cada estudo (que está associado
com o tamanho da amostra).
•Ao combinar estudos homogêneos,a meta-análise aumenta o número de observações, e o poder estatístico de
detectar os efeitos.
•Quando se lida com estudos conduzidos em circunstâncias distintas, os resultados diferentes podem
contribuir para a melhor compreensão do fenômeno que se deseja investigar.
Exemplo:
Anticoagulantes e IAM
Risk ratio
(95% CI)
Study
% Weight
1
0.23 (0.03,1.75)
0.2
2
0.57 (0.20,1.66)
0.3
3
1.35 (0.74,2.45)
0.6
4
1.22 (0.67,2.24)
0.7
5
1.01 (0.55,1.85)
0.8
6
0.70 (0.53,0.92)
4.1
7
0.46 (0.25,0.83)
1.2
8
0.78 (0.48,1.27)
1.4
9
2.38 (0.65,8.71)
0.1
10
1.05 (0.48,2.28)
0.4
11
0.96 (0.33,2.80)
0.3
12
0.90 (0.63,1.28)
2.3
13
2.57 (0.34,19.48)
0.1
14
0.61 (0.42,0.89)
2.7
15
0.28 (0.03,2.34)
0.1
16
1.16 (0.84,1.60)
2.2
17
0.81 (0.26,2.51)
0.2
18
0.85 (0.54,1.34)
19
0.51 (0.33,0.78)
20
0.88 (0.62,1.25)
2.7
21
0.83 (0.75,0.91)
32.3
22
0.77 (0.70,0.84)
43.9
Overall (95% CI)
0.80 (0.75,0.85)
.030012
1
1.3
2.1
33.3199
Risk ratio
HETEROGENEIDADE:
•Heterogeneidade clínica. Estudos diferem quanto a: participantes (idade, severidade), intervenção (dose),
acompanhamento, desfecho.
Odds ratio
(95% CI)
Study
% W eight
1
0.10 (0.02,0.46)
2
0.17 (0.01,3.82)
1.2
3
0.23 (0.10,0.52)
11.7
4
0.37 (0.15,0.96)
5
0.48 (0.22,1.06)
9.1
6
0.48 (0.23,1.01)
10.2
7
0.55 (0.08,3.59)
1.5
8
0.56 (0.13,2.34)
2.5
9
0.56 (0.23,1.34)
6.8
10
0.59 (0.27,1.30)
8.1
11
0.96 (0.40,2.28)
5.2
12
1.00 (0.29,3.50)
2.4
13
1.03 (0.39,2.71)
4.0
14
1.07 (0.45,2.54)
4.9
15
1.12 (0.28,4.54)
1.8
16
1.20 (0.29,4.91)
1.8
17
1.36 (0.62,2.99)
5.3
18
1.38 (0.36,5.34)
1.8
19
2.37 (1.34,4.19)
7.9
Overall (95% CI)
0.76 (0.61,0.93)
.007758
1
6.5
7.2
128.901
Odds ratio
Intervalos de confiança de alguns estudos não englobam os riscos relativos observados por outros estudos
•Heterogeneidade estatística. Variação entre os resultados dos estudos é maior do que a esperada ao acaso.
29
MANEJO DA HETEROGENEIDADE:
A presença da heterogeneidade não é um problema para a meta-análise, mas uma oportunidade para
investigar por que o efeito da intervenção / tratamento varia em diferentes circunstâncias.
Possibilidades:
Não combinar resultados - explicar causas da heterogeneidade.
Combinar estudos usando efeitos aleatórios - conhecer um efeito médio.
ANÁLISE DE SUBGRUPO:
•Apresentar os resultados para subgrupos previamente determinados (hipótese)
De pacientes
De intervenções
De desfechos
VIESES EM ESTUDOS DE REVISÃO SISTEMÁTICA:
Vieses de seleção:
1. Viés de Publicação:
Ocorre quando estudos inteiros, ou parte de seus dados, não são publicados em função do resultado obtido.
Tal decisão tende a produzir um predomínio de publicações com resultados positivos, aumentando a
probabilidade de que um resultado falso-positivo.
Pode ser avaliado graficamente (gráfico de funil)
2. Viés de Idioma:
Os estudos são identificados, mas excluídos em função da língua. A situação mais freqüente é a exclusão de
artigos publicados em outro idioma, que não o inglês, em meta-análises publicadas em inglês.
Gráfico funil para avaliar viés de publicação:
Vieses de informação:
1. Viés de extração
Ocorre quando estudos são avaliados de forma não padronizada, permitindo heterogeneidade na extração dos
dados. Pode ser minimizado com a adoção de instrumentos validados.
2. Viés do investigador
Ocorre quando o investigador conhece os autores e pode ficar sugestionado. Pode ser minimizado ocultandose a identificação do artigo (avaliação mascarada).
REVISÃO SISTEMÁTICA E META-ANÁLISE:
Essenciais para:
• a tomada de decisões na medicina clínica
•o planejamento e a administração da área da saúde
•a definição de políticas e programas a serem implementados
•o estabelecimento de estratégias de pesquisa mais adequadas aos estudos etiológicos.
30