2º EM
Química A
Wesley
Av. Trimestral
06/08/14
INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA
LEIA COM MUITA ATENÇÃO
1.
Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos.
2.
Esta prova contém 10 questões dissertativas.
3.
Leia todas as questões com atenção.
4.
A prova deverá ser feita com caneta esferográfica de tinta azul ou preta.
5.
É vedada a utilização de qualquer material de consulta, eletrônico ou impresso.
6.
É terminantemente proibido retirar-se do local da prova antes de ocorrido o tempo mínimo estipulado,
qualquer que seja o motivo.
7.
Tempo de duração da avaliação - Mínimo: 50min
Máximo: 50min
8.
Ao final, entregue a prova ao professor aplicador.
BOA PROVA!
Assinatura do Aluno: _________________________________________________
QUESTÕES
1. Catalisador é toda substância que aumenta a taxa de desenvolvimento de determinadas
reações químicas sem, contudo, participar dos produtos da reação, sendo integralmente
recuperado no final, tanto em massa quanto na composição. Os catalisadores conseguem
aumentar a velocidade das reações porque:
a) (
) Com a presença do catalisador, a concentração aumenta, ou seja, aumenta o número
de partículas por unidade de volume e, consequentemente, o número de choques efetivos será
maior.
b) (
) Com o catalisador, há mais choques efetivos, aumentando a energia cinética das
partículas, aumentando a temperatura do sistema, que faz a reação se processar mais rápido.
c) (
) O catalisador aumenta o número de partículas por unidade de volume e,
consequentemente, a pressão aumenta, aumentando a taxa de desenvolvimento da reação.
d) (
) O catalisador participa da formação do complexo ativado, fazendo com que os
reagentes necessitem de uma energia de ativação menor para atingir esse estado,
aumentando, dessa forma, a taxa de desenvolvimento da reação.
e) (
) O catalisador tem afinidade com todos os reagentes, ligando-se a todos eles e
aumentando a velocidade com que eles se ligam.
1/5
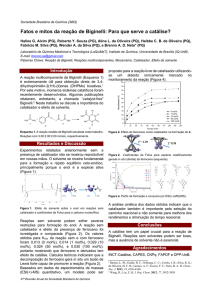
2. Observe o gráfico de uma reação efetuada com e sem catalisador:
Relacione as colunas abaixo:
I) A curva que corresponde à reação com catalisador.
(
) – 30 kcal/mol.
II) A curva que corresponde à reação sem catalisador.
(
) 70 kcal/mol.
III) Valor da energia do complexo ativado com catalisador.
(
) 30 kcam/mol
IV) Valor da energia do complexo ativado sem catalisador.
(
) 1.
V) Valor da energia de reação.
(
) 10 kcal/mol.
VI) Valor da energia de ativação da reação com catalisador.
(
) 2.
VII) Valor da energia de ativação da reação sem catalisador.
(
) 50 kcal.mol.
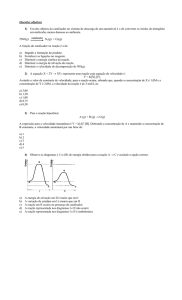
3. (Vunesp-SP) A hidrólise do brometo de metila pode ser representada pela equação abaixo e
pelo gráfico a seguir:
1 CH3Br(ℓ) + 2 H2O(ℓ) → 1 CH3OH(ℓ) + 1 H3O1+(aq) + 1 Br1-(aq)
Com relação a essa reação, assinale a alternativa que contém a afirmação incorreta.
a) (
) O íon I1-(aq) é catalisador da reação, que se processa com liberação de calor.
b) (
) E4 é a energia de ativação do catalisador, que é o I1-(aq).
c) (
) E3 é o abaixamento de energia de ativação devido ao catalisador.
d) (
) E5 é a variação de entalpia da reação, que é exotérmica.
e) (
) E1 é a energia de ativação sem catalisador e E2 é a energia de ativação com
catalisador.
2/5
4. Grande parte da energia que consumimos em nossos afazeres diários advém da queima de
materiais denominados combustíveis. Escolha dentre as alternativas, aquela que fornece os
combustíveis obtidos a partir da destilação do petróleo:
a) (
) Álcool etílico e gás GLP
b) (
) Gasolina e gás de cozinha
c) (
) Álcool etílico e gasolina
d) (
) Carvão e etanol
e) (
) Madeira e carvão
5. O trióxido de diarsênio é um sólido venenoso obtido pela reação do arsênio (As) com o gás
oxigênio. Sua entalpia padrão de formação é igual a
660 kJ.mol-1.
Escreva a equação química completa e balanceada da obtenção do trióxido de diarsênio. Em
seguida, calcule a quantidade de energia, em quilojoules, liberada na formação desse sólido a
partir da oxidação de 1,5 kg de arsênio.
6. Considere as entalpias de formação da água:
H2(g) + ½ O2(g) H2O(s) ∆H= -69,7 kcal/mol
H2(g) + ½ O2(g) H2O(l) ∆H= -68,3 kcal/mol
H2(g) + ½ O2(g) H2O(g) ∆H= -57,8 kcal/mol
a) Calcule, no quadro abaixo, a variação da entalpia envolvida na produção de 4 g de
hidrogênio a partir da água sólida.
b) Calcule, no quadro abaixo, a variação da entalpia envolvida na produção de 4 g de
hidrogênio a partir da água sólida.
c) Calcule, no quadro abaixo, a diferença de entalpia que existe entre 18 g de gelo e 36 g de
água líquida à mesma temperatura e pressão.
3/5
7. Dados os calores de reação nas condições padrões para as reações químicas abaixo:
Pode-se afirmar que a entalpia padrão do acetileno, em kcal/mol, é:
a) (
) – 310,6
b) (
) – 222,5
c) (
) – 54,3
d) (
) + 54,3
e) (
) + 222,5
8. Dados os processos:
a) C2H6(g)
2C(s) + 3H2(g)
DH = + 20,3 Kcal
b) C(g)
C(s)
DH = -171,7 Kcal
c) H2(g)
2H+(g)
DH = +104,2 Kcal
Calcule o valor de DH para o processo C2H6(g)
9. Dada a reação: H2O(1)
2C(g) + 6H+(g)
H2(g) + 1/2 O2(g)
DH = + 68,3 Kcal
Responda:
a) A reação é exotérmica ou endotérmica.
b) Represente esse processo num gráfico entalpia X caminho da reação.
4/5
10. A combustão completa do etanol: 1 C2H5OH + 3 O2 2 CO2 + 3 H2O + 1373 Kj.
(massa mola do álcool = 46 g/mol.), responda.
a) Qual é a quantidade de calor liberado ou absorvido na queima de 5 mol de etanol?
b) Se ocorresse a formação de mol de gás carbônico na reação, qual seria a quantidade de
calor liberado ou absorvido?
c) Calcule a quantidade de calor liberado ou absorvido na queima de 460 g de etanol?
5/5