Química 1 – 2ºs anos – Ensino Médio
Prof. Mauro Martins – El Maurón
Lista de Exercícios de Revisão
sobre Cinética Química
1) A decomposição do peróxido de
hidrogênio pode ser representada pela
equação:
H2O2(l) → H2O(l) + 1/2O2(g)
Das seguintes condições:
I. 35º C e presença de catalisador.
II. 35º C e ausência de luz.
III. 25º C e presença de luz.
IV. 25º C e presença de catalisador.
V. 25º C e ausência de luz.
Aquela que favorece a conservação do
peróxido de hidrogênio é:
m) I
a) II
u) III
r) IV
o) V
2) Você está cozinhando batatas e
fazendo carne grelhada, tudo em fogo
baixo, num fogão a gás. Se você
passar as duas bocas do fogão para
fogo alto, o que acontecerá com o
tempo de cozimento?
m) Diminuirá para a carne e
permanecerá o mesmo para as
batatas.
a) Diminuirá para a carne e aumentará
para as batatas.
u) Diminuirá para os dois alimentos.
r) Não será afetado.
o) Diminuirá para as batatas e não será
afetado para a carne.
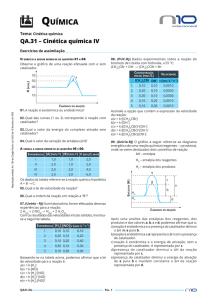
3) (PUC-SP) Sobre o gráfico abaixo, é
incorreto afirmar que:
m) Na reação direta ∆H=-bc.
a) A reação inversa é exotérmica.
u) A energia de ativação da reação
inversa é ca.
r) O complexo ativado está em a.
o) E e D são reagentes na reação
inversa.
4) (CEFET-MG) O diagrama abaixo
representa a variação de energia
ocorrida na combustão do álcool etílico,
de acordo com a equação:
De acordo com o gráfico, pode-se
afirmar corretamente que:
m) A energia de ativação da
combustão vale (a+b) kcal.
a) A energia liberada na combustão é
(b) kcal/mol de álcool.
u) O complexo ativado tem conteúdo
energético (a+b) kcal.
r) O ∆H da reação de combustão é (ba) kcal/mol.
o) O conteúdo energético dos
reagentes é menor que o conteúdo
energético dos produtos da combustão.
5) (UFMS/98) Com relação à cinética
de uma dada reação química e sendo
∆H = variação da entalpia, é correto
afirmar que:
01. As reações químicas serão mais
rápidas quanto maior for o número de
partículas reagentes com energia igual
ou superior à energia de ativação.
02. Um catalisador aumenta a
velocidade de uma reação química,
porque diminui o valor de ∆H.
04. Todas as colisões intermoleculares
resultam em reação química.
08. O aumento do número de colisões
intermoleculares,
devidamente
orientadas, favorece a reação química.
16. Um catalisador aumenta a
velocidade de uma reação química,
pois diminui o valor da energia de
ativação.
32. A pulverização de um reagente
sólido influi na velocidade de suas
reações.
Química 1 – 2ºs anos – Ensino Médio
Prof. Mauro Martins – El Maurón
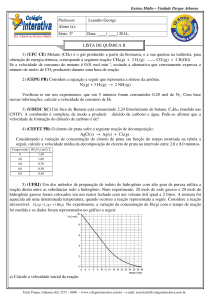
6) (UFMS/02-Exatas) Um estudante de
química observou a reação de
decomposição abaixo, a 25ºC.
H2CO3(aq) → H2O(l) + CO2(aq)
Medindo a concentração, em mol/L, de
CO2 , nos tempos 5 e 15 segundos, o
estudante obteve, respectivamente, [
CO2 ] = 0,1 mol/L e [ CO2 ] = 1,1 mol/L.
Determine a velocidade média dessa
reação no intervalo de 5 a 15
segundos. Para efeito de resposta,
multiplique o resultado por 20.
7) Ao se fazer pão caseiro, coloca-se a
massa,
em
geral,
coberta,
“descansando”
em
lugar
mais
aquecido, a fim de que “cresça”. Esse
fato pode ser interpretado da seguinte
forma:
m) Como uma prática caseira e que
não está relacionada a fenômeno
químico.
a) Que o leve aumento de temperatura
aumenta a velocidade de reação dos
componentes da massa.
u) Que o ambiente mais aquecido evita
que a massa estrague.
r) Que o leve aumento da temperatura
diminui a fermentação da massa.
o) Como um modo de evitar que a
mistura
se
torne
heterogênea
polifásica.
8) (FEPAR) Fazem-se as afirmações
abaixo.
I. Todas as colisões moleculares entre
quaisquer gases diferentes levam à
reação química.
II. A colisão molecular é efetiva se tiver
orientação adequada e se estiver
provida de um mínimo de energia.
III. A energia mínima de que as
moléculas necessitam para reagir por
colisão chama-se energia de ativação,
que pode ser baixada pelo uso de um
catalisador.
IV. Em processos que apresentam
duas ou mais etapas, a velocidade de
reação é determinada pela etapa mais
rápida, por requerer maior energia de
ativação.
V. Energia de ativação de uma reação
depende da natureza das substâncias
reagentes.
Assinale:
m) Se somente a II, a III e a V
estiverem corretas.
a) Se somente a I estiver correta.
u) Se somente a III e a IV estiverem
corretas.
r) Se somente a V estiver correta.
o) Se somente a II, a III, a IV e a V
estiverem corretas.
9) (UnB-DF- Adaptada) O biodigestor uma das soluções tecnológicas para o
tratamento do lixo - consiste em um
reservatório no qual são favorecidas as
condições para a decomposição de
matéria orgânica em seu interior por
meio da ação de bactérias aeróbicas. O
conhecimento a respeito de cinética
química permite entender aspectos
relativos aos processos que ocorrem
nesse sistema. Com relação a esse
assunto, julgue os itens que se
seguem.
01. De acordo com a teoria das
colisões, um aumento de temperatura
no interior de um biodigestor tende a
aumentar a velocidade das reações
químicas.
02. A moagem do material a ser
colocado no biodigestor provocará a
redução da velocidade das reações
químicas de decomposição, devido à
diminuição do tamanho dos fragmentos
a serem decompostos.
04. O trabalho de decomposição das
bactérias poderá ser acelerado por
meio do aumento da concentração de
oxigênio no interior do biodigestor.
08. Segundo a teoria cinética, nem
todas as colisões entre as moléculas
dos gases no interior do biodigestor
resultarão na formação de produtos.