Prof. Rodney
CINÉTICA QUÍMICA
Questão 01)Durante a manifestação das reações químicas, ocorrem variações de energia. A quantidade
de energia envolvida está associada às características químicas dos reagentes consumidos e dos
produtos que serão formados.
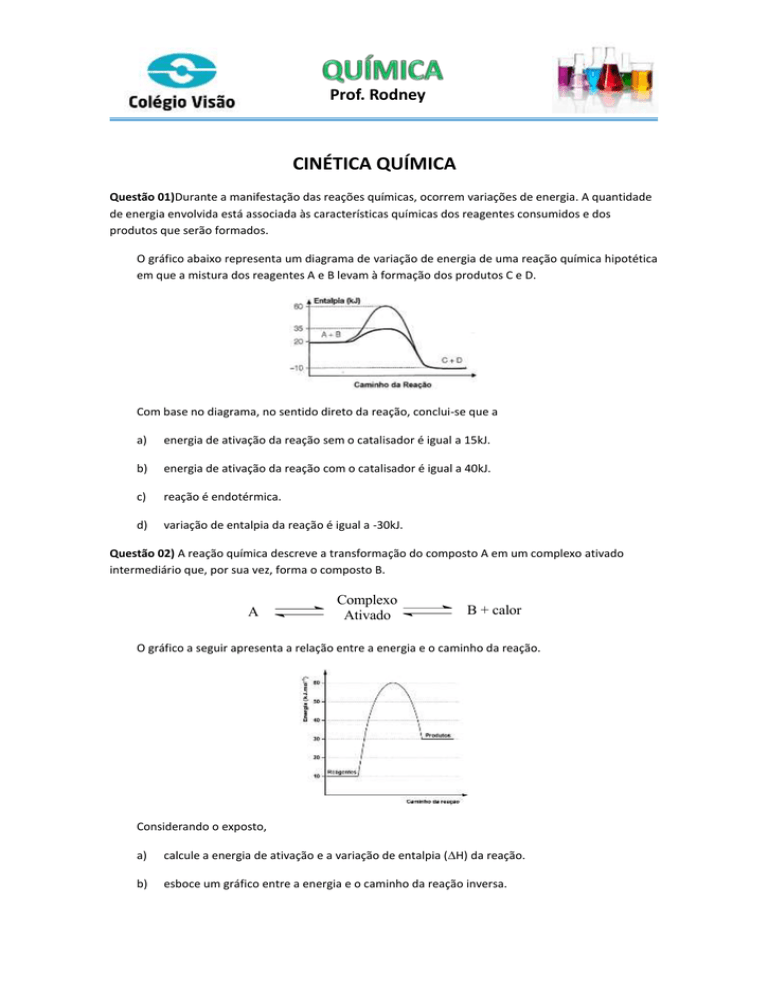
O gráfico abaixo representa um diagrama de variação de energia de uma reação química hipotética
em que a mistura dos reagentes A e B levam à formação dos produtos C e D.
Com base no diagrama, no sentido direto da reação, conclui-se que a
a)
energia de ativação da reação sem o catalisador é igual a 15kJ.
b)
energia de ativação da reação com o catalisador é igual a 40kJ.
c)
reação é endotérmica.
d)
variação de entalpia da reação é igual a -30kJ.
Questão 02) A reação química descreve a transformação do composto A em um complexo ativado
intermediário que, por sua vez, forma o composto B.
A
Complexo
Ativado
B + calor
O gráfico a seguir apresenta a relação entre a energia e o caminho da reação.
Considerando o exposto,
a)
calcule a energia de ativação e a variação de entalpia (H) da reação.
b)
esboce um gráfico entre a energia e o caminho da reação inversa.
Prof. Rodney
Questão 03) A investigação do mecanismo de reações tem contribuído na compreensão de muitos
processos químicos desenvolvidos em laboratório de pesquisa. A reação genérica A D é uma reação
não elementar e seu mecanismo está representado no gráfico a seguir:
Analise o gráfico e assinale a alternativa correta.
a)
b)
c)
d)
e)
A etapa C D é a determinante da velocidade da reação A D.
Na reação A D estão envolvidas quatro reações elementares.
No decorrer da reação ocorre a formação de seis substâncias intermediárias.
A expressão da velocidade da reação A D é v = k [A].
As substâncias B e C são catalisadores da reação A D.
Questão 04) No diagrama, as curvas I e II representam caminhos possíveis para a reação de
decomposição do ácido fórmico, na presença e na ausência de um catalisador.
Com base nesse diagrama, é correto afirmar que
a)
a curva I refere-se à reação catalisada e a curva II refere-se à reação não catalisada.
b) a curva II corresponde ao caminho da reação mais lenta.
c)
as energias dos complexos ativados formados nos dois caminhos da reação são as mesmas.
d) a curva I refere-se à reação exotérmica, pois a presença do catalisador diminuiu o valor de “H”.
e)
a curva II corresponde ao caminho da reação mais rápida, apesar da reação ocorrer em várias
etapas.
Prof. Rodney
Questão 05)
O gráfico acima representa a reação X Y Z . Os valores do H e da energia de ativação, em
kJ/mol, são, respectivamente,
a)
+ 50 e 20.
b) + 15 e 45.
c) + 30 e 20.
d)
+ 5 e 20.
e) + 25 e 55.
Questão 06) Um fogão de cozinha consome 134,4 L de metano por hora, medidos nas CNTP. Nas
mesmas condições, a velocidade de formação do dióxido de carbono, resultante da combustão
completa do metano, é:
a)
6,0 moléculas/h b) 6,02x1023 moléculas/h c) 8,4 mol/h
d) 22,4L/h
e)6,0 mol/h
Questão 07) Os resultados de três experimentos, feitos para encontrar a lei de velocidade para a reação
2 NO(g) + 2 H2(g) N2(g) + 2 H2O(g), encontram-se na Tabela 1 abaixo.
Tabela 1 – Velocidade inicial de consumo de NO(g)
Velocidade de
[NO] inicial [H 2 ] inicial
(mol L-1 )
(mol L-1 )
consumo inicial
de NO
1
4,0 x 10 -3
2,0 x 10 -3
(mol L-1 s -1 )
1,2 x 10 -5
2
8,0 x 10 -3
2,0 x 10 -3
4,8 x 10 -5
3
-3
-3
2,4 x 10 -5
Experiment o
4,0 x 10
4,0 x 10
De acordo com esses resultados, é correto concluir que a equação de velocidade é
a)v = k [NO] [H2]2 b)v = k [NO]2[H2]2
c)v = k [NO]2[H2]
d)v = k [NO]4[H2]2
e)v = k [NO]1/2[H2]
Questão 08) A tabela mostra a variação da velocidade inicial da reação hipotética representada pela
equação A2(g) + 2 B(g) C(g), em função das concentrações iniciais dos reagentes utilizados no
processo.
Experiment o
[A] inicial [B] inicial
Velocidade
inicial
Temperatura
(mol/L)
1,0
(mol/L)
1,0
(mol/L.min )
0,4
(K)
338
2
2,0
1,0
0,2
298
3
1,0
1,0
0,1
298
4
2,0
2,0
0,4
298
1
Interpretando-se a tabela, considere as afirmações I, II, III e IV abaixo.
Prof. Rodney
I.
O valor da constante de proporcionalidade k é igual para todos os experimentos.
II.
A lei cinética da velocidade pode ser expressa pela equação v = k[A][B].
III.
Trata-se de uma reação cuja ordem global é 2.
IV.
As ordens para os reagentes A e B são, respectivamente, zero e 2.
São verdadeiras, apenas as afirmações
a)
I e III.
b) I e IV.
c) II e III.
d) II e IV. e) III e IV.
Questão 09) Considere a equação para a reação de obtenção do dióxido de nitrogênio:
2NO(g) + O2(g) 2NO2(g)
A tabela a seguir apresenta dados obtidos experimentalmente para determinação da cinética de
reação do dióxido de nitrogênio à temperatura de 400ºC.
A ordem global da reação é:
a) 4
b) 3
c) 2
d) 1
e) 0
Questão 10) A amônia é matéria-prima para a fabricação de fertilizantes como a ureia (CON 2H4), o
sulfato de amônio [(NH4)2SO4)] e o fosfato de amônio [(NH4)3PO4]. A reação de formação da amônia se
processa em duas etapas, conforme equações químicas fornecidas abaixo.
N2 (g) + 2 H2 (g) N2H4 (g) (1) lenta
N2H4 (g) + H2 (g) 2 NH3 (g) (2) rápida
Dessa forma, a velocidade da equação global N2 (g) + 3 H2 (g) 2 NH3 (g) é dada pela seguinte
expressão:
a)v = k [N2] [H2]2
b)v = k [NH3]2
d)v = k [NH3]2/[N2] [H2]3
c) v = k [N2] [H2]3
e)v = k [N2H4]/[N2] [H2]2
Questão 11) A tabela abaixo apresenta os resultados obtidos para o estudo cinético de uma reação
D + E.
química elementar genérica na forma aA + bB + cC
Prof. Rodney
Experiment o
[A]
[B]
Velocidade
[C]
1
mol.L-1s-1
0,10 0,10 0,10 8,0.10 4
2
0,20 0,10 0,10
1,6.103
3
0,10 0,20 0,10
1,6.103
4
0,10 0,10 0,20
3,2.103
A partir destes resultados, determine:
a) a lei de velocidade da reação.
b) o valor da velocidade da reação quando [A] = [B] = [C] = 0,20 mol L -1
Questão 12) As espécies químicas A e B reagem a uma certa temperatura de acordo com a reação 2 A (g)
+ 2 B(g) C(g) . Verificou-se que a velocidade desta reação quadruplica quando a concentração de A
duplica, independente da concentração de B.
Assinale a alternativa que corresponde à expressão da velocidade e ao valor da ordem da reação,
respectivamente.
a)v = k [A]2 e 2
b)v = k [A]2 e 4
c) v = k [A]2 [B]2 e 2
d)v = k [A]2 [B]2 e 4 e)v = k [A]2 [B]2 e 1
Questão 13) Metano (CH4) é o gás produzido a partir da biomassa, e a sua queima na indústria, para
obtenção de energia térmica, corresponde à seguinte reação: CH4(g) + 2 O2(g)
CO2(g) + 2 H2O(l)
Se a velocidade de consumo do metano é 0,01 mol min –1, assinale a alternativa que corretamente
expressa o número de moles de CO2 produzido durante uma hora de reação.
a)
0,3
b)0,4
c) 0,5
d) 0,6
e)0,7
Questão 14) O esquema apresentado descreve os diagramas energéticos para uma mesma reação
química, realizada na ausência e na presença de um agente catalisador.
Com base no esquema, responda qual a curva que representa a reação na presença de catalisador.
Explique sua resposta e faça uma previsão sobre a variação da entalpia dessa reação na ausência e
na presença do catalisador.
1) D
2) a)HAtivação = +50 kJ/mol
HReação = +20 kJ/mol
Prof. Rodney
b)
3) A
11) a)
12) A
4) E
5) B
v = 8[A][B][C]2
6) E
b)
7) C
8) C
9) B
10) Gab: A
1,2810–2 mol L–1 s–1.
13) D
14) A curva II representa a reação na presença de catalisador, pois houve diminuição da energia de
ativação. A variação de entalpia é a mesma na presença e na ausência de um catalisador.












