SOLUBILIZAÇÃO DE FÁRMACOS EM COPOLÍMEROS
TRIBLOCOS DO TIPO EPE E ESE EM SOLUÇÃO AQUOSA
Maria E. N. P. Ribeiro1*, Flávia de M. L. L. Costa1, Samira A. de Oliveira1, João V. X. Moreira1, Nágila M. P. S.
Ricardo1**
1
Departamento de Química Orgânica e Inorgânica, Universidade Federal do Ceará, Caixa Postal 12.200, 60.455-760,
Fortaleza, CE, Brasil.*elenirnp@ yahoo.com.br, ** [email protected]
Drug solubilisation in triblock copolymer type EPE and ESE in aqueous solution
The aim of this work was to investigate mixed systems of triblock copolymer type E62P39E62 (commercially denoted
F87) and E137S18E137 (prepared by oxyanionic polymerization) as novel vehicles for solubilisation and controlled
delivery of aromatics drugs. The desirable gelation characteristics of solutions of the EmPnEm copolymers with the
greater solubilising capacities of solutions of the EmSnEm were investigated by oscillatory rheometry. The solubilisation
capacity (scp) for the separate copolymers and for the mixtures of the two in the range 50/50 to 10/90%
E62P39E62/E137S18E137 was evaluated by UV/Vis. The fluid/gel boundaries for the copolymers alone and its mixtures
were determined by rheometry. The scp measured for the separate copolymers and its mixtures revealed promise results
for application of binary mixtures of copolymer as systems for drug release involving in situ gelation.
Introdução
O interesse em sistemas de liberação de fármacos deve-se, dentre outros, ao fato de alguns
fármacos apresentarem baixa disponibilidade ou a substância ativa ter um efeito colateral de
irritação local, além de ser pouco solúvel em água.1 Os surfactantes não-iônicos têm despertado
interesse na indústria e academia por apresentarem baixa toxicidade e assim serem potencialmente
utilizáveis na solubilização de fármacos.2
Os copoli(oxialquileno)s em bloco, em específico, têm sido bastante explorados quanto a
capacidade de solubilização de fármacos (scp) pouco solúveis em água como a griseofulvina4
(Crothers e col., 2005) dado a formação de micelas. As propriedades físico-químicas dos
copoli(oxialquileno)s comercialmente disponíveis, preparados por óxido de etileno e óxido de
propileno (os copolímeros Pluronic ou Synperonic), têm sido muito estudados.5,6 Estes copolímeros
são denominados EmPnEm, onde E representa o óxido de etileno (OCH2CH2), P, óxido de propileno
[–OCH2CH(CH3)2], e os subscritos m e n denotam o comprimento do bloco.
A auto-associação de copolímeros em bloco de poli(oxialquileno)s contendo blocos
hidrofóbicos alternados são investigados, particularmente, pelo grupo da Universidade de
Manchester.3,7-10 Por exemplo, copolímeros diblocos e triblocos foram preparados com blocos de E
combinados com blocos B [B = oxibutileno, OCH2(C2H5)], ou blocos S [S = oxifeniletileno,
preparado a partir do óxido de estireno, OCH2CH(C6H5)].3,9
Tabela 1 – Estrutura, fórmula, peso molecular e solubilidade em água a 25 e 37 ºC da griseofulvina, rutina e quercetina.
Fármaco
Estrutura, fórmula, peso molecular
Griseofulvina
H C
3
CH
O
O
O
3
Solubilidade
em água em
água a 25 ºC
10 mg/
100 mL
Solubilidade
em água em
água a 37 ºC
12 mg/
100 mL
1,9 mg/
100 mL
5,7 mg/
100 mL
0,4 mg/
100 mL
0,7 mg/
100 mL
H
H
O
O
H CO
3
Cl
H
H
CH 3 H
C17H17ClO6
352,77
Rutina
C27H30O16
610,52
Quercetina
C15H10O7
302,24
A griseofulvina (Tabela 1) é um fármaco antifúngico, aplicado no tratamento de dermatofitose
dado sua eficácia15, pouco solúvel em água e bastante utilizado como padrão para avaliação da
capacidade de solubilização (scp) de muitos copolímeros em bloco.4,16
Os flavonóides rutina e quercetina (Tabela 1) pertencem à classe dos flavonóis e são
conhecidos por suas atividades antioxidantes e suas habilidades de prevenir doenças cardíacas.17
Anais do 9o Congresso Brasileiro de Polímeros
2
No presente trabalho, resultados de scp dos copolímeros e suas misturas são apresentados a 25
e 37 ºC para os fármacos griseofulvina, rutina e quercetina. O estudo reológico dos géis da mistura
50/50 %m/m de E137S18E137/F87 foi também explorado.
Experimental
Materiais
O copolímero E137S18E137 foi preparado no Laboratório de Polímeros da Universidade de
Manchester. O copolímero E62P39E62 (comercialmente chamado de F87) foi obtido da ICI
Surfactants atualmente chamada Uniquema. Água milli-Q, metanol (SYNTH) foram usados como
solventes. O fármaco griseofulvina foi obtido da Aldrich. Os fármacos rutina e quercetina foram
gentilmente cedidos pela empresa Flora Brasil – Produtos Naturais LTDA.
Misturas Binárias dos Copolímeros
As misturas dos copolímeros S18 e F87 foram preparadas em tubos de diâmetro interno de
10 mm com proporção crescente do S18 (50 a 90 %m/m) em concentrações variando de
1 a 50 %m/m e massa total de 0,5g.
Estudo Reológico
A temperatura e a freqüência dependentes do módulo foram determinadas para as soluções
preparadas da mistura 1 (S18/F87 50/50 %m/m), através de medidas em um Reômetro de Tensão
Controlada (Controlled Stress Rheometer) Bohlin CS50 com banho de temperatura controlável.
Geometria Couette (copo cilíndrico com 24,5 mm de diâmetro, 29 mm de altura). 2,5 cm3 de
amostra foram adicionados ao recipiente no estado fluido. O solvente foi mantido usando atmosfera
saturada de solvente ao redor da cela e o que evaporou não foi significativo nas escalas de
temperatura e tempo utilizadas. As amostras foram vertidas na cela Couette e equilibradas
aproximadamente por 20 minutos antes de começar o experimento. A amplitude da tensão ajustada
para baixos valores (A = 0,5 %) usando um facilitador de tensão controlada do software Bohlin para
que fosse garantido o estudo na região de viscoelasticidade linear. Resultados das soluções de baixo
módulo, os quais saíam da faixa de operação satisfatória de tensão controlada foram rejeitados.
Solubilização
No espectro de UV, as moléculas dos fármacos normalmente têm absorbância forte num
determinado comprimento de onda. A intensidade da absorbância num pico específico pode ser
usada para determinar a quantidade de fármaco solubilizada. Os comprimentos de onda para os
Anais do 9o Congresso Brasileiro de Polímeros
3
picos específicos de absorção da griseofulvina, rutina e quercetina em metanol foram em 292 nm,
359 nm e 375 nm, respectivamente.
O gráfico de calibração foi preparado a partir dos dados de concentração (mg/L) versus
absorbância (A). Equipamento U-2000 Spectrophotometer da Hitachi foi utilizado no experimento.
Para quantificação da porção solúvel foi construída uma curva de calibração para os fármacos
griseofulvina, rutina e quercetina em metanol com concentrações variando de 2,0 a 20,0 mg/dm3
obedecendo a Lei de Beer. As equações obtidas foram: A = 0,0681c (griseofulvina), A = 0,0260c
(rutina) e A = 0,0683c (quercetina). Foram preparadas soluções aquosas estoques a 1% dos
copolímeros e das misturas. A uma porção da solução estoque (10 mL) foram adicionadas 5,0 mg
dos fármacos a serem testadas: griseofulvina, rutina e quercetina em frascos separados. As misturas
foram agitadas a 25 e 37 oC, separadamente, de 3 a 5 dias num banho QUIMIS, sendo
posteriormente filtradas em membrana Millipore de porosidade 0,45 µm, para remoção de fármaco
não solubilizado. Alíquotas (0,5 mL) das amostras filtradas foram diluídas com metanol (3,5–4,5
mL) e a leitura no comprimento de onda para cada fármaco em cada uma das soluções foi realizada
contra metanol puro. Quantificação da solubilidade dos fármacos em água e leituras nos mesmos
comprimentos de onda para os copolímeros e misturas para correção dos valores obtidos também
foram realizadas. Todas as medidas foram feitas em triplicata ou mais. A absorbância do fármaco
em água e a absorção dos copolímeros foram descontadas da absorbância total dos copolímeros
contendo o fármaco.
Resultados e Discussão
Estudo Reológico
O efeito da temperatura no logaritmo do módulo de armazenamento ou elástico (G’) medido a
freqüência (ƒ) de 1Hz para a mistura 1 (E137S18E137/F87 50/50 %m/m) nas concentrações de 20, 30
e 40 % m/m encontram-se na Figura 1.
A dependência do módulo G’ com a temperatura serve para definir e confirmar o baixo limite
de gel obtido pelo diagrama de fase.18 O restrito aumento da temperatura com significativo aumento
do módulo de armazenamento (G’) corresponde ao limite fluido-gel definido por inversão de tubo.19
A temperatura na qual G’ aumenta bruscamente para altos valores sendo superiores aos valores de
G” (módulo de perda ou viscoso) caracteriza o início da região de gel para esse sistema em estudo e
para outros sistemas de copolímeros similares.11,20 Os valores de temperatura na qual essa mudança
ocorre para mistura 1 (E137S18E137/F87 50/50 %m/m) nas concentrações 20, 30 e 40% m/m foram
obtidos através do aumento significativo do módulo (Figura 1). Observou-se a diminuição da
temperatura de formação de gel com o aumento da concentração como relatado para outros sistemas
Anais do 9o Congresso Brasileiro de Polímeros
4
triblocos do tipo ESE.7 Tal fato deve-se a um maior empacotamento das micelas com o aumento da
concentração.
Através da Figura 1 é possível observar com clareza a variação nos valores de G’e G’’ e assim
melhor caracterizar o material. “Em geral, uma solução apresenta valores de G” > G’, sendo
G’ < 1Pa. Gel fluido é obtido quando G’ > G”, com valores de G’ de 10-600 Pa e gel rígido é obtido
quando a condição de G’ > G” onde G’ > 3Kpa.
O valor de G’ para a concentração de 20% da mistura 1 (E137S18E137/F87 50/50 %m/m) foi de
aproximadamente 270 Pa característico de um gel fluido. Essa concentração apresentou-se fluida no
teste de inversão de tubo,13,18 mas com módulo de armazenamento (medido a 1 Hz)
significativamente acima do nível característico de solução (isto é G’ > 10 Pa) com G’ > G”
implicando numa classificação de gel fluido já relatado para copolímeros triblocos do tipo ESE
(E66S13E66 e E142S19E142). 7,9,21
Os géis fluidos a concentrações e temperaturas próximas ao limite de gel rígido são
designados para versões defeituosas de géis rígidos de empacotamento cúbico, isto é, domínio de
estrutura pequena numa matriz totalmente fluida.11 Podem ser resultados de uma menor atração
entre as micelas esféricas e o solvente (pois se tornou levemente solúvel).22,23 A transição ocorre
quando os agregados das micelas esféricas se estendem numa estrutura que causa o efeito reológico
característico (G’ > G”).
O valor de G’ para as concentrações de 30 e 40% m/m da mistura 1 (E137S18E137/F87 50/50
%m/m) são aproximadamente 3 KPa e 19 KPa, respectivamente. Tais valores de G’ são
característicos de géis rígidos que apresentam micelas esféricas empacotadas em forma cúbica,
quando G’ > 1 KPa, como relatado para copolímeros diblocos7-9,22 e copolímeros triblocos ESE.7,8
Entretanto, géis de concentração e temperatura bem dentro da região de gel apresentam valores
mais altos sob essas mesmas condições (ƒ = 1Hz e A = 0,5%). Por exemplo, para solução da
mistura 1 (E137S18E137/F87 50/50% m/m) a 40 % a 40 ºC, G’= 17 KPa, valor esse muito menor do
que o encontrado para soluções de F87, em geral, G’= 25 KPa para uma solução a 30 % a 40 ºC,11
mas todos são consistentes com géis rígidos de alta tensão crítica.
Anais do 9o Congresso Brasileiro de Polímeros
5
3
G'
gel fluido
2
solução
log
10
G/Pa
log10 G/ KPa
G"
1
0
-1
-2
solução
(a)
-3
0
20
40
60
o
T/ C
80
10 0
4
G'
gel rígido
3
G"
log10 G/ KPa
log 10 G/Pa
2
gel fluido
1
solução
0
-1
(b)
-2
0
20
40
o
T/ C
60
80
100
5
G'
gel rígido
4
G"
gel fluido
2
10
log G/Pa
log10 G/ KPa
3
1
solução
0
-1
(c)
-2
0
20
40
o
T/ C
60
80
100
Figura 1 – Dependência da temperatura do logaritmo dos módulos G’ e G” das soluções aquosas da mistura 1 (S18/F87 50/50 %m/m) nas
concentrações: (a) 20, (b) 30 e (c) 40 (%m/m).
Solubilização
A griseofulvina é um fármaco antifúngico utilizado como padrão para estudo da capacidade de
solubilização dos copolímeros. A rutina e quercetina são fármacos que apresentam benefícios para
saúde humana como vaso-dilatador, gastroprotetor entre outros. Os resultados mostram que o
Anais do 9o Congresso Brasileiro de Polímeros
6
copolímero E137S18E137 e suas misturas podem ser utilizados como meio para aplicações
farmacêuticas (Tabela 4), pois apresentaram valores de capacidade de solubilização (scp) para os
flavonóides mais elevados que para o fármaco griseofulvina. Tal fato deve-se a maior
hidrofobicidade desses flavonóides quando comparados com a griseofulvina. Ao compararmos os
valores de solubilidade em mg/100 mL para esses fármacos em água a 25 e 37 ºC (Tabela 2)
confirma-se a hidrofobicidade. Os flavonóides são menos solúveis em água que a griseofulvina,
justificando os maiores valores de scp nas soluções dos copolímeros e misturas.
Tabela 2 – Solubilização das fármacos: griseofulvina, rutina e quercetina (mg/100 mL) em água a 25 e 37 ºC.
Fármaco
Temperatura (ºC)
Referência
25
37
Griseofulvina
10,0
12,0
4
Rutina
1,9
5,7
Este trabalho
Quercetina
0,4
0,7
Este trabalho
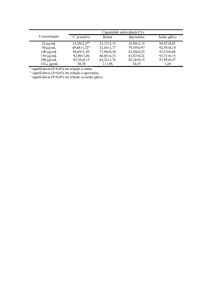
A capacidade de solubilização (scp, expressa em mg g -1) para o E137S18E137 e as misturas
apresentaram aumento significativo com a temperatura, devido as micelas apresentarem-se na forma
esférica (Tabela 4). Comportamento similar a este foi verificado para copolímeros diblocos e
triblocos.11
O tamanho do núcleo hidrofóbico no copolímero influencia a capacidade de solubilização
(scp). Ao compararmos diferentes tamanhos de um mesmo núcleo hidrofóbico, verifica-se um
aumento na scp com o aumento do núcleo (Tabela 3). Mas o valor da capacidade de solubilização
não aumenta significativamente quando os blocos terminais E (óxido de etileno) são muito longos
como no caso do E137S18E137 em relação aos copolímeros E82S8E82, E66S13E66 e E67S15E67 (Tabela 3).
Tabela 3 – Capacidade de solubilização, scp (mg g-1), de diferentes copolímeros para fármaco griseofulvina a 25 ºC.
Copolímero
scp (mg g-1)
Referência
E82S8E82
2,7
16
E66S13E66
4,0
16
E67S15E67
5,6
16
E137S18E137
4,9
Este trabalho
Anais do 9o Congresso Brasileiro de Polímeros
7
O núcleo S [S denominado do oxifeniletileno, OCH2CH(C6H5)] sendo mais hidrofóbico que
o núcleo P [P representa oxipropileno, OCH2CH(CH3)], solubiliza mais que esse último. Assim, o
aumento da proporção de E137S18E137 nas misturas favorece um aumento na quantidade de fármaco
solubilizado, numa mesma temperatura. Os fármacos rutina e quercetina também apresentam
valores de scp que aumentam com a proporção de S18 na mistura numa mesma temperatura
(Tabela 4).
Tabela 4 – Capacidade de solubilização, scp (mg g-1 ) e sh (mg g-1), dos copolímeros e misturas.
Copolímero
Ga
Temperatura (ºC)
Rb
Qc
scp
sh
scp
sh
scp
sh
E62P39E62
25
0,5
1,7
2,4
8,3
1,2
4,1
(F87)
37
0,8
2,7
3,7
12,9
2,8
9,6
E137S18E137
25
4,9
32,7
7,3
48,7
8,2
54,7
(S18)
37
5,6
37,3
*
*
*
*
Mistura 1
25
2,1
9,5
4,5
21,4
3,3
15
37
3,0
13,6
4,7
21,3
4,8
21,8
25
3,5
17
4,8
23,3
4,4
21,3
37
4,9
23,8
6,8
33,0
5,4
26,2
25
4,0
20,8
5,0
26,0
5,8
30,2
37
5,8
30,2
7,0
36,4
6,7
34,9
25
4,6
25,8
5,1
28,6
5,9
33,1
37
6,1
34,3
7,1
39,9
7,5
42,1
25
5,0
30,5
5,1
31,1
6,2
37,8
37
6,7
40,8
7,5
45,7
8,0
48,8
Mistura 2
Mistura 3
Mistura 4
Mistura 5
a – griseofulvina; b – rutina; c – quercetina. * medidas não obtidas.
Anais do 9o Congresso Brasileiro de Polímeros
8
Conclusões
A característica de formação de gel a frio do copolímero E62P39E62 (F87) e a alta capacidade
de solubilização do copolímero E137S18E137 (S18) tornou promissora a mistura em proporções de
50/50 a 90/10 (com proporção crescente de S18) para sistemas de liberação.
A reologia confirmou os estados de gel obtidos pelo teste de inversão de tubo de estudos já
publicados.18 Os resultados também direcionam para uma estrutura cúbica de corpo centrado, a qual
foi detectada por SAXS e PLM.24
A solubilidade dos fármacos griseofulvina, rutina e quercetina aumenta com a temperatura, o
que concorda com outros sistemas citados na literatura.4 (Crothers e col., 2005). Tal fato também é
utilizado para sugerir presença de micelas esféricas. A capacidade de solubilização (scp) sofreu
aumento proporcional ao aumento da proporção de S18 para os fármacos griseofulvina, rutina e
quercetina, concordando com o fato de o S18 possuir núcleo mais hidrofóbico que F87.
O copolímero S18 e, principalmente, suas misturas podem ser utilizadas como solubilizadores
e sistemas encapsulantes para liberação controlada dos fármacos griseofulvina, rutina, quercetina
entre outros.
Agradecimentos
CAPES e CNPq pelas bolsas concedidas
Referências Bibliográficas
1. R. B. Oliveira; E. M. Lima Rev. Elet. de Farmácia, 2006, 3(2), 29.
2. A. T. Florence; D. Attwood in Principios Físicos-Químicos em Farmácia, Zuleika Rothschild,
Ed. da Universidade de São Paulo, São Paulo, 2003, 3ª ed., p. 331, 332 e 428.
3. C. Booth; D. Attwood Macromol. Rap. Comm., 2000, 21, 501.
4. M. Crothers; Z.-Y. Zhou; N. M. P. S. Ricardo; Z. Yang; P. Taboada; C. Chaibundit; D.
Attwood; C. Booth Int. J. Pharm., 2005, 293, 91.
5. M. Scherlund; A. Brodin; M. Malsten Int. J. of Pharm., 2000, 211, 37.
6. J. Dong; B. Z. Chowdhry; S. A. Leharne Col. and Surf. A: Physicochem. Eng. Aspects, 2006,
277, 249.
7. Z. Yang; M. Crothers; N. M. P. S. Ricardo; C. Chaibundit; P. Taboada; V. Mosquera; A.
Kelarakis; V. Havredaki; L. Martini; C. Valder; J. H. Collett; D. Attwood; F. Heatley; C. Booth
Langmuir, 2003a, 19, 943.
8. Z. Yang; M. Crothers; D. Attwood; J. H. Collett; N. M. P. S. Ricardo; L. G. A. Martini; C. Booth
J. Col.Interf.Scie., 2003b, 263, 312.
9. I. W. Hamley; S.-M. Mai; A. J. Ryan; J. P. A. Fairclough; C. Booth Phys. Chem. Chem. Phys.,
2001, 3, 2972.
10. N. M. P. S. Ricardo; C. Chaibundit; Z. Yang; D. Attwood; C. Booth Langmuir, 2006, 22, 1301.
11. W. J. Harrison; G. J. Aboulgasem; F. A. I. Elathrem; S. K. Nixon; D. Attwood; C. Price; C.
Booth Langmuir, 2005, 21, 6170.
12. T. Liu; V.M. Nace; B. Chu; Langmuir, 1999, 15, 3109.
13. M. E. N. Pinho; F. de M. L. L. Costa; N. M. P. S. Ricardo; S. G. Yates; D. Attwood; C. Booth
Int. J. of Pharm., 2007, 328, 95.
14. T. O. Kyung; T. K. Bronich; A. V. Kabanov J. of Contr. Rel., 2004, 94, 411.
15. R. Arenas; J. Ruiz-Esmenjaud An. Bras. Dermatol., 2004, 79(2), 225.
Anais do 9o Congresso Brasileiro de Polímeros
9
16. P. Taboada; G. Velasquez; S. Barbosa; V. Castelletto; S. K. Nixon; Z. Yang; F. Heatley; I. W.
Hamley; V. Mosquera; M. Ashford; D. Attwood; C. Booth Langmuir, 2005, 21, 5263.
17. M. H. Gordon; A. Roeding-Penman Chem. Phys. Lipids, 1998, 97, 79.
18. N. M. P. S. Ricardo; M. E. N. Pinho; Z. Yang; D. Attwood; C. Booth Int. J. of Pharm., 2005,
300, 22.
19. C. Chaibundit; P. Sumanatrakool; S. Chinchew; P. Kanatharana; C. E. Tattershall; C. Booth; X.F. Yuan J. of Coll. and Interf. Scie., 2005, 283, 544.
20. A. Kelarakis; V. Havredaki; C. J. Rekatas; S.-M. Mai; D. Attwood; C. Booth; A. J. Ryan; I. W.
Hamley; L. G. A. Martini Macromol. Chem. Phys., 2001, 202, 1345.
21. S. Hvidt; E. B. Jφrgenesen; W. Brown; K. Schillen J. Phys. Chem., 1994, 98, 12320.
22. H. Li; G.-E. Yu; C. Price; C. Booth; E. Hecht; H. Hoffmann Macromolecules, 1997, 30, 1347.
23. H. Li; G.-E. Yu; C. Price; C. Booth; J. P. A. Fairclough; A. J. Ryan; K. Mortensen Langmuir,
2003, 19, 1075.
24. I. W. Hamley; V. Castelletto; N. M. P. S. Ricardo; M. E. N. Pinho; C. Booth; D. Attwood; Z.
Yang Polym. Int., 2007, 56(1), 88.
Anais do 9o Congresso Brasileiro de Polímeros
10