COPOLÍMEROS TRIBLOCOS DO TIPO P123 E F127 E SUAS
MISTURAS: SOLUBILIZAÇÃO DA GRISEOFULVINA E
MANGIFERINA
Draúlio S. da Silva1*, Maria E. N. P. Ribeiro1, Rafael B. M. Nogueira1, Samira A. de Oliverira1, Maria T. S.
Trevisan1, Nágila M. P. S. Ricardo1**
1
Departamento de Química Orgânica e Inorgânica, Universidade Federal do Ceará, Caixa Postal 12.200, 60.455-760,
Fortaleza, CE, Brasil.*draulio4000@ yahoo.com.br, ** [email protected]
Triblock copolymers type P123 and F127 and its mixtures: solubilisation of griseofulvin and mangiferin
In this paper we report a study by tube inversion and the solubilisation of griseofulvin and mangiferin of mixtures of
E21P67E21 (P123) and E98P67E98 (F127) in dilute aqueous solutions. The evidence outlined above indicates that
these two copolymers, which have identical hydrophobic blocks, will comicellize. Additionally, in order to get a better
understanding of the self assembly of the mixed copolymers at high concentrations, we have studied the effect of
mixing on the gelation of more concentrated solutions, including definition of phase boundaries. The high-temperature
boundary of the 30 wt% cubic gel decreased monotonically from 90 to 43 °C as the proportion of P123 in the mixture
was increased from 0 to 100 wt%, whereas the low-temperature boundary was essentially constant at 15±3 °C.
Increasing the proportion of P123 in the mixture at 25 °C increased the concentration at which the cubic gel was first
formed, and decreased the concentration at which the hexagonal gel was first formed.
Introdução
Micelas poliméricas possuem uma promissora característica para a liberação de um grande
número de compostos terapêuticos. O estudo de liberação de fármacos utilizando micelas é baseado
nas suas características de auto-associação, originando um núcleo nanoestruturado em meio aquoso
para os copolímeros em bloco de poli(oxialquileno)s.1
Estudos físico-químicos de misturas binárias de copolímeros com diferentes hidrofobicidades
são relatados há algum tempo.2-4 No entanto, a potencialidade dessas misturas, quanto à
solubilização de fármacos pouco solúveis em água, só foi investigada na última década.5
H C
3
CH3
O
O
O
H
H
O
O
H CO
3
H
H
Cl
CH H
3
(a)
(b)
Figura 1. Estrutura química: (a) griseofulvina e (b) mangiferina.
Neste trabalho misturas binárias de copolímeros em bloco foram estudadas no intuito de
avaliar a solubilidade da griseofulvina e da maginferina. A griseofulvina (Figura 1a) é um fármaco
antifúngico, pouco solúvel em água, aplicado no tratamento de dermatofitose, dado sua eficácia6, e
é bastante utilizado como padrão para avaliação da capacidade de solubilização (scp) de muitos
copolímeros em bloco.7,8 A mangiferina (Figura 1b) é um derivativo da xantona9, distribuído em
plantas superiores das famílias Anacardiaceae e de Gentianaceae. A mangiferina apresenta diversas
atividades farmacológicas incluindo propriedades antidiabéticas, anti-HIV, anticancerígeno,
imunomodulatório, antiinflamatório, e sua propriedade antioxidante, amplamente estudada.10-12
Experimental
Materiais
Os copolímeros P123(E21P67E21) e F127(E98P67E98) foram obtidos da IC Surfactants. A
Tabela 1 apresenta as características moleculares dos copolímeros triblocos utilizados.
Tabela 1. Características molecular dos copolímeros
Copolímero
P123
F127
Mn/g mol-1
5820
%E
30
Mw/Mn
1,10
MW
6400
12600
70
1,20
15000
Água milli-Q e metanol (SYNTH) foram usados como solventes. O fármaco griseofulvina foi
obtido da Aldrich.
Misturas Binárias dos Copolímeros
As misturas dos copolímeros P123 e F127 foram preparadas em tubos cujo diâmetro interno é
de 10 mm com proporção crescente de P123 (25 a 75 %m/m), em concentrações variando de 1 a 50
%m/m e massa total de 0,5g.
Diagrama de Fase
O diagrama de fase foi estudado pelo método de inversão de tubo. As soluções dos
copolímeros e das misturas foram preparadas em tubos apropriados, misturando sempre que
possível e deixando por vários dias em repouso sob refrigeração até atingir o equilíbrio.
As misturas, em diferentes concentrações (1 a 75 %m/m) e massa total de 0,5g, foram
colocadas nos vidros, observando-se as modificações, sob lento aquecimento, num banho de água
termostatizado (1-90 °C), com velocidade de aquecimento de 1º min-1.
A reprodutibilidade foi de + 2 ºC para as temperaturas de transição fluido/gel e + 4 ºC para
as temperaturas de transição gel/fluido.
Anais do 9o Congresso Brasileiro de Polímeros
2
Solubilização
No espectro de UV, as moléculas dos fármacos normalmente têm absorbância forte num
determinado comprimento de onda. A intensidade da absorbância num pico específico pode ser
usada para determinar a quantidade de fármaco solubilizada. O comprimento de onda para o pico
específico de absorção da griseofulvina em metanol foi 292 nm e da mangiferina 276 nm.
O gráfico de calibração foi obtido a partir dos dados de concentração (mg/L) versus
absorbância (A). Equipamento U-2000 Spectrophotometer da Hitachi foi utilizado no experimento.
Para quantificação da porção solúvel foi construída uma curva de calibração para os fármacos
griseofulvina e mangiferina, em metanol, com concentrações variando de 2,0 a 20,0 mg/dm3,
obedecendo a Lei de Beer. As equações obtidas foram: A = 0,0681c (griseofulvina) e A =
0,012503c (mangiferina). Foram preparadas soluções aquosas estoques a 1% dos copolímeros e das
misturas. A uma porção da solução estoque (10 mL) foram adicionado 5,0 mg dos fármacos a
serem testados em frascos separados. As misturas foram agitadas a 25 e 37 oC, separadamente, de 3
a 5 dias num banho QUIMIS, sendo posteriormente filtradas em membrana Millipore de porosidade
0,45 µm, para remoção de algum fármaco não solubilizado. Alíquotas (0,5 mL) das amostras
filtradas foram diluídas com metanol (3,5–4,5 mL) e a leitura no comprimento de onda para cada
fármaco, em cada uma das soluções, foi realizada em metanol puro. Quantificação da solubilidade
dos fármacos em água, leituras nos mesmos comprimentos de onda para os copolímeros e misturas
para correção dos valores obtidos também foram realizadas. Todas as medidas foram feitas em
triplicata ou mais. As absorbâncias dos fármacos em água e a absorção dos copolímeros foram
descontadas da absorbância total dos copolímeros contendo os fármacos.
Resultados e Discussão
Diagrama de Fase
Os resultados obtidos por inversão de tubo para os copolímeros triblocos P123 e F127 nas
proporções PF75/25, PF50/50 e PF25/75 são mostrados na Figura 2. Observa-se que na faixa de
concentração de 1-28 %m/m que o aumento de P123 diminui o limite da temperatura em que o
sistema encontra-se turvo. A formação de géis foi reconhecida pela imobilidade da solução quando
o tubo era invertido (gel duro). O diagrama de fase no intervalo de 15-26 %m/m e na faixa de
temperatura de estudo (1-90 oC), mostra que com o aumento de F127 o limite da fase gel move-se
para concentrações mais baixas e temperaturas mais altas, consistente com o fato do F127 possuir
maior grupo hidrofílico. Apesar da grande semelhança entre os copolímeros, pois ambos são do tipo
EPE e têm o mesmo tamanho da cadeia hidrofóbica (oxi-propileno), a diferença entre eles está na
cadeia hidrofílica (oxi-etileno), onde no F127 é quase cinco vezes maior, proporcionando-lhe maior
Anais do 9o Congresso Brasileiro de Polímeros
3
afinidade com a água. Por isso, as propriedades das micelas em soluções aquosas diluídas diferem
das micelas empacotadas dentro da fase do gel duro, no qual não é visível a mobilidade.
80
T / oC
60
40
20
00
10
20
30
c / wt%
Figura 2. Efeito da mistura dos copolímeros P123 e F127 para as soluções aquosas de:
PF25/75 e
40
50
() F127 sozinho, () PF75/25, () PF50/50, ()
() P123 sozinho.
A Tabela 2 mostra a temperatura e a concentração mínima em que cada mistura de
copolímeros torna-se um gel rígido. Os resultados obtidos do diagrama de fase das misturas
realizadas pelo procedimento de inversão de tubo.
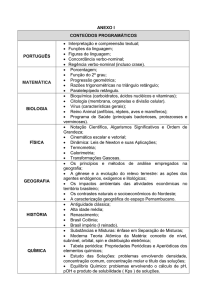
Tabela 2. Temperatura e concentração limite para a formação de gel duro.
Copolímero (%m/m)
T* (°C)
c* (%m/m)
P123
28,0
26,0
PF75/25
33,0
23,3
PF70/30
40,0
22,5
PF50/50
40,0
21,7
PF30/70
42,5
16,5
PF25/75
43,0
16,1
F127
45,0
15,0
Foi verificado em toda faixa de concentração estudada, que o limite de formação de gel das
misturas tem o comportamento esperado, ou seja, as mudanças ocorridas na formação do gel são
proporcionais à quantidade do copolímero tribloco. O limite para formação de géis rígidos para os
copolímeros estudados estão de acordo com trabalho realizado anteriormente em concentrações
similares.13 As misturas PF70/30, PF50/50 e PF30/70 e os copolímeros triblocos sozinhos foram
Anais do 9o Congresso Brasileiro de Polímeros
4
estudadas anteriormente.13 O resultado da proporção 50/50 mostrou-se semelhante ao relatado.13 As
demais proporções (PF75/25 e PF25/75) mostraram uma boa tendência na faixa de temperatura e
concentração da formação do gel das misturas PF70/30 e PF30/70.13
Solubilização
A capacidade de solubilização (scp) para o P123, F127 e suas misturas apresentaram aumento
significativo com o aumento da temperatura (Figura 3) para griseofulvina, característico de
presença de micelas esféricas.8 O mesmo foi observado para a mistura binária do E137S18E137/F87.14
Em geral, interações hidrofóbicas ou eletrostáticas são as forças determinantes de separação entre o
núcleo e o meio aquoso circundante na formação das micelas.15
A porção P [P representa o oxipropileno, OCH2(C2H5)] é mais hidrofóbica que a porção E [E
representa o oxietileno, OCH2CH2)], compondo, assim, o núcleo da micela e o grupo terminal
compõe a corona micelar. Logo, a scp é realizada significativamente pela porção hidrofóbica. O
P123 e o F127 possuem núcleos hidrofóbicos praticamente iguais, entretanto os valores de scp do
Capacidade de Solubilização (mg/g)
P123 são maiores que do F127 a 25 e 37 ºC para griseofulvina e mangiferina.
14
12
10
8
6
4
2
0
20
40
60
80
100
% P123
Figura 3. Capacidade de solubilização (scp) do P123, F127 e suas misturas nas proporções de PF75/25, PF70/30, PF50/50, PF25/75 e PF30/70: ()
griseofulvina a 25 ªC, () griseofulvina a 37 ºC e () mangiferina a 37 ºC.
O aumento da proporção do copolímero mais hidrofóbico (P123) na mistura binária favoreceu
um aumento na scp (Figura 3). Para griseofulvina a 25 ºC, a partir de 70% de P123 na mistura, o
valor de scp ultrapassa o valor do P123 sozinho, enquanto a 37 ºC o maior valor de scp é
“linearmente” crescente, não ultrapassando o valor do P123 sozinho. A mangiferina a 37 ºC
Anais do 9o Congresso Brasileiro de Polímeros
5
apresenta aumento crescente de scp, não ultrapassando valor do P123 sozinho, entretanto o valor de
scp para a mistura PF50/50 foi menor.
As misturas dos copolímeros triblocos apresentaram capacidade de solubilização maior que
para os Pluronics sozinhos16. A solubilidade aumenta com a mistura de copolímeros triblocos com
diferentes hidrofobicidades, principalmente com o aumento da proporção do copolímero mais
hidrofóbico.5
Conclusões
A característica de formação de gel a frio dos copolímeros P123 (E21P67E21) e do F127
(E98P67E98) tornaram promissora a mistura deles em proporções PF75/25, PF50/50 e PF25/75 (com
proporção crescente de P123) para sistemas de liberação.
A solubilidade do fármaco griseofulvina aumenta com a temperatura, o que concorda com
outros sistemas citados na literatura.8 Tal fato também é utilizado para sugerir presença de micelas
esféricas. A capacidade de solubilização (scp) sofreu aumento proporcional ao aumento da
proporção de P123, concordando com o fato do P123 ser mais hidrofóbico que F127.
As misturas dos copolímeros P123 e F127 podem ser utilizadas como solubilizadores e
sistemas encapsulantes para liberação controlada dos fármacos griseofulvina, mangiferina, entre
outros.
Agradecimentos
CAPES e CNPq pelas bolsas concedidas
Referências Bibliográficas
1. C. Booth; D. Attwood Macromol. Rap. Comm., 2000, 21, 501.
2. N. M. P. S. Ricardo; C. Chaibundit; Z. Yang; D. Attwood; C. Booth Langmuir, 2006, 22, 1301.
3. W. J. Harrison; G. J. Aboulgasem; F. A. I. Elathrem; S. K. Nixon; D. Attwood; C. Price; C.
Booth Langmuir, 2005, 21, 6170.
4. T. Liu; V.M. Nace; B. Chu Langmuir, 1999, 15, 3109.
5. M. E. N. Pinho; F. de M. L. L. Costa; N. M. P. S. Ricardo; S. G. Yates; D. Attwood; C. Booth
Int. J. of Pharm., 2007, 328, 95.
6. R. Arenas; J. Ruiz-Esmenjaud An. Bras. Dermatol., 2004, 79(2), 225.
7. P. Taboada; G. Velasquez; S. Barbosa; V. Castelletto; S. K. Nixon; Z. Yang; F. Heatley; I. W.
Hamley; V. Mosquera; M. Ashford; D. Attwood; C. Booth Langmuir, 2005, 21, 5263.
8. M. Crothers; Z.-Y. Zhou; N. M. P. S. Ricardo; Z. Yang; P. Taboada; C. Chaibundit; D.Attwood;
C. Booth Int. J. Pharm., 2005, 293, 91.
9. M. Aritomi, T. Kawasaki Tetrahedron Lett, 1969, 12, 941.
10. T. Sato, A. Kawamoto, A. Tamura, Y. Tatsumi, T. Fujii Chem. Pharm. Bull., 1992, 40, 721.
11. B. C. Saunders Peroxidases and catalases, G. L. Eichorn, Amsterdam, 2000, p. 988–1021.
12. G. Ghosal, G. Rao, V. Saravanan, S. Misra, D.Rana Indian J. Chem., 1996, 35B, 561.
13. C. Chaibundit; F. de M. L. L. Costa; N. M. P. S. Ricardo; S. G. Yeates; C. Booth Langmuir,
submetido, 2007.
14. M. E. N. Pinho, Dissertação de Mestrado, Universidade Federal do Ceará, 2006.
Anais do 9o Congresso Brasileiro de Polímeros
6
15. G. Gaucher; M.-H., Dufresne; V. P. Sant; N. Kang; D. Maysinger; J.-C. Leroux J. of Contr.
Rel., 2005, 109, 169.
16. T. O. Kyung; T. K. Bronich; A. V. Kabanov J. of Contr. Rel., 2004, 94, 411.
Anais do 9o Congresso Brasileiro de Polímeros
7







![Roteiro Mensal [3ª série] – Biologia – Química – Empreendedorismo](http://s1.studylibpt.com/store/data/000321355_1-fe20122337e00be7fc133cc291bfacca-300x300.png)