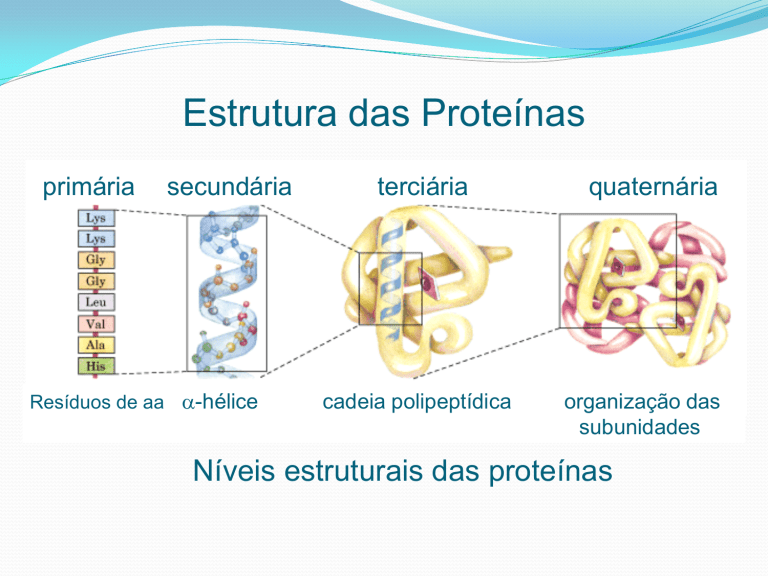
Estrutura das Proteínas
primária
secundária
Resíduos de aa -hélice
terciária
cadeia polipeptídica
quaternária
organização das
subunidades
Níveis estruturais das proteínas
Formação da ligação
peptídica
Extremidades
amino e carboxi
terminal dos peptídeos
ACMSN
Estrutura primária:
Seqüência de aminoácidos e localização de
pontes dissulfeto, se houver
Por que é importante?
Determina os outros níveis estruturais
Informações sobre mecanismo de ação e sobre a
ação fisiológica
Indica o grau de proximidade de diferentes
espécies
Permite a produção de peptídeos sintéticos
3
Comparação da insulina humana com a de
outras espécies
Humana
Thr (8), Ile (10), Thr (30)
Bovina
Ala (8), Val (10), Ala
(30)
Porcina
Thr (8), Ile (10), Ala (30)
Estrutura secundária:
Arranjos regulares de aminoácidos que, estão
localizados próximos uns dos outros, na
seqüência linear
Tipos:
-hélice
-folha
-curvatura
Estrutura não repetitiva
Estruturas supersecundárias (motivos)
-hélice
3,6 resíduos de aa/volta
Pontes de hidrogênio
intracadeia (aa e o 4º aa seguinte)
Grupos R projetados para fora
da hélice
Orientação para a direita ou
para a esquerda
Pro, Glu, Asp, His, Lys, Arg
incompatíveis com a estrutura
Pontes de
hidrogênio
-folha
Cadeias quase totalmente estendida.
Pontes de H intercadeias.
Grupos R projetados para cima e para baixo da folha
pregueada.
Orientação paralela ou anti-paralela
ACMSN
-curvatura (volta reversa)
Reverte a direção da cadeia polipeptídica
Resíduos de aas carregados
Presentes na superfície da proteína
Compostas por 4 aas, sendo um deles a Pro
Pontes de H intracadeia e ligações iônicas
ACMSN
Estruturas secundárias
não repetitivas
Estruturas
supersecundárias
Conformação em alça
Agrupamento de
ou espiral
Revertem a direção da
cadeia polipeptídica
Não são aleatórias
Estruturas menos
regulares
elementos estruturais
secundários adjacentes
Estrutura Terciária
Estrutura tridimensional da proteína
Relação geométrica entre segmentos distantes na estrutura
primária
Relações entre as cadeias laterais dos aminoácidos no espaço
tridimensional
Estabilizada por
Pontes dissulfeto
Pontes de hidrogênio
Ligações iônicas
Interações hidrofóbicas
interações de van der Waals
mioglobina
Domínios
Unidades fundamentais funcionais e de estrutura
tridimensional de um peptídeo
Regiões compactas semi-independentes com
geometria característica
Troponina C
Estrutura quaternária
Arranjo das cadeias polipeptídicas numa proteína
multicadeias
As subunidades são mantidas juntas por interações
não covalentes
hemoglobina
DESNATURAÇÃO
•Perda das estruturas 2ª, 3ª e 4ª
de uma proteína.
•Agentes desnaturantes:
•Variações de pH:
• alteram as cargas elétricas da
proteína.
•Solventes orgânicos e compostos
como uréia e detergentes:
• rompem as interações
hidrofóbicas.
•Aumento de temperatura:
• rompe várias ligações fracas.
13
Dobramento inadequado das proteínas
Pode ocorrer:
de forma espontânea
por mutação gênica
por clivagem
proteolítica anormal
Amilóides:
Agregados protéicos
espontâneos
Resultam em
doenças
degenerativas
Doença de Alzheimer
Fatores biológicos
Formação de placa amilóide no
parênquima cerebral e ao redor
dos vasos sangüíneos
Peptídeo com 40-43 aas (A)
Agregação em folha
Neurotóxico
Acúmulo cerebral de
emaranhados de neurofibrilas
Proteína tau defeituosa
14
Bibliografia
• Champe, P.C.; Harvey, R.ª; Ferier, D.R.Bioquímica Ilustrada,
traduzido por Carla Dalmaz. 3ª Ed., ARTMED, 2005.
• Campbell, M. K. Bioquímica; traduzido por Henrique B. Ferreira
et al. 3ª ed. Porto Alegre: Artes Médicas, 1997
• Lehninger, A; Nelson, D.; Cox, M. Princípios de Bioquímica.
Traduzido por Arnaldo A Simões, Wilson R. N. Lopes. 2ª ed.,
São Paulo: SARVIER, 2000
• Devlin, T.M. Manual de Bioquímica Química Clínica com
Correlações Clínicas; traduzido por Yara M. Michelacci et
al.
4ª ed, São Paulo: Edgard Blücher Ltda, 1997.
• Krause-Alimentos, nutrição e dietoterapia
8ª Ed., Editora Roca












