Equilíbrio Químico
Controlo da Produção
Industrial de Amoníaco
Reações completas
• Combustão do carvão
C (s) + O2 (g)
CO2 (g)
Reações completas
• Reação do Ácido clorídrico com o Magnésio
2 HCl (aq) + Mg (s)
MgCl2 (aq) + H2 (g)
Reações completas
• Os reagentes transformam-se para formar produtos da reação;
• Há esgotamento de pelo menos um dos reagentes;
• No estado final existem:
- Apenas produtos da reação, se os reagentes estiverem em
proporções estequiométricas;
- Produtos da reação e reagentes, quando em excesso.
Reações Irreversíveis
• Reação do Ácido clorídrico com o Magnésio
2 HCl (aq) + Mg (s)
• Em sistema fechado,
os produtos em contacto,
não originam os reagentes.
MgCl2 (aq) + H2 (g)
Reações Reversíveis
• Reação do Iodo com o Hidrogénio
I2 (g) + H2 (g)
Violeta Incolor
2 HI (g)
Incolor
Reações Reversíveis
• Reação do Iodo com o Hidrogénio
I2 (g) + H2 (g)
2 HI (g)
Violeta
Incolor
Incolor
• Atinge-se o equilíbrio químico.
Reação direta ou
sentido direto da
reação
Transformação
representada na equação
química com a seta a
apontar para a direita:
Reagentes do lado
esquerdo e produtos da
reação do lado direito
Reação inversa ou
sentido inverso da
reação
Transformação
representada na equação
química com a seta a
pontar para a esquerda:
Produtos da reação do
lado esquerdo e
reagentes do lado direito
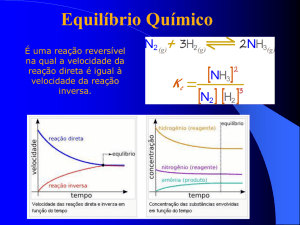
Equilíbrio Químico
• Equilíbrio dinâmico – as velocidades das reações direta e
inversa são iguais;
• Não há alteração das propriedades macroscópicas do
sistema.
Equilíbrio Químico
• Início - Reacção directa
• Após algum tempo – Reação Inversa
Equilíbrio Químico
• Após atingir o equilíbrio químico - velocidades das reações
direta inversa são iguais.
Equilíbrio Químico
• As concentrações de reagentes e produtos
mantêm-se constantes.
Equilíbrio Químico
A reação direta e a reação
inversa continuam a ocorrer
com igual velocidade.
As concentrações das
substâncias presentes
mantêm-se constantes.
Não há mudanças observáveis
nas propriedades do sistema
(cor, pressão, temperatura,…)
Equilíbrio Químico
Equilíbrio
Rapidez da reação
Concentração
químico
Direta
Inversa
Antes
Diminui Aumenta
Após
São iguais
Reagentes
Produtos
Diminui
Aumenta
São constantes
Equilíbrio Químico
• Equilíbrio Homogéneo
I2 (g) + H2 (g)
2 HI (g)
Os constituintes do sistema encontram-se todos na mesma
fase.
• Equilíbrio Heterogéneo
CaCO3 (s)
CaO (s) + CO2 (g)
Os constituintes do sistema encontram-se em diferentes fases.
Equilíbrio Químico
Amoníaco
N2(g) + 3 H2 (g)
2 NH3 (g)
Equilíbrio Químico
Amoníaco
• Há uma infinidade de estados de equilíbrio que se podem
obter a partir das diferentes concentrações iniciais.
Constante de Equilíbrio, Kc
CO (g) + H2O (g)
CO2 (g) + H2 (g)
???
???
???
???
Constante de Equilíbrio, Kc
A + B
C + D
Lei do Equilíbrio Químico (ou Lei da Ação das Massas)
Foi estabelecida pelos cientistas noruegueses Cato Guldberg
e Peter Waage em finais do século XIX.
Constante de Equilíbrio, Kc
aA + bB
cC + dD
Relações entre constantes de equilíbrio
1- Reações inversas
Se duas reações químicas forem inversas uma da outra, as suas
constantes de equilíbrio também são inversas uma da outra.
Relações entre constantes de equilíbrio
2- Reações com coeficientes estequiométricos múltiplos
Se os coeficientes estequiométricos de uma equação química
forem multiplicados por um valor n, a constante de equilíbrio
referente à nova equação é igual à inicial elevada ao expoente n.
Relações entre constantes de equilíbrio
3- Combinação de reações químicas
Se uma
Relações entre constantes de equilíbrio
3- Combinação de reações químicas
Se uma equação química puder ser expressa como a soma
de duas ou mais equações químicas, a constante de
equilíbrio da reação global é igual ao produto das
constantes de equilíbrio das reações parciais.
Kc e extensão da reação
1- Síntese do Cloreto de Hidrogénio
H2 (g) + Cl2 (g)
2 HCl (g)
Kc (25 °C) = 3,8 x 1033
Se K 1 os reagentes têm muita tendência para reagirem.
Produtos
Reagentes
Kc e extensão da reação
2- Síntese do Monóxido de Azoto
N2 (g) + O2 (g)
2 NO (g)
Kc (25 °C) = 1,0 x 10-30
Se K 1 os reagentes não têm tendência para reagirem.
Reagentes
Produtos
Kc e extensão da reação
Valor de
Kc muito
pequeno
A reação quase
não se dá.
10-3
1
103
Concentrações
apreciáveis de
reagentes e produtos na
mistura reaccional em
equilíbrio.
Valor de
Kc muito
grande
A reação é
quase completa.
Kc e extensão da reação
aA + bB
cC + dD
Cce xDde
Kc
A ae xBbe
Kc
Numerador
(produtos)
Denominador
(reagentes)
Grau de conversão
de reagentes em
produtos(extensão
da reação
Kc1
Valor elevado
Valor baixo
Elevado (reação
muito extensa)
Kc1
Valor baixo
Valor elevado
Baixo (reação pouco
extensa)
Kc 1
Valor médio
Valor médio
Intermédio (extensão
intermédia)
Quociente da reação
• Para a transformação:
aA + bB
C c xDd
Qc
Aa xBb
cC + dD o
quociente da reação é:
, sendo os valores das
concentrações medidos num instante qualquer.
Síntese do amoníaco
N2(g) + 3 H2 (g)
2 NH3 (g)
T=350ºC, Kc = 5,355
Se C = 0,2mol.dm-3, para todos os componentes em que
sentido irá evoluir a reação?
Quociente da reação
Kc
Qc
Reagentes
Produtos
Qc
Kc
Sentido
da reação
Qc
Kc
Sentido
da reação
Equilíbrio
Reagentes
Produtos
Quociente da reação
Qc
QcKc
Aumenta
Sentido
Direto
até
Favorece
Formação
Denominador Numerador
(Reagentes)
(Produtos)
Diminui
Aumenta
Aumenta
Diminui
Constante
Constante
de produtos
igualar Kc
QcKc
Qc=Kc
Diminui
Inverso
Formação
até
de
igualar Kc
reagentes
Não varia Equilíbrio Velocidades
iguais
Kc e Temperatura
• Decomposição do carbonato de cálcio
T aumenta Kc aumenta Reação endotérmica
Kc e Temperatura
• Síntese do amoníaco
T aumenta Kc diminui Reação exotérmica
Principio de Le Chatelier
Se a um sistema em equilíbrio se causa uma
perturbação este vai reagir evoluindo no sentido de
contrariar essa perturbação.
Que perturbação???
1- Variação da concentração
(a)Solução de nitrato de ferro (III) ;
(b)Solução de tiocianato de sódio;
(c)Solução contendo iões tiocianato de ferro (III).
1- Variação da concentração
1- Variação da concentração
1- Variação da concentração
Perturbação provocada
Reação do sistema
Aumento da concentração de
Evolui no sentido direto
um reagente
Aumento da concentração de
Evolui no sentido inverso
um produto
Diminuição da concentração
Evolui no sentido inverso
de um reagente
Diminuição da concentração
de um produto
Evolui no sentido direto
2- Variação da pressão
À mesma temperatura e para
o mesmo número de
partículas, quanto menor o
volume ocupado pelo gás,
maior será a pressão
exercida por este.
2- Variação da pressão
N2O4(g)
2NO2(g)
Incolor
Castanho
2- Variação da pressão
Aumento da pressão
Diminuição da pressão
O sistema vai evoluir no
O sistema vai evoluir no
sentido da reação que origina
sentido da reação que origina
o menor número de moléculas
maior número de moléculas
de componentes gasosos.
de componentes gasosos.
3- Variação da temperatura
N2O4(g)
2NO2(g) H = + 58,1kJ
Incolor
Castanho
3- Variação da temperatura
Aumento de
Diminuição de
temperatura
temperatura
Absorção de energia
É retirada energia do
pelo sistema
sistema
O sistema evolui no sentido
O sistema evolui no sentido
da direção endotérmica
da direção exotérmica
Processo de Haber- Bosch
N2(g) + 3 H2 (g)
2 NH3 (g)
Condições de concentração
• Aumentando a quantidade de azoto (N2), reagente
mais barato, aumenta o rendimento da reação.
Processo de Haber- Bosch
N2(g) + 3 H2 (g)
Condições de pressão
2 NH3 (g)
Processo de Haber- Bosch
N2(g) + 3 H2 (g)
Condições de Temperatura
2 NH3 (g) , H 0
Processo de Haber- Bosch
N2(g) + 3 H2 (g)
Condições
de
Temperatura
2 NH3 (g) , H 0
Processo de Haber- Bosch
N2(g) + 3 H2 (g)
Uso de catalisadores
2 NH3 (g) , H 0
Processo de Haber- Bosch
Uso de catalisadores
Processo de Haber- Bosch
Condições economicamente aceitáveis para produzir
amoníaco:
1- Pressão de 200 a 600 atm;
2- Temperatura de 450oC;
3- Catalisadores (uma mistura de Fe, K2O e Al2O3).
Atinge um rendimento de aproximadamente 50%;
O método permite ainda que as sobras de N2 e H2 sirvam para
produzir mais amoníaco.