Nas células tem-se o seguinte equilíbrio:
Keq=0,42
Sendo assim, quando a concentração molar de glicose
for de 0,10 mol/litro,a de frutose será
Alteração na concentração:
- Se aumentarmos a concentração dos reagentes, o equilíbrio se deslocará para
a direita, ísto é, no sentido dos produtos.
- Se aumentarmos a concentração dos produtos, o equilíbrio se deslocará para a
esquerda, ísto é, no sentido dos reagentes.
- Se diminuirmos a concentração dos reagentes, o equilíbrio se deslocará para a
esquerda, ísto é, no sentido dos reagentes.
- Se diminuirmos a concentração dos produtos, o equilíbrio se deslocará para a
direita, ísto é, no sentido dos produtos.
CO2 (g) + H2 (g)
CO(g) + H2O(g)
Suponha que certa quantidade de CO2 e H2 estão contidas em um recipiente
hermeticamente fechado e que disponhamos de um instrumento que nos permita acompanhar
o desenvolvimento da reação. Após o início da reação, percebemos que as concentrações dos
reagentes (CO2 e H2) diminuem e que as dos produtos (CO e H2O) aumentam. (Todas essas
concentrações aumentam e diminuem na mesma proporção, já que a relação estequiométrica
de todas as substâncias envolvidas, em razão mol por mol, é de 1:1). Veja abaixo o gráfico que
representaria esse equilíbrio químico:
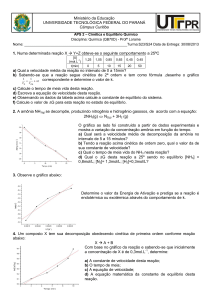
Considerando que a reação se inicia no instante t0, as concentrações dos reagentes
diminuíram e as dos produtos aumentaram. Veja, pelo gráfico, que as variações de
concentração vão se tornando menos acentuadas desde o início da reação até o instante t3,
em que o equilíbrio foi atingido. Isso significa que as velocidades de troca se tornam
menores com o passar do tempo. No tempo t0 somente pode ocorrer a reação no sentido da
formação dos produtos: A + B
C + D (reação direta). Entretanto, após certo tempo,
quando significativa quantidade de produto já foi formada, pode se iniciar a reação no
sentido contrário, ou seja, de se regenerar os reagentes: C + D
A + B (reação inversa).
A velocidade da reação direta diminui com o tempo, devido ao decréscimo de reagentes
(menor número de choques efetivos). Ao mesmo tempo, a velocidade da reação inversa
aumenta, por causa do aumento da concentração dos produtos.
Finalmente, em t3, a velocidade da reação direta diminui e a da reação inversa
aumenta, a ponto de se igualarem. A partir daí não há mais variação das concentrações de
reagentes e produtos, uma vez que estes são formados e consumidos em velocidades iguais:
CO2 (g) + H2 (g)
CO(g) + H2O(g)
. Concentração x tempo
Não há predomínio de nenhuma das reações.
A reação inversa predomina.
A constante de equilíbrio para a ionização do ácido acético,
,
é 0,00002. O que você pode concluir sobre essa reação?
Equilíbrio Químico
A equação para a reação química desse problema desceve a ionização ácido acético. O
ácido acético (CH3COOH) pode se ionizar originando íons acetato (CH3COO-) e íons
hidrogênio (H+).
A igualdade de velocidade entre as reações direta e inversa é denominada equilíbrio
químico, que é definido pela razão entre os valores das concentrações dos produtos e as
dos reagentes no equílibrio, ou seja, quando não há mais variação das concentrações.
Para essa reação,
Como a constante de equilíbrio é muito pequena, podemos concluir que a mior parte do
ácido acético permanece não-ionizada, e que a ionização do ácido acético não é
espontânea.
Abaixo encontra-se um resumo de importantes relações entre energia livre,
espontaneidade e equilíbrio químico:
Reação Espontânea
Reação Não-Espontânea
Keq > 1
Keq < 1
G<0
G>0
Exergônica
Endergônica
A reação direta é favorecida
A reação inversa é favorecida
A ionização do ácido acético
Esse é um processo não espontâneo quando se inicia com ácido acético.
A constante de equilíbrio da conversão do dissacarídeo sacarose nos açúcares simples
glicose e frutose é de 140.000. O que você pode concluir sobre a reação : sacarose +
H2O
glicose + frutose?
Equações químicas
A equação da reação química descrita neste problema é a que segue:
Essa é uma reação de hidrólise. O dissacarídeo sacarose é hidrolisado originando dois
monossacarídeos, glicose e frutose. As reações de hidrólise biológicas são quase sempre
espontâneas (exergônicas).
A igualdade de velocidade entre as reações direta e inversa é denominada equilíbrio
químico, que é definido pela razão entre os valores das concentrações dos produtos e as
dos reagentes no equílibrio, ou seja, quando não há mais variação das concentrações.
Para essa reação,
Energia livre e equilíbrio químico
Essa reação química pode ocorrer em ambas as direções, mas os produtos glicose e
frutose estão num nível de energia menor do que o do reagente sacarose.
A diferença entre reações espontâneas e não-espontâneas pode ser percebida pelas
seguintes relações:
Reação Espontânea
Reação Não-Espontânea
Keq > 1
Keq < 1
G<0
G>0
Exergônica
Endergônica
A reação direta é favorecida
A reação inversa é favorecida
A hidrólise da sacarose
Essa é uma reação espontânea quando se inicia com a sacarose pois Keq >