CAPÍTULO
e15
Desequilíbrios entre Líquidos e
Eletrólitos e Desequilíbrios entre
Ácido e Base
Dados laboratoriais
+
Na
Unidades
130
meq/L
+
5,0
meq/L
-
96
meq/L
CO2
14
meq/L
Nitrogênio da ureia sanguínea (BUN)
20
mg/dL
Creatinina (Creat)
1,3
mg/dL
Glicose
450
mg/dL
Gases no sangue arterial
No ar ambiente
pH
7,39
PaO2
24
mmHg
PaO2
89
mmHg
14
meq/L
20
meq/L
K
Cl
-
HCO 3
Exame de urina
Cetonas urinárias
Positiva 4⫹
Glicose
Positiva 4⫹
Cetonas séricas
Fortemente positiva 1:8
Radiografia torácica
Infiltrado pneumônico no lado direito
Lobo inferior
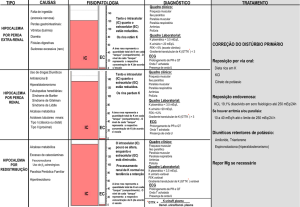
■ ABORDAGEM DIAGNÓSTICA
O diagnóstico do distúrbio ácido-base deveria prosseguir por etapas:
1. O hiato aniônico (HA) normal é de 10 meq/L, embora neste
caso o HA seja elevado (20 meq/L). Portanto, a alteração no HA
(⌬HA) = 10 meq/L.
2. Compare o ⌬HA e o ⌬[HCO–3]. Neste caso, o valor do ⌬HA é
10, de acordo com o item acima, e o ⌬[HCO–3] (25 – 14) é 11.
Portanto, o incremento no hiato aniônico é aproximadamente
igual ao decréscimo no nível de bicarbonato.
3. O próximo passo é estimar a resposta respiratória compensatória. Neste caso, o PaO2 previsto para um [HCO–3] de 14 deve
ser de aproximadamente 29 mmHg. Para obter esse valor basta
adicionar 15 ao [HCO–3] medido (15 + 14 = 29) ou calculando
o PaO2 previsto a partir da equação de Winter: 1,5 ⫻ [HCO–3] +
Neste caso, as características clínicas incluem hiperglicemia,
hipovolemia, cetoacidose, sinais de confusão no sistema nervoso
central (SNC) e sobreposição de pneumonia. Este cenário clínico
é consistente com cetoacidose diabética (CAD) que desenvolve em
pacientes com diabetes melito tipo 1 conhecida. A presença de infecções em casos de CAD é comum e pode ser uma característica
precipitante do desenvolvimento de cetoacidose.
Usualmente, o diagnóstico de CAD não é tão desafiador, porém
deve ser considerado em todos os pacientes com hiato aniônico elevado e acidose diabética. A hiperglicemia e a cetonemia (acetoacetato positivo em uma diluição de 1,8 ou mais) são critérios suficientes
para dignósticos em pacientes portadores de diabetes melito tipo 1. O
–
⌬[HCO 3] deve aproximar o acréscimo do hiato aniônico (⌬HA), porém a igualdade poderá ser alterada por vários fatores. Por exemplo,
o ⌬HA geralmente diminui com hidratação intravenosa, levando-se
em consideração que a filtração glomerular aumenta e as cetonas são
expelidas através da urina. O decréscimo no nível de sódio plasmático é resultado da hiperglicemia que, por sua vez, induz a movimentação de água no compartimento intracelular das células, exigindo
insulina para o transporte de glicose. Além disso, ocorre uma natriurese em resposta à diurese osmótica associada à hiperglicemia.
Além disso, em pacientes com CAD a sede é muito comum e, em
geral, a ingestão de água é contínua. Usualmente, as concentrações
plasmáticas de potássio são ligeiramente elevadas, porém, em face da
acidose e com base na diurese osmótica em curso, o déficit corporal
total significativo de potássio é de importância fundamental. A inclusão da reposição de potássio no regime terapêutico no momento
apropriado e com as indicações adequadas (ver abaixo) é essencial. A
depleção volumétrica é uma descoberta muito comum em casos de
cetoacidose diabética, além de ser um componente fundamental na
patogênese do distúrbio.
■ ABORDAGEM DE GERENCIAMENTO
Com frequência, os pacientes portadores de cetoacidose diabética
apresentam déficit significativo e sustentado de sódio, potássio, água,
bicarbonato e fostato. A abordagem geral ao tratamento exige atenção especial a todas essas anormalidades. Para que seja bem sucedido,
o tratamento de CAD envolve abordagens por etapas, como segue:
Desequilíbrios entre Líquidos e Eletrólitos e Desequilíbrios entre Ácido e Base
CASO 1
Uma mulher de 23 anos de idade foi admitida com histórico de febre
de 3 dias, tosse produzindo escarro tingido de sangue, confusão e
ortostase. O histórico medico anterior incluía diabetes melito tipo 1.
O exame físico realizado no departamento de emergências indicou
a presença de hipotensão postural, taquicardia e respiração de Kusmaul. O hálito era “cetônico”. O exame do tórax sugeriu consolidação
no lobo inferior direito.
CAPÍTULO e15
David B. Mount
Thomas D. DuBose, Jr.
8. Neste caso, o valor previsto para o PaO2 de 29 é significativamente mais elevado do que 24. Portanto, o PaO2 prevalente ultrapassa a faixa apenas para fins de compensação, sendo, assim,
excessivamente baixa.
4. Portanto, esta paciente apresenta um misto de distúrbio ácido-base com dois componentes: (a) acidose elevada com hiato
aniônico, secundária a cetoacidose; e (b) alcalose respiratória
secundária a pneumonia adquirida na comunidade. A alcalose
respiratória resultou em um componente adicional de hiperventilação que excedeu a resposta compensatória acionada
pela alcalose metabólica, explicando o pH normal neste caso.
A descoberta de alcalose respiratória no quadro de acidose com
hiato aniônico sugere a presença de outra causa do componente
respiratório que, neste caso, poderá ser atribuído à pneumonia
adquirida na comunidade.
1. Reposição dos déficits volumétricos de fluidos extracelulares
(FECs). Levando-se em consideração que a maioria dos pacientes se apresenta com hipotensão real ou relativa e, às vezes, em
estado de choque iminente, a administração inicial de fluidos
deve ser de infusão rápida de NaCl a 0,9%, até a pressão arterial
sistólica ultrapassar 100 mmHg ou até a administração acumulada de 2 a 3 litros. Durante o período inicial de 2 a 3 horas de
infusão de solução salina, o declínio do nível de glicose no sangue pode ser resultado da diluição e do aumento na excreção
renal. Pode-se adicionar glicose na infusão como D5 NS ou D5
0,45 NS depois que o nível de glicose plasmática cair para 230
mg/dL ou menos.
2. Redução na produção de cetoácidos. Durante a cetoacidose
diabética a administração regular de insulina é imprescindível
©2013, AMGH Editora Ltda. Todos os direitos reservados.
15-1
3.
PARTE II
4.
Principais Manifestações e Apresentações das Doenças
5.
6.
7.
como um bolo intravenoso inicial de 0,1 U/kg em relação ao
peso corporal (PC), seguida de uma infusão contínua imediata
de 0,1 U/kg do peso corporal por hora em solução salina. A
eficácia da administração intravenosa (ou subcutânea) de insulina pode ser rastreada observando-se o declínio no nível de
cetonas plasmáticas. Considerando que o incremento no hiato
aniônico acima do valor normal de 10 meq/L representa acúmulo de cetoacidose na CAD, o desaparecimento dos ânions
cetoácidos reflete-se no estreitamento e na normalização final
do hiato aniônico. Tipicamente, o hiato aniônico plasmático retorna ao nível normal dentro de 8 a 12 horas.
Reposição dos déficits de potássio. Embora, de maneira geral,
sejam hipercalêmicos, por causa da deficiência insulínica, usualmente os pacientes com CAD apresentam depleção grave de
K+. Deve-se adicionar KCl (20 meq/L) a cada litro IV de fluidos
depois do estabelecimento do débito urinário e da administração de insulina.
Correção da acidose metabólica. Usualmente, a concentração
plasmática do bicarbonato não aumenta durante várias horas
por causa da diluição resultante da administração intravenosa
de NaCl. O nível de plasma [HCO-] se aproxima de 18 meq/L
logo após o desaparecimento da cetoacidose. Com frequência,
a terapia com bicarbonato de sódio não é recomendada, especialmente em crianças. O bicarbonato deve ser administrado
em adultos com acidemia extrema (pH < 7,1); em pacientes
idosos (> 70 anos) o limite recomendado de pH é de 7,20. Caso
seja necessário, o bicarbonato de sódio deve ser administrado
apenas em pequenas quantidades. O bicarbonato deverá ser
adicionado ao fluido extracelular tendo em vista que os cetoácidos são metabolizados depois da terapia insulínica. O excesso de alcalose pode resultar da combinação da administração
exógena de bicarbonato de sódio e da produção metabólica de
bicarbonato.
Fosfato. Durante as primeiras 6 a 8 horas de terapia pode ser
necessário fazer infusões de potássio com fosfato por causa do
desmascaramento da depleção fosfática na terapia combinada
de insulina e glicose. A glicose transporta o fosfato para a célula. Portanto, em pacientes com CAD, o nível de fosfato plasmático deve ser seguido de perto, porém a reposição fosfática
nunca deverá ser feita de forma empírica. O fosfato deve ser
administrado em pacientes com nível de fosfato plasmático em
queda, levando-se em consideração que o nível de fosfato cai
para o nível normal baixo. A terapia recomendável é na forma
de fosfato de potássio a uma taxa de 6 mmol/hora.
A busca de fatores subjacentes tais como infecção, infarto do
miocárdio, pancreatite e interrupção da terapia insulínica sempre é muito importante, assim como a busca de outros eventos
responsáveis pelo início da cetoacidose diabética. O caso que
estamos apresentando ilustra esse ponto.
Expansões volumétricas excessivas com administração intravenosa de fluidos são comuns e contribuem para o desenvolvimento de acidose hiperclorêmica durante os estágios finais do
tratamento de CAD. Recomenda-se evitar expansões volumétricas excessivas.
CASO 2
Um homem de 25 anos de idade com histórico de 6 anos de HIV/
Aids recentemente complicado pela pneumonia por Pneumocystis
jiroveci (PPC) foi tratado com administração intravenosa de trimeroprima-sulfametoxazol (20 mg TMP/kg por dia) No quarto dia de
tratamento foram obtidos os seguintes dados laboratoriais:
Dados laboratoriais
Unidades
Plasma
Urina
Na+
meq/L
135
60
+
meq/L
6,5
15
meq/L
110
43
meq/L
15
0
K
-
Cl
-
HCO3
15-2
Dados laboratoriais
Unidades
pH
Plasma
Urina
7,30
5,5
-
BUN
mg/dL
14
Creat
mg/dL
0,9
-
Osmolalidade
mOsmoL/kg H2O
268
270
■ ABORDAGEM DIAGNÓSTICA
Qual a causa de hiperpotassemia e de acidose metabólica neste paciente? Que outras medicações poderão estar associadas a apresentações semelhantes? Como utilizar os dados eletrolíticos urinários para
determinar se a origem da hiperpotassemia é renal ou se foi causada
por deslocamentos celulares para o compartimento extracelular?
A hiperpotassemia ocorre em 15 a 20% dos pacientes hospitalizados portadores de HIV/Aids. As causas usuais são insuficiência
adrenal, síndrome do hipoaldosteronismo hiporreninêmico ou uso de
vários medicamentos incluindo trimetoprima, pentramidina, medicamentos anti-inflamatórios não esteroidais, inibidores da enzima conversora da angiotensia (ACE), bloqueadores do receptor da angiotensina II, espironolactona e eplerona. Usualmente, nos tratamentos de
PPC, a trimetoprima é administrada em combinação com sulfametoxazol ou com dapsona e, na média, aumenta a concentração de K+ em
aproximadamente 1 meq/L. Entretanto, pode agravar a hiperpotassemia. Sob os pontos de vista estrutural e químico a trimetoprima está
relacionada à amilorida e ao triantereno e, consequentemente, pode
agir como diurético poupador de potássio. Esse efeito é o resultado da
inibição do canal de sódio epitelial (CNaE) nas células principais do
ducto coletor. O bloqueio do canal de Na+ inibe também a secreção de
K+. A secreção de K+ depende da diferença potencial do lúmen negativo gerada pela entrada K+ através do CNaE (Fig. e15.1).
A TMP está associada a uma acidose de hiato não aniônico que se
compara ao desenvolvimento de hiperpotassemia de forma que, nesse
tipo de quadro, é muito comum a ocorrência simultânea de hiperpotassemia e de acidose metabólica. A secreção de H+ através das bombas
de H+-ATPase em células intercaladas adjacentes tipo A (Figura e15.1)
também é eletrogênica, de forma que a redução na diferença de potencial do lúmen negativo devido à TMP inibe a secreção distal de H+.
Com frequência, esse fato é conhecido como uma forma de defeito de
voltagem na acidose tubular renal distal. A hiperpotassemia sistêmica
pode suprimir também a amoniagênese renal, a excreção de amônia
e, consequentemente, a excreção ácida, isto é, a hiperpotassemia propriamente dita exerce múltiplos efeitos sobre a acidificação urinária.
O efeito inibitório da trimetoprima sobre a secreção de K+ e H+
no túbulo coletor cortical acompanha a relação entre dose e resposta.
Portanto, doses maiores desse agente usadas em pacientes portadores
de HIV/Aids com PPC ou em infecções teciduais profundas por Staphyloccus aureus resistente à meticilina (MRSA) resultam na prevalência mais elevada de hiperpotassemia e acidose. As doses convencionais de trimetoprima também podem induzir hiperpotassemia e/
ou acidose em pacientes predispostos, particularmente em idosos,
em pacientes com insuficiência renal e/ou em pacientes com hipoaldosteronismo hiporreninêmico na linha de base.
Uma das formas de avaliar o papel dos rins no desenvolvimento de hiperpotassemia é calcular, a partir de um spot urinário e de
uma amostra de plasma coincidente, o gradiente transtubular de potássio (GTTP). O GTTP é calculado pela fórmula (Posmol ⫻ Upotássio)/
Ppotássio ⫻ Uosmol). Os valores esperados do GTTP são inferiores a 3 na
presença de hipocalemia (ver também os casos 7 e 8) e acima de 7 a
8 na presença de hiperpotassemia. Neste caso, o valor do GTTP de
aproximadamente 2 indica que a excreção renal de potássio é anormalmente baixa para a hiperpotassemia prevalente. Portanto, níveis
inapropriadamente baixos de GTTP indicam que a origem da hiperpotassemia é tubular renal.
■ ABORDAGEM DE GERENCIAMENTO
O conhecimento dos fatores que controlam a secreção de potássio
pelas células principais do túbulo coletor cortical pode ser útil na
compreensão da base para o tratamento de hiperpotassemia, em es-
©2013, AMGH Editora Ltda. Todos os direitos reservados.
Na+
(–)
3Na+
CNaE
Na+
ATP
2K+
Maxi-K
PEMR
K+
K+
H2O
AQP-2
AQP-3, 4
H2O
NH3
+
H
NH3
ATP
H+-ATPase
HCO3–
CI–
CI–
K+
NH4+
Dados laboratoriais
3Na+
Na+ 150
ATP
2K+
H+/K+-ATPase
ATP
K+
K+
K+
K+ 3,9
Cl– 114
Gli 95
Alb 3,1
2+
HCO3– 26
BUN 8
Creat 1,7
Ca 8,1
Fosf 2,6
Mg 2
Osm Plasm 315
Urina:
+
Na 34
K+ 5,2
Osm 137
CI–
Lúmen
A-IC
Interstício
Figura e15.1 Transporte de água, sódio, potássio, amônia e prótons nas
células principais (CPs) e nas células intercaladas adjacentes tipo A. A
água é absorvida no gradiente osmótico pelas células principais através da aquaporina-2 (AQP2) apical, assim como pelos canais basolaterais de aquaporina-3 e aquaporina-4. A absorção de sódio através do canal de sódio epitelial (CNaE) sensível à
amilorida gera uma diferença potencial negativa de lúmen que aciona a excreção de
K+ pelo canal secretor apical de potássio, pelo PEMR (canal renal medular externo
de K+) e/ou pelo canal de maxi-K dependente do fluxo. O transporte transepitelial
de amônial (NH3) e o transporte de prótons ocorrem em células intercaladas tipo A
adjacentes através dos canais basolaterais de amônia e das bombas apicais de H+-ATPase, respectivamente. Finalmente, o NH4+ é expelido através da urina em defesa
do pH sistêmico. A secreção eletrogênica de prótons pelas células intercaladas tipo
A também é afetada pela diferença potencial negativa de lúmen gerada pelas células
principais adjacentes, de maneira que as reduções nos gradientes elétricos de lúmen
negativo diminuem a excreção de H+. Além disso, em estados com deficiência de
potássio, as células intercaladas tipo A reabsorvem o K+ filtrado através da H+/K+
ATPase apical.
pecial nos casos em que a descontinuação do agente ofensor não seja
uma opção clínica razoável. A secreção de potássio é estimulada por
taxas mais elevadas de fluxo urinário, pelo aumento na liberação distal de sódio, pela liberação distal de ânions mal reabsorvidos (como o
bicarbonato) e/ou pela administração de diuréticos de alça. Portanto,
no caso deste paciente, a abordagem de tratamento deve incluir a administração intravenosa de NaCl a 0,9% para expandir o fluido extracelular e liberar uma quantidade maior de Na+ e de Cl para o túbulo
coletor cortical. Além disso, a molécula de TMP deve ser protonada
para inibir o canal de sódio epitelial. A alcalinização do túbulo renal
lentifica o efeito do medicamento sobre a secreção tubular distal de
K+. Como alternativa para a indução de bicarbonatúria para facilitar
a secreção de potássio pode-se administrar um inibidor de anidrase
carbônica para induzir um nível significativo de caliurese. Entretanto, no caso que estamos apresentando, para que a acetazolamida seja
eficaz seria necessário, em primeiro lugar, corrigir a acidose metabólica do hiato não aniônico do paciente. Consequentemente, a coadministração intravenosa de bicarbonato de sódio maximizaria o
benefício da acetazolamida. Finalmente, a hiperpotassemia sistêmica
resulta na supressão direta da amoniagênese renal, da secreção de
amônia e, portanto, da excreção ácida. Às vezes, a correção da hiperpotassemia com uma resina de ligação ao potássio (Kayexalate) é
apropriada nesses pacientes. O declínio subsequente na concentração
plasmática de K+ também aumenta a excreção urinária de amônia,
ajudando a corrigir a acidose.
Depois de 3 dias de hidratação intravenosa foi feito um teste de
privação de água. Foi aplicada uma dose única de 2 g IV de desmopressina (DDAVP) às 9 horas (+9):
Dados laboratoriais
Horário (h)
0
+6
+8
+12
+18
Na+
145
148
150
152
149
+
5,4
5,3
3,9
3,9
3,9
-
111
110
118
120
114
HCO3
24
27
25
242
25
Creat
1,3
1,3
1,4
1,3
1,3
Sosmol
300
311
315
Uosmol
132
140
201
237
257
8,4
6,3
K
Cl
-
AVP
■ ABORDAGEM DIAGNÓSTICA
Por que o paciente desenvolveu hipernatremia, poliúria e insuficiência renal aguda? O que o teste de privação de água mostrou? Qual a
fisiopatologia subjacente da síndrome hipernatrêmica deste paciente?
O paciente se tornou poliúrico depois da admissão na UTI com
pneumonia grave e desenvolveu hipernatremia significativa e insuficiência renal aguda. A poliúria pode ter sido causada por diurese osmótica ou por diurese hídrica. A diurese osmótica pode ser
provocada por excreção excessiva de Na+-Cl-, manitol, glicose e/ou
ureia, com eliminação diária de soluto variando entre > 750 a 1000
mosmol/dia (> 15 mosmol/kg de água corporal por dia). Entretanto,
neste caso, o paciente estava eliminando grandes volumes de urina
hipotônica, com osmolalidade urinária substancialmente inferior em
comparação com a do plasma. Por definição, este fato se caracterizava como diurese hídrica, resultando na excreção inadequada de água
livre e em hipernatremia. A resposta apropriada à hipernatremia e a
uma osmolalidade plasmática superior a 295 mosmol/kg é a elevação
no nível de vasopressina (AVP) circulante e a excreção de volumes
baixos (< 500 mL/dia) de concentração urinária máxima, isto é, urina
com osmolalidade acima de 800 mosmol/kg. A resposta deste paciente à hipernatremia foi claramente inadequada por causa da perda de
AVP em circulação [diabetes insípido central (DIC)] ou resistência
renal à AVP [diabetes insípido nefrogênico (DIN)]. A perda de água
livre em curso foi tão grave que resultou em hipovolemia absoluta a
©2013, AMGH Editora Ltda. Todos os direitos reservados.
Desequilíbrios entre Líquidos e Eletrólitos e Desequilíbrios entre Ácido e Base
H+
CAPÍTULO e15
CP
CASO 3
Um homem de 63 anos de idade foi admitido na unidade de tratamento intensivo (UTI) com pneumonia grave por aspiração. O histórico médico anterior incluía esquizofrenia para a qual havia solicitado cuidados institucionais. O tratamento incluía neuroepilépticos
e administração intermitente de lítio, sendo que o uso de lítio havia
sido reiniciado 6 meses antes da admissão. O paciente foi tratado
com antibióticos e intubado por vários dias, com desenvolvimento de
poliúria (3 a 5 litros/dia), hipernatremia e insuficiência renal aguda.
O pico da concentração plasmática de Na+ foi de 156 meq/L e o nível
máximo de creatinina foi de 2,6 mg/dL. A osmolalidade urinária foi
medida uma vez e atingiu 157 mosmol/kg, com uma osmolalidade
plasmática coincidente de 318 mosmol/kg. A administração de lítio
foi interrompida logo após a admissão na UTI.
No exame físico o paciente estava alerta, extubado e com sede. O
peso era de 97,5 kg. O débito urinário nas últimas 24 horas foi de 3,4
litros, com ingestão IV de 2 litros/dia de D5W.
15-3
PARTE II
Principais Manifestações e Apresentações das Doenças
despeito do fato de que aproximadamente dois terços da água eliminada se originaram no compartimento do fluido intracelular (FIC) e
não no compartimento do fluido extracelular (FEC). A hipovolemia
provocou uma queda aguda na taxa de filtração glomerular (TFG),
isto é, insuficiência renal aguda, com melhora gradual depois da hidratação (ver adiante).
Depois da correção da hipernatremia e da insuficiência renal aguda com hidratação adequada (ver abaixo), o paciente foi submetido a
um teste de privação de água seguido pela administração de DDAVP.
Esse teste permite determinar se a causa de diurese hídrica inadequada é DIC ou DIN. O paciente restringiu o uso de água logo no início
da manhã, com monitoramento cuidadoso dos sinais vitais e do débito urinário. A privação de água durante a noite em pacientes com diabetes insípido não é segura e inadequada sob o ponto de vista clínico
por causa do potencial de hipernatremia grave. A concentração plasmática de Na+ – mais precisa e com disponibilização mais imediata do
que a osmolalidade plasmática – foi monitorada em intervalos de uma
hora durante a privação de água. Uma amostra de AVP na linha de
base foi coletada no início do teste; uma segunda amostra foi coletada
depois que o nível de Na+ plasmático atingiu 148 a 150 meq/L. Neste ponto, administramos uma dose única de 2 g do agonista do receptor de vasopressina V2 DDAVP. Uma abordagem alternativa seria
medir a AVP e administrar o DDAVP no momento em que o paciente
se tornou hipernatrêmico pela primeira vez. Entretanto, seria menos
seguro administrar o DDAVP em quadros de danos renais, tendo em
vista que a eliminação desse medicamento depende dos rins.
O resultado do teste de privação de água do paciente foi consistente com DIN, com o nível de AVP dentro da faixa normal no
quadro de hipernatremia (isto é, nenhuma evidência de DIC) e com
um nível de osmolalidade urinária inadequadamente baixo que não
chegou a aumentar em mais de 50%, ou mais de 150 mosmol/kg, depois da privação de água e da administração de DDAVP. Esse defeito
poderia ter sido considerado compatível com DIN “completo”. Embora consigam atingir osmolalidades urinárias de 500 a 600 mosmol/
kg depois do tratamento com DDAVP, os pacientes com “DIN parcial” não conseguem atingir concentrações urinárias máximas de 800
mosmol/kg ou mais.
O diabetes insípido nefrogênico possui inúmeras causas genéticas e adquiridas que compartilham a interferência com alguns aspectos do mecanismo da concentração renal. Por exemplo, a perda de
mutações funcionais no receptor da V2 AVP provoca DIN ligado ao
X. Este paciente era portador de DIN como resultado da terapia com
lítio, talvez a causa mais comum de diabetes insípido nefrogênico
em adultos. O lítio causa DIN através da inibição direta do glicogênio sintase-quinase-3 (GSK3) renal. A quinase é considerada o alvo
farmacológico do lítio em doenças psiquiátricas, sendo que a GSK3
renal é imprescindível para as respostas das células principais à AVP.
Além disso, o lítio induz a expressão da ciclo-oxigenase 2 (COX-2)
na medula renal. A prostaglandina derivada da COX-2 inibe o transporte de sal estimulado pela AVP por meio do ramo espesso ascendente e o transporte de água estimulado pela AVP por meio do ducto
coletor, exacerbando a poliúria associada ao lítio. A entrada do lítio
através do canal de Na+ sensível à amilorida (ENaC) (Figura e15.1)
é necessária para que o medicamento possa fazer efeito nas células
principais. Portanto, a terapia combinada de lítio com amilorida
pode mitigar o DIN associado ao lítio. Todavia, o lítio forma cicatrizes tubulointesticiais e doença renal crônica depois de terapias prolongadas, de maneira que os pacientes podem ter DIN muito tempo
depois de interromper o uso do medicamento, com benefícios terapêuticos reduzidos com o uso de amilorida. Cabe ressaltar que este
paciente havia sido tratado de forma intermitente com lítio durante
vários anos, o que resultou no desenvolvimento de doença renal crônica (creatinina na linha de base: 1,3 a 1,4) e de DIN que persistiram
depois da descontinuação do uso do medicamento.
■ ABORDAGEM DE GERENCIAMENTO
Como este paciente deveria ter sido tratado? Quais são os perigos
latentes principais da terapia?
Este paciente desenvolveu hipernatremia grave devido à diurese
hídrica causada pelo uso de lítio associado ao diabetes insípido na-
15-4
trogênico. O tratamento de hipernatremia deve incluir reposição do
déficit existente de água livre e reposição diária da perda de água livre
em curso. O primeiro passo é calcular o volume de água total do corpo (ATC), tipicamente estimado em 50% do peso corporal para mulheres e em 60% para homens. Consequentemente, o déficit de água
livre poderá ser calculado de acordo com fórmula [(Na+ – 140)/140]
x ATC. Neste paciente o déficit de água livre era de 4,2 litros para o
peso de 97,5 kg e uma concentração plasmática de Na+ de 150 meq/L.
A reposição desse déficit de água livre deveria ser lento no período
de 48 a 72 horas para evitar elevações na concentração plasmática de
Na+ em mais de 10 meq/L durante 24 horas. Um erro comum é repor
esse déficit e não fazer a reposição das perdas de água livre em curso,
de forma que não é possível corrigir a concentração plasmática de
Na+ que, na realidade, aumenta.
As perdas de água livre em curso podem ser estimadas por meio
da equação de eliminação de eletrólitos e água livre:
+
+
onde V é o volume urinário; UNa é o [Na ] urinário; UK é o [K ] urinário; e PNa é o [Na+] plasmático.
Para este paciente em particular o CeH2O era de 2,5 litros por
dia na avaliação inicial, isto é, com concentrações urinárias de Na+ e
K+ de 34 e 5,2 meq/L, e um volume urinário de 3,4 litros. Portanto,
o paciente recebeu 2,5 litros de D5W durante as primeiras 24 horas
para repor as perdas de água livre em curso, juntamente com 2,1 litros de D5W para repor a metade do déficit de água livre. Medições
aleatórias dos eletrólitos urinários e do volume urinário podem ser
utilizadas para monitorar o CeH2O e para fazer ajustes diários na administração de fluidos, durante o acompanhamento da concentração
plasmática do Na+. De maneira geral, os médicos calculam o déficit de água livre para orientar a terapia de hipernatremia, repondo
metade do déficit nas primeiras 24 horas. Essa abordagem pode ser
adequada em pacientes que não tenham perdas correntes significativas de água livre, como, por exemplo, em casos de hipernatremia
causada pela ingestão deficiente de água livre. Este caso ilustra como
as demandas de água livre podem ser grosseiramente subestimadas
em pacientes hipernatrêmicos se as perdas diárias de água livre não
forem levadas em consideração.
CASO 4
Um homem de 78 anos de idade foi admitido com pneumonia e
hiponatremia. A concentração plasmática inicial de Na+ era de 129
meq/L, diminuindo depois de 3 dias para 118 a 120 meq/L, a despeito
da restrição de fluidos para 1 L/dia. Uma TC torácica revelou a presença de uma massa infrahilar direita de 2,8 x 1,6 cm e pneumonia
pós-obstrutiva. O paciente era um fumante inveterado. O histórico
médico anterior indicava um carcinoma laríngeo que havia sido tratado 15 anos antes com radioterapia, um carcinoma de células renais,
doença vascular periférica e hipotireoidismo. Na revisão de sistemas,
o paciente negou a presença de cefaleia, náusea e vômito. Ele sentia
dor crônica no quadril que fora tratada com acetaminofeno e codeína. Outras medicações incluíam cilostazol, amoxilina/clavulanato,
digoxina, diltiazem e tiroxina. O exame revelou que o paciente era
euvolêmico, sem linfadenopatia e o exame do tórax foi normal.
Dados laboratoriais
Na+ 120
K+ 4,3
2+
Cl– 89
HCO3–
BUN 8
Fos 2,8
23
Mg2
Plasma osm 248 mosmol/
kg
Creat 1
Alb 3,1
Ca 8,9
Cortisol
25 g/dL
TSH 2,6
Ácido úrico 2,7 mg/dL
Urina
Na+ 97
K+ 22
Cl– 86
Gli 93
Osm 597
O paciente foi tratado com administração oral de 20 mg de furosemida duas vezes ao dia e com comprimidos de sal. Com essa terapia, a concentração plasmática de Na+ aumentou para 129 meq/L.
©2013, AMGH Editora Ltda. Todos os direitos reservados.
Entretanto, o paciente desenvolveu hipotensão ortostática e tontura.
Ele iniciou o tratamento com demeclociclina, 600 mg por via oral na
parte da manhã e 300 mg à tarde, antes de receber alta hospitalar. A
+
concentração plasmática de Na aumentou para 140 meq/L com um
BUN de 23 e creatinina de 1,4. Nesse ponto, a dose de demeclociclina
foi reduzida para 300 mg por via oral, duas vezes ao dia. Finalmente,
a biópsia broncoscópica confirmou a presença de carcinoma pulmonar de pequenas células. O paciente se recusou a fazer quimioterapia
e foi internado em um hospício.
©2013, AMGH Editora Ltda. Todos os direitos reservados.
Desequilíbrios entre Líquidos e Eletrólitos e Desequilíbrios entre Ácido e Base
CASO 5
Uma mulher com 76 anos de idade apresentou-se com um histórico
de vários meses de diarreia, com agravamento acentuado durante 2 a
3 semanas antes da admissão (até 12 evacuações por dia). A revisão
dos sistemas foi negativa para febre, tontura ortostática, náusea e vômito, e cefaleia. O histórico médico anterior incluía hipertensão, cálculos renais e hipercolesterolemia. As medicações incluíam atenolol,
espironolactona e levastatina. A paciente consumia também mais de
2 litros de líquidos por dia para tratamento de nefrolitíase.
A paciente recebeu 1 litro de solução salina durante as primeiras
5 horas após sua admissão no hospital. O exame realizado depois de
6 horas apresentou os seguintes resultados: frequência cardíaca de 72
na posição sentada e 90 na posição de pé; pressão arterial de 105/90
com a paciente deitada ou de pé. A pressão venosa jugular (PVJ) era
indistinta e não apresentava edemas periféricos. O exame abdominal
revelou que a paciente teve um ligeiro aumento nos sons intestinais,
porém nenhuma sensibilidade no abdome e sem organomegalia.
A concentração plasmática de Na+ na admissão era de 113
meq/L, com creatinina de 2,35 (Quadro e15.1). Depois de 7 horas de
hospitalização a paciente apresentava as seguintes condições: concentração plasmática de Na+ de 120 meq/L, potássio de 5,4 meq/L,
cloreto de 90 meq/L, bicarbonato de 22 meq/L, BUN de 32 mg/dL,
CAPÍTULO e15
■ ABORDAGEM DIAGNÓSTICA E DE GERENCIAMENTO
Quais fatores contribuíram para a hiponatremia deste paciente?
Quais são as opções terapêuticas?
Este paciente desenvolveu hiponatremia no contexto de uma
massa pulmonar central e de pneumonia pós-obstrutiva. Sob o ponto
de vista clínico o paciente era euvolêmico com concentração genero+
sa de Na urinário e baixa concentração plasmática de ácido úrico.
Ele era eutiroideo sem evidências de disfunção hipofisária ou de insuficiência adrenal secundária. A apresentação clínica é consistente com a síndrome da antidiurese inapropriada (SADI). Embora a
pneumonia tenha sido um fator potencial para a SADI, percebemos
+
que houve uma queda na concentração plasmática de Na a despeito
da resposta clínica aos antibióticos. Havia uma suspeita de que este
paciente tinha SADI causada por um carcinoma pulmonar de pequenas células, com uma massa pulmonar central na TC do tórax e um
histórico significativo de tabagismo. Apesar do histórico de câncer
laríngeo e de câncer renal, não havia evidências de recorrência dessas doenças. Essas malignidades não contribuíram para a SADI. Em
última análise, a biópsia da massa pulmonar confirmou o diagnóstico de carcinoma pulmonar de pequenas células, que é responsável
por aproximadamente 75% das malignidades associadas à síndrome
da antidiurese inapropriada. Cerca de 10% de pacientes portadores
+
desse tumor neuroendócrino têm concentração plasmática de Na
inferior a 130 meq/L na apresentação. O paciente não tinha nenhum
outro estímulo “não osmótico” para aumento na AVP, sem medicações associadas à SADI e nível mínimo de dor ou de náusea.
Embora não apresentasse sintomas atribuíveis à hiponatremia, o
paciente foi considerado com risco de agravamento da hiponatremia
causada por SADI grave. A hiponatremia crônica persistente (mais
de 48 horas de duração) resulta em efluxos de osmólitos orgânicos
(creatina, betaína, glutamato, mio-inositol e taurina) provenientes
das células do cérebro. Essa resposta diminui a osmolalidade intracelular e o gradiente osmótico, facilitando a penetração de água. Essa
resposta celular não protege totalmente os pacientes contra os sintomas, que podem incluir vômito, náusea, confusão e convulsões, usu+
almente em concentrações plasmáticas de Na acima de 125 meq/L.
Mesmo pacientes que sejam considerados “assintomáticos” podem
apresentar defeitos sutis na marcha e na cognição que poderão ser
revertidos com correção da hiponatremia. A hiponatremia crônica
aumenta também o perigo de fraturas ósseas por causa do aumento
no risco de quedas e devido à redução na densidade óssea associada.
Portanto, o objetivo de cada tentativa deve ser corrigir com segu+
rança a concentração plasmática de Na em pacientes portadores de
hiponatremia crônica. Isso é particularmente válido em casos SADI
associada a malignidades, nos quais a obtenção de um diagnóstico
tecidual poderá ocorrer em semanas ou meses, assim como a redução
subsequente na AVP depois do início de quimioterapia, radioterapia
e/ou cirurgia.
Quais são as opções terapêuticas para a SADI? Neste paciente, a
privação de água, um dos pilares da terapia para SADI, teve pouco
+
efeito sobre a concentração plasmática de Na . A razão entre urina
+
+
+
e eletrólitos plasmáticos ([Na ] urinário + [K ] / [Na ] plasmático)
pode ser utilizada para estimar a excreção de eletrólitos-água livre e
o grau necessário de restrição de água. A restrição em pacientes com
razão acima de 1 deve ser mais agressiva (< 5 mL/dia); a restrição em
pacientes com razão próxima de 1 deve ficar entre 500 e 700 mL/dia;
e a restrição em pacientes com razão abaixo de 1 deve ser inferior a
1 L/dia. A razão entre urina e eletrólitos plasmáticos deste paciente
era 1 e, como havíamos previsto, não respondia a uma restrição moderada de aproximadamente 1 litro por dia. Teoricamente, uma res-
trição de água mais agressiva teria sido bem sucedida, embora, talvez,
dificilmente os pacientes com SADI tolerem esse nível restritivo por
causa do estímulo inapropriado da sede.
De maneira geral, em casos de SADI, a terapia combinada com
furosemida e comprimidos de sal aumentam a concentração plasmática de Na+. A furosemida diminui a capacidade de concentração
urinária máxima através da inibição do mecanismo contracorrente
e os comprimidos de sal neutralizam a perda de NaCl associada ao
uso de diuréticos. Nem sempre esse regime é bem sucedido e exige
titulações cuidadosas dos comprimidos de sal para evitar a ocorrência de depleções volumétricas. Na realidade, no caso deste paciente,
a concentração plasmática de Na+ permaneceu abaixo de 130 meq/L.
O paciente se tornou ortostático. A demeclocidina, toxina das células
principais, é um agente oral alternativo para SADI. Neste paciente,
o tratamento com demeclocidina foi bem sucedido, aumentando a
concentração plasmática de Na+ para 140 meq/L. Entretanto, a demeclocidina pode ser natriurética, levando a uma redução pré-renal
na taxa de filtração glomerular (TFG). Além disso, a demeclocidina
foi implicada em lesões nefrotóxicas, principalmente em pacientes
com cirrose e doença hepática crônica, nos quais ocorre acúmulo do
medicamento. Este paciente em particular desenvolveu uma redução
significativa, porém estável, na TFG durante a terapia com demeclocidina, sendo que a dose administrada teve de ser reduzida.
Um grande avanço no gerenciamento da hiponatremia foi o desenvolvimento clínico dos antagonistas da vasopressina (vaptans).
Esses agentes inibem o efeito da AVP nos receptores renais V2, resultando na excreção de eletrólitos-água livre e na correção da hiponatremia. Embora tenham sido aprovados pela U.S. Food and Drug
Administration (FDA) para o gerenciamento de hiponatremia euvolêmica e hipervolêmica, as indicações específicas para uso desses
agentes ainda não estão suficientemente claras. Entretanto, é possível
prever que o vaptans irá desempenhar um papel cada vez mais importante no tratamento da SADI e de outras causas de hiponatremia.
Na realidade, se este paciente em particular tivesse continuado com
a terapia ativa para esse câncer, a substituição de demeclocidina por
tolvaptan oral (um vaptan oral específico para V2) teria sido o passo
seguinte mais correto, tendo em vista o desenvolvimento de insuficiência renal com uso daquele medicamento. Assim como ocorre
com outras medidas para corrigir a hiponatremia (solução salina hipertônica, demeclocidina, etc.) os vaptans têm o potencial para fazer
“supercorreções” na concentração plasmática do Na+ (elevações > 8
a 10 meq/L por 24 horas ou 18 meq/L por 18 horas), aumentando,
consequentemente, o risco de desmielinização osmótica (ver o Caso
5). Portanto, não é necessário fazer monitoramento rigoroso da concentração plasmática do Na+ durante a fase inicial das terapias com
esses agentes.
15-5
+
QUADRO e15.1
Dados laboratoriais seriais relativos ao caso 5
Hora hospitalar
Linha de base
0
3
7
11
Na plasmático (meq/L)
123
113
115
120
117
Creat (mg/dL)
1,2
2,35
2,10
2,02
1,97
+
PARTE II
Principais Manifestações e Apresentações das Doenças
15-6
Osmolalidade urinária
(mosmol/kg)
319
+
Na urinário
17
creatinina de 2,02 mg/dL, glicose de 89 mg/dL e albumina de 1,9. O
hematócrito era de 33,9, a contagem de leucócitos era de 7,6 e a contagem de plaquetas era de 405. Pela manhã o cortisol era de 19,5 e
o hormônio estimulante da tireoide (TSH) era de 1,7. O tratamento
da paciente consistia da administração intravenosa de 1 g de DDAVP juntamente com 75 mL/hora IV de solução salina meio normal.
Após a queda da concentração plasmática de Na+ para 116 meq/L, o
fluido intravenoso foi substituído por solução salina normal, com a
mesma taxa de infusão. A Tabela e15.1 apresenta os resultados subsequentes.
■ ABORDAGEM DIAGNÓSTICA
A paciente se apresentou com hiponatremia hipovolêmica e uma
redução “pré-renal” na TFG, com elevação no nível de creatinina
sérica. Ela havia tido diarreia por algum tempo e manifestou taquicardia ortostática depois da administração de 1 litro de solução salina
normal. Como era de se esperar em casos de hiponatremia hipovolêmica, a concentração do Na+ urinário era inferior a 20 meq/L na
ausência de insuficiência cardíaca congestiva ou de outras causas de
hiponatremia “hipervolêmica”. A paciente respondeu à hidratação salina com elevação na concentração plasmática de Na+ e uma redução
no nível de creatinina.
A hipovolemia inicial aumentou a sensibilidade da resposta da
AVP desta paciente à osmolalidade, diminuindo o limite osmótico
para liberação de AVP e aumentando a curva de resposta à osmolalidade. Como a meia-vida da arginina vasopressina é de apenas 10
a 20 minutos, o aumento agudo no volume intravascular depois da
administração intravenosa de 1 litro de solução salina provocou uma
rápida redução na AVP em circulação. A diurese hídrica subsequente
é a explicação primária para a rápida elevação na concentração plasmática de Na+ nas primeiras 7 horas de hospitalização.
■ ABORDAGEM DE GERENCIAMENTO
Neste caso, a preocupação principal era a cronicidade evidente da hiponatremia da paciente, com várias semanas de diarreia seguidas de
2 a 3 dias de exacerbação aguda. Acreditava-se que a paciente tivesse
hiponatremia “crônica”, isto é, com suspeita de duração de mais de
48 horas. Dessa forma, a a paciente estaria predisposta a desmielinização osmótica no caso de se submeter a uma correção muito rápida
na concentração plasmática de Na+, ou seja, mais de 8 a 10 meq/L
em 24 horas ou 18 meq/L em 48 horas. Na apresentação, a paciente
não tinha sintomas que, tipicamente, seriam atribuídos a hiponatremia aguda, e a concentração plasmática de Na+ já havia aumentado
em um nível suficiente para protegê-la contra a ocorrência de edema cerebral. Entretanto, ela havia corrigido 1 meq/L por hora nas
primeiras 7 horas pós-admissão, o que era consistente com correção
excessiva iminente. Para reduzir ou interromper a elevação na concentração plasmática de Na+, a paciente recebeu 1 g IV de DDAVP
juntamente com a administração intravenosa de água livre. À vista da
hipovolemia e da insuficiência renal aguda em fase de resolução, foi
tomada a decisão de administrar solução salina meio normal como
fonte de água livre em vez de D5W. Isso foi substituído por solução
salina normal no momento em que a concentração plasmática de Na+
caiu drasticamente para 117 meq/L (Quadro e15.1).
A correção excessiva de hiponatremia crônica é um fator de risco
importante para o desenvolvimento da síndrome da desmielinização
osmótica (SDO). Estudos realizados em animais mostram benefícios neurológicos e de sobrevida na SDO “abaixando novamente” a
concentração de Na plasmático com
DDAVP e administração de água livre. É possível demonstrar a segurança
14
24
48
72
dessa abordagem em pacientes hipo116
117
124
130
natrêmicos, sem nenhum risco eviden1,79
1,53
1,20
1,13
te de convulsões ou de outras sequelas.
415
397
O uso dessa combinação evita correções excessivas ou novas reduções na
+
concentração plasmática de Na em
23
47
pacientes que já tiveram correção excessiva. A administração de DDAVP
é imprescindível tendo em vista que a
maioria dos níveis de AVP endógena desses pacientes caiu drasticamente, resultando em diurese hídrica livre. Somente a administração
de água livre exerce efeito mínimo nesse tipo de quadro por causa da
ausência relativa de AVP em circulação.
+
A concentração plasmática de Na da paciente permaneceu baixa
por vários dias depois da administração de DDAVP. Possivelmente, a
hiponatremia hipovolêmica atenuou a recuperação da concentração
+
plasmática de Na . Como alternativa, a recuperação atenuada talvez
tenha sido resultado dos efeitos permanentes da dose única de DDAVP. Cabe observar que, embora a meia-vida plasmática do DDAVP
seja de apenas 1 a 2 horas, os estudos farmacodinâmicos indicam
efeitos muito mais prolongados no débito urinário e/ou na osmolalidade urinária. Uma consideração final é o efeito da disfunção renal
inicial da paciente sobre a farmacocinética e a farmacodinâmica do
DDAVP administrado, que é eliminado pelas vias renais. O DDAVP
deve ser administrado com muita cautela para reindução de hiponatremia em pacientes portadores de doença renal crônica ou de disfunção renal aguda.
CASO 6
Uma mulher de 44 anos de idade havia sido encaminhada por um
hospital local depois de apresentar-se com paralisia flácida. Hipocalemia grave (2,0 meq/L) fez parte da documentação, ensejando o
início de uma infusão contendo KCl.
Dados laboratoriais
Valor
Unidades
Na
140
meq/L
+
2,6
meq/L
Cl
115
meq/L
Bicarbonato
15
meq/L
Hiato aniônico
10
meq/L
BUN
22
mg/dL
Creat
1,4
mg/dL
pH
7,32
U
PaCO2
30
mmHg
15
meq/L
+
K
Gases no sangue arterial
⫺
HCO3
Os dados laboratoriais complementares foram os seguintes: fator
reumatoide positivo, anti-Ro/SS-A e anti-La/SS positivo. O exame de
urina revelou um pH de 6,0, sedimento normal sem cilindros leucocitários ou eritrocitários e sem bactérias. A razão entre proteína
urinária e creatinina era de 0,150 g/g. Os valores dos eletrólitos uri+
+
–
nários eram Na = 35, K = 40 e Cl = 18 meq/L. Portanto, o hiato
aniônico urinário era positivo, indicando baixo nível de excreção de
+
NH4 através da urina.
■ ABORDAGEM DIAGNÓSTICA
Neste caso, o diagnóstico mais preciso é de acidose tubular renal
distal hipocalêmica clássica causada pela síndrome de Sjögren. Este
paciente apresentou-se com acidose metabólica sem hiato aniônico.
O hiato aniônico da urina era positivo, indicando excreção anormal-
©2013, AMGH Editora Ltda. Todos os direitos reservados.
CASO 7
Um homem de 32 anos de idade foi admitido no hospital com fraqueza e hipocalemia. O paciente era uma pessoa saudável até 2 meses
antes, quando começou a desenvolver fraqueza intermitente nas pernas. A revisão de sistemas foi negativa. Ele negava abuso de drogas e
de laxantes e não estava tomando nenhuma medicação. Nada constava no histórico médico anterior e não havia histórico de doença
neuromuscular. Na história familiar constava uma irmã portadora de
doença tireoidea. O exame físico revelou apenas redução dos reflexos
tendinosos profundos.
Dados laboratoriais
Admissão
Linha de base
Na
139
143
meq/L
+
2,0
3,8
meq/L
-
105
107
meq/L
+
K
Cl
Unidades
Admissão
Linha de base
Unidades
Bicarbonato
26
29
meq/L
BUN
11
16
mg/dL
Creat
0,6
1,0
mg/dL
Ca
2+
8,8
8,8
mg/dL
Fosfato
1,2
mg/dL
Albumina
3,8
mg/dL
Osmolalidade
plasmática
290
mosmol/kg
Osmolalidade urinária
590
mosmol/kg
+
K urinário
10
meq/L
TSH UI/L (normal: 0,2 a 5,39)
T4 livre 41 pmol/L (normal: 10 a 27)
■ ABORDAGEM DIAGNÓSTICA
O paciente desenvolveu hipocalemia devido à redistribuição de
potássio entre os compartimentos intracelular e extracelular. Essa
fisiopatologia se tornou imediatamente aparente depois do cálculo
do gradiente transtubular de potássio (GTTP). O GTTP é calculado com base na seguinte fórmula: (Posmol x Upotássio) / Ppotássio x Uosmol).
Os valores esperados para o GTTP são inferiores a 3 na presença de
hipocalemia e maiores do que 7 e 8 na presença de hiperpotassemia
(ver os casos 2 e 8). Neste caso, o GTTP calculado de 2,5 era consistente com a conservação renal adequada de K+ e com uma causa
não renal para hipocalemia. Na ausência de perdas gastrointestinais
significativas de K+, o diagnóstico do paciente foi de um tipo “redistributivo” de hipocalemia.
Mais de 98% do potássio total do corpo é intracelular. O tamponamento regulado do K+ extracelular por este grande acúmulo intracelular desempenha um papel importante na manutenção de concentrações plasmáticas estáveis de K+. Sob o ponto de vista clínico,
alterações na troca e na distribuição de K+ intra e extracelular podem
provocar hipo ou hiperpotassemia significativas. Insulina, atividade
adrenérgica 2, hormônio da tireoide e alcalose promovem a reabsorção celular de K+ por meio de vários mecanismos interrelacionados, levando à hipocalemia. Em particular, alterações na atividade
do sistema nervoso simpático endógeno podem causar hipocalemia
em vários quadros, incluindo abstinência de álcool, hipertireoidismo,
infarto agudo do miocárdio e lesão cerebral grave.
A fraqueza é comum em casos de hipocalemia grave. A hipocalemia provoca hiperpolarização muscular, alterando a capacidade
de despolarização e de contração. Neste paciente, a doença de Graves resultou em hipertireoidismo e paralisia hipocalêmica (paralisia
tirotóxica periódica [PTP]). Esse tipo de paralisia desenvolve com
mais frequência em pacientes de origem asiática ou hispânica. Essa
predisposição foi relacionada a variações genéticas no gene Kir2.6,
um canal de K+ induzido pelo hormônio da tireoide específico para
os músculos. Entretanto, os mecanismos patofisiológicos que ligam a
disfunção desse canal iônico à PTP ainda não foram esclarecidos. A
PTP nos casos de hipocalemia é atribuída à ativação direta e indireta
de Na+, K+-ATPase pelo hormônio da tireoide, resultando no aumento da reabsorção de K+ pelos músculos e por outros tecidos. O hormônio da tireoide induz a expressão de várias subunidades de Na+,
K+-ATPase nos músculos esqueléticos, aumentando a capacidade de
reabsorção de K+. Acredita-se também que aumentos hipertireoideos
na atividade beta-adrenérgica desempenha papel importante na PTP.
Sob o ponto de vista clínico, os pacientes com PTP se apresentam com fraqueza nas extremidades e cíngulo nos membros, com
episódios paralíticos que ocorrem com mais frequência entre 1 da
madrugada e 6 horas da manhã. Os agentes que precipitam a fraqueza incluem cargas elevadas de carboidratos e exercícios estrênuos. Os
sinais e sintomas de hipertireoidismo nem sempre estão presentes e
com frequência atrasam o diagnóstico. De maneira geral, a hipocalemia é profunda e, com frequência, é acompanhada de hipofosfate-
©2013, AMGH Editora Ltda. Todos os direitos reservados.
Desequilíbrios entre Líquidos e Eletrólitos e Desequilíbrios entre Ácido e Base
■ ABORDAGEM DE GERENCIAMENTO
Ainda não existe prognóstico renal de longo prazo para pacientes
com ATRd clássica causada pela síndrome de Sjögren. Não obstante,
a acidose metabólica e a hipocalemia respondem à reposição alcalina
com solução de citrato de sódio (solução de Shohl) ou com comprimidos de bicarbonato de sódio. Obviamente, no início, é necessário
repor o déficit de potássio, embora, usualmente, a reposição potássica não seja mandatória no longo prazo em pacientes com ATRd
levando-se em consideração que a terapia com bicarbonato de sódio
(ou citrato) expande o volume e corrige o hiperaldosteronismo secundário. Uma das consequências do infiltrado intersticial observada
em pacientes portadores da síndrome de Sjögren e da ATRd clássica
é a progressão de doenças renais crônicas. A terapia citotóxica + glicocorticoides tem sido a base terapêutica para a síndrome de Sjögren
por muitos anos, embora as infiltrações de linfócitos B nos tecidos
das glândulas salivares sejam atenuantes e a acidificação urinária melhore depois do tratamento com rituximab.
Dados laboratoriais
CAPÍTULO e15
mente baixa de amônia em face de acidose sistêmica. O pH da urina
era inapropriadamente alcalino, embora não houvesse nenhuma evidência de hipercalciúria, nefrocalcinose ou doença óssea. Subsequentemente o paciente apresentou hiperglobulinemia. Essas descobertas,
consideradas em conjunto, indicam que a causa da hipocalemia e da
acidose metabólica sem hiato aniônico era uma anormalidade tubular renal. A hipocalemia e a excreção anormalmente baixa de amônia,
de acordo com estimativa feita com base no hiato aniônico da urina,
na ausência de glicosúria, fosfatúria ou aminoacidúria (síndrome
de Fanconi), define a entidade clássica acidose tubular renal distal
(ATRd), também conhecida como ATR tipo 1. Por causa da hiperglobulinemia foi necessário obter serologia adicional para produzir evidências para o diagnóstico de síndrome primária de Sjögren. Além
disso, o histórico complementar indicou um histórico de 5 anos de
xerostomia e de ceratoconjuntivite seca, porém sem sinovite, artrite
ou erupções cutâneas.
Com frequência, a ATRd clássica ocorre em pacientes com
síndrome de Sjögren, como resultado de ataques imunológicos no
túbulo coletor, provocando insuficiência de H+-ATPase nas células
intercaladas tipo A. A síndrome de Sjögren é uma das causas adquiridas mais bem documentadas da ATRd clássica. A perda da função
da H+-ATPase ocorre também com determinadas formas herdadas
de ATRd clássica. Neste caso, não havia história familiar, sendo que
outros membros da família não chegaram a ser afetados. Uma determinada quantidade de autoanticorpos foi associada à síndrome de
Sjögren, sendo provável que esses autoanticorpos impeçam o trânsito
ou a função da H+-ATPase nas células intercaladas tipo A do túbulo
coletor. Embora muito menos comuns, há também relatos de ATR
proximal em pacientes portadores da síndrome de Sjögren, não tendo sido encontrada no caso deste paciente nenhuma característica de
disfunção no túbulo proximal (síndrome de Fanconi). A hipocalemia
é o resultado de hiperaldosteronismo secundário causado por depleção de volume.
15-7
mia redistributiva, a exemplo do que ocorre neste caso. Gradientes
transtubulares de potássio inferiores a 2-3 separam os pacientes com
PTP de pacientes com hipocalemia devido à perda renal de potássio,
que têm valores de GTTP acima de 4. Essa distinção é extremamente
importante para a terapia. Pacientes com grandes déficits de potássio
exigem reposição agressiva com K+-Cl-, que aumenta o risco de hiperpotassemia de rebote em casos de paralisia tirotóxica periódica e
de distúrbios relacionados.
PARTE II
Principais Manifestações e Apresentações das Doenças
■ ABORDAGEM DE GERENCIAMENTO
Em última análise, a terapia definitiva para PTP exige tratamento do
hipertireoidismo associado. Entretanto, no curto prazo, a reposição
de potássio é necessária para agilizar a recuperação muscular e evitar
arritmias cardíacas. O tempo médio de recuperação de ataques agudos é reduzido pela metade em pacientes tratados com administração
intravenosa de K+-Cl– a uma taxa de 10 meq por hora. Entretanto, isso
incorre em um risco significativo de hiperpotassemia de rebote, sendo
que até 70% dos pacientes desenvolvem concentrações plasmáticas de
K+ acima de 5,0 meq/L. Esse potencial para hiperpotassemia de rebote
é um problema geral no gerenciamento de todas as causas de hipocalemia “redistributiva”, resultando na necessidade de fazer uma distinção
precisa e rápida entre esses pacientes e aqueles com grandes déficits de
K+ devido às perdas renais ou extrarrenais de potássio. Uma das alternativas atraentes para reposição de K+-Cl– é o tratamento com doses
elevadas de propranolol (3 mg/kg), que reverte rapidamente a hipocalemia associada e a paralisia. Cabe ressaltar que a hiperpotassemia de
rebote não está associada a esse tipo de tratamento.
CASO 8
Um homem de 66 anos de idade foi admitido no hospital com concentração plasmática de K+ de 1,7 meq/L e em estado profundo de
fraqueza. Este paciente havia percebido a presença de fraqueza progressiva durante vários dias, até o ponto em que não conseguia levantar-se da cama. O histórico médico anterior indicava carcinoma
pulmonar de pequenas células com metástases para o cérebro, fígado
e adrenais. O paciente havia sido tratado com um ciclo de cisplatina/
etoposida 1 ano antes da admissão, cujo estado fora complicado por
uma lesão renal aguda (pico de creatinina de 5 mg/dL, com doença
renal crônica residual), e com três ciclos subsequentes de ciclofosfamida/doxorubicina/vincristina, além de 15 tratamentos com radiação em todo o cérebro.
Depois de 2 meses
Dados laboratoriais
PTA
Admissão
HD2
Unidades
Na+
143
149
144
meq/L
+
3,7
1,7
3,5
meq/L
Cl
-
103
84
96
meq/L
Bicarbonato
26
44
34
K
pH venoso
7,47
PCO2 venoso
62
mmHg
BUN
21
412
40
mg/dL
Creat
2,8
2,9
2,3
mg/dL
2+
1,3
1,6
2,4
mg/dL
Mg
CPK
15-8
meq/L
pH
183
UI/L
ALT
8
75
Albumina
3,4
2,8
2,3
18
Hiato aniônico ajustado
15
24
Bilirrubina total
0,65
5,19
Fosfatase alcalina
93
217
UI/L
mg/dL
UI/L
+
Na urinário
35
28
meq/L
+
Ka urinário
25
49
meq/L
Cloreto urinário
48
51
meq/L
Osmolalidade urinária
391
mosmol/kg
Dados laboratoriais
PTA
Admissão
Osmolalidade plasmática
312
pH da urina
5,5
HD2
Unidades
mosmol/kg
ACTH plasmático
185
pg/mL (7 a 50 pg/mL)
Cortisol plasmático
94
pg/mL (3 a 16 pg/mL)
Cortisol urinário de 24
horas
1044
g/mL (4 a 50
g/24 h)
No exame físico o paciente apresentou icterícia. A pressão arterial (PA) era de 130/70, aumentando para 160/98 depois da administração de 1 litro de solução salina, com pressão venosa jugular (PVJ)
de 8 cm. A fraqueza muscular era generalizada.
O curso hospitalar do paciente foi complicado por insuficiência
respiratória aguda que foi atribuída a embolia pulmonar. O paciente
faleceu 2 semanas depois da admissão.
■ ABORDAGEM DIAGNÓSTICA
Por que este paciente era hipocalêmico? Por que estava tão fraco? Por
que teve alcalose?
Este paciente era portador de um carcinoma pulmonar metastático de pequenas células que permanecia persistente depois de várias
aplicações de quimioterapia e de radioterapia. O paciente se apresentou com hipocalemia profunda, alcalose, hipertensão, fraqueza grave,
icterícia e testes da função hepática piores.
No que diz respeito à hipocalemia, não havia causas evidentes
de perda não renal de potássio, isto é, de diarreia. O gradiente transtubular de potássio (GTTP) urinário era de 11,7 com concentração
plasmática de sódio de 1,7 meq/L. Este valor do GTTP é consistente com secreção inadequada de K+ renal, a despeito do estado grave
de hipocalemia. O GTTP é calculado com base na seguinte fórmula:
(Posmol x Upotássio) / Ppotássio x Uosmol). Os valores esperados para o GTTP
são menores que 3 na presença de hipocalemia e acima 7 a 8 na presença de hiperpotassemia (ver os Casos 2 e 6).
Havia várias explicações para a perda renal excessiva de potássio.
Em primeiro lugar, o paciente havia tido um histórico de lesão renal
aguda associada à cisplatina e de doença hepática crônica residual. A
cisplatina pode causar defeitos tubulares renais persistentes, com hipocalemia proeminente e hipomagnesemia. Entretanto, este paciente
não havia necessitado previamente de reposição de potássio ou de
magnésio, indicando que os defeitos tubulares renais associados à
cisplatina não desempenhavam papel importante na apresentação
com hipocalemia grave. Em segundo lugar, o paciente era hipomagnesêmico na apresentação, sugerindo depleção total de magnésio no
corpo. A depleção de magnésio tem efeitos inibidores sobre a atividade muscular N+,K+-ATPase, reduzindo o influxo para as células musculares, provocando um aumento secundário na excreção de K+. A
depleção de magnésio aumenta também a secreção de K+ pelo néfron
distal. Esse fato é atribuído a uma redução no bloqueio intracelular
do efluxo de K+ dependente de magnésio através do canal secretor
de potássio das células principais [canal de potássio medular externo
renal (PMER)] (Figura e15.1). Sob o ponto de vista clínico, os pacientes hipomagnesêmicos são refratários à reposição de K+, na ausência
de hipervolemia por magnésio. Entretanto, novamente, este paciente não havia desenvolvido previamente hipocalemia significativa, a
despeito da hipomagnesemia periódica e, consequentemente, outros
fatores devem ter causado a hipocalemia grave.
Neste caso, a hipertensão associada sugeria aumento na atividade
mineralocorticoide provocando intensificação na atividade dos canais de CNaE nas células principais, retenção de NaCl, hipertensão e
hipocalemia. O aumento no transporte de Na+ mediado pelo CNaE
nas células principais teria resultado em um aumento na diferença de
potencial do lúmen negativo no túbulo conector e no ducto coletor
cortical, estimulando um acréscimo na secreção de K+ através dos
canais potássicos apicais (Figura e15.1). Essa explicação é compatível
com gradientes transtubulares de potássio (GTTP) extremamente
elevados, isto é, aumentos na excreção de K+ incompatíveis com as
concentrações plasmáticas de potássio.
©2013, AMGH Editora Ltda. Todos os direitos reservados.
Na
K
NCC
ENaC
PMER
+
Aldo
+
Cortisol
+
+
+
Receptor ML
+
11HSD2
Cortisona
K CI
CI
K
K Na
Figura e15.2 11-hidroxiesteroide desidrogenase-2 e síndromes de excesso
aparente de mineralocorticoides. A enzima 11-hidroxiesteroide desidrogenase-2
(11HSD-2) protege as células no néfron distal sensível à aldosterona [túbulo convoluto distal (TCD) e túbulo conector (TCN) e o ducto coletor] contra ativações ilícitas
dos receptores de mineralocorticoides (RML) pelo cortisol. A ligação da aldosterona
ao RML provoca a ativação do cotransportador de Na+-Cl– sensível às tiazidas nas
células do TCD e do canal de sódio epitelial (ENaC) sensíveis às amiloridas nas células principais (TCN e ducto coletor). A aldosterona ativa também a Na+,K+-ATPase
basolateral e, em menor extensão, o canal secretor apical de K+ (canal de potássio
medular externo renal [PMER]). No que diz respeito aos RMLs, o cortisol possui afinidade equivalente à da aldosterona. O metabolismo do cortisol em comparação
com o metabolismo da cortisona, que não tem nenhuma afinidade com o RML, impede a ativação dessas células pelo cortisol em circulação. A deficiência genética da
11HSD-2, ou a inibição de sua atividade, provoca a síndrome do excesso aparente
de mineralocorticoides (ver o Caso 8).
Desequilíbrios entre Líquidos e Eletrólitos e Desequilíbrios entre Ácido e Base
CI Na
tensão. A atividade da enzima 11-hidroxiesteroide desidrogenase-2
(11HSD-2) renal é reduzida em pacientes com ACTH ectópico, em
comparação com a síndrome de Cushing, resultando em uma síndrome do excesso aparente de mineralocorticoides. A teoria predominante é que a produção muito maior de cortisol nas síndromes de
ACTH ectópico supera a enzima 11HSD-2 renal, resultando na ativação de RMLs renais por cortisol não metabolizado (Figura e15.2).
Por que o paciente estava tão enfraquecido? O paciente sentia uma
fraqueza profunda devido ao efeito combinado de hipocalemia e da
elevação no nível de cortisol. A hipocalemia provoca hiperpolarização
muscular, alterando a capacidade de despolarização e de contração.
Com frequência, o estado de fraqueza, e mesmo a paralisia ascendente,
pode complicar estados graves de hipocalemia. Além disso, a hipocalemia provoca miopatia e predispõe para rabdomiólise. Entretanto, o
nível de creatina fosfoquinase (CPK) do paciente era normal. De maneira geral, a síndrome de Cushing é acompanhada de miopatia proximal devido aos efeitos das perdas proteicas do excesso de cortisol.
O paciente se apresentou com um distúrbio misto de ácido-base, com alcalose metabólica significativa e uma concentração de
bicarbonato de 44 meq/L. Logo após a apresentação, foi retirada uma
amostra de gás sanguíneo venoso. Os gases sanguíneos venosos e arteriais apresentam um nível elevado de conformidade em pacientes
com estabilidade hemodinâmica. Isso permite interpretar os distúrbios entre ácido e base de acordo com o resultado do teste de avaliação dos gases no sangue. Em resposta a essa alcalose metabólica,
o PCO2 deveria ter aumentado em 0,75 mmHg para cada 1 meq/L de
aumento no nível de bicarbonato; o nível aproximado esperado do
PCO2 deveria ter sido de 55 mmHg. Em face de um PCO2 de 62 mmHg,
o paciente teve uma acidose respiratória adicional, provavelmente
causada pela fraqueza dos músculos respiratórios decorrente de hipocalemia aguda e de hipercortisolismo subagudo.
O hiato aniônico do paciente, ajustado pela albumina, era 21 +
[(4 – 2,8) ⫻ 2,5] = 24. Esse valor sugere a presença de um terceiro
distúrbio entre ácido e base: a acidose causada pelo hiato aniônico.
Cabe ressaltar que o hiato aniônico medido poderá aumentar em casos de alcalose como resultado do aumento nas concentrações plasmáticas de proteínas (em alcalose hipovolêmica) e do aumento associado à alcalemia na carga negativa líquida de proteínas plasmáticas,
com ambos aumentando os “ânions não medidos”. Entretanto, este
paciente não apresentava depleção volumétrica nem era particularmente alcalêmico, sugerindo que a importância desses defeitos era
mínima no hiato aniônico aumentado. A alcalose estimulava também o aumento na produção de ácido láctico devido à ativação da
fosfofructoquinase e da glicólise acelerada. Entretanto, infelizmente,
neste paciente, o nível de ácido láctico no chegou a ser medido. Nesse
aspecto, é importante observar que, tipicamente, a alcalose eleva os
níveis de ácido láctico em 1,5 a 3 meq/L e que o paciente não era
significativamente alcalêmico. Seja qual for a patologia subjacente,
provavelmente o aumento no hiato aniônico estava relacionado à
alcalose metabólica tendo em vista o fato de que o hiato aniônico
diminuiu para 18 no segundo dia de hospitalização.coincidindo com
a redução no nível de bicarbonato plasmático.
Por que o paciente teve alcalose metabólica? A ativação dos receptores de mineralocorticoides no néfron distal aumenta a acidez
nefrônica distal e a secreção ácida líquida. Como consequência, o
excesso de mineralocorticoides provoca alcalose metabólica resistente a soluções salinas, que é exacerbada significativamente pelo
desenvolvimento da hipocalemia. A hipocalemia desempenha papel
importante na geração da maioria das formas de alcalose metabólica, estimulando a produção tubular proximal de amônia, a reabsorção tubular proximal de bicarbonato e a atividade tubular distal de
H+,K+-ATPase.
CAPÍTULO e15
O que provocou o aumento na atividade mineralocorticoide
deste paciente? O paciente possuía metástases adrenais bilaterais, indicando a presença improvável de hiperaldosteronismo primário. A
apresentação clínica (hipocalemia, hipertensão e alcalose) e o histórico de carcinoma pulmonar de pequenas células (CPPC) sugeriam
síndrome de Cushing, com aumento massivo na circulação de glicocorticoides, em resposta à secreção do hormônio adrenocorticotrópico (ACTH) pelo tumor do CPCP. A confirmação desse diagnóstico
foi feita pelo nível muito elevado de cortisol plasmático, pelo nível
elevado de ACTH e pelo aumento no nível de cortisol urinário (ver
os dados laboratoriais anteriormente).
Por que um aumento no cortisol em circulação provocaria uma
elevação aparente no nível da atividade mineralocorticoide? O cortisol e a aldosterona possuem a mesma afinidade em relação ao receptor de mineralocorticoides (RML), de forma que o cortisol possui
atividade “semelhante à dos mineralocorticoides”. Entretanto, as células do néfron distal sensível à aldosterona [túbulo convoluto distal
(TCD) e ducto coletor] são protegidas contra o cortisol em circulação
pela enzima 11-hidroxiesteroide desidrogenase-2 (11HSD-2) que
converte o cortisol em cortisona (Fig. e15.2). A afinidade da cortisona com o receptor de mineralocorticoides (RML) é mínima. A ativação do RML ativa a Na+,K+-ATPase basolateral, o cotransportador
de Na+-Cl– sensível às tiazidas no TCD e os canais apicais de ENaC
nas células principais, e o ducto coletor (Figura e15.2). As mutações
recessivas de perda de função no gene da enzima 11HSD-2 levam
à ativação dependente de cortisol do RML e à síndrome do excesso
aparente de mineralocorticoides (SEAM), que consiste de hipertensão, hipocalemia e alcalose metabólica, supressão da atividade da renina plasmática (ARP) e supressão da aldosterona. Uma síndrome
semelhante é causada pela inibição bioquímica da enzima 11HSD-2
(pelo ácido glicirretínico/glicirrizínico encontrado no alcaçuz, por
exemplo) e/ou pela carbenoxolona.
Na síndrome de Cushing causada por elevações no nível do
ACTH hipofisário, a incidência de hipocalemia é apenas de 10%, ao
passo que é de aproximadamente 70% em pacientes com secreção ectópica de ACTH, a despeito de uma incidência semelhante de hiper-
■ ABORDAGEM DE GERENCIAMENTO
A primeira prioridade no gerenciamento deste paciente foi aumentar rapidamente as concentrações plasmáticas de K+ e de magnésio.
Os pacientes hipomagnesêmicos são refratários às reposições de K+
isoladamente, sendo que é necessário fazer a correção imediata da
hipomagnesemia. Isso foi feito com administração oral e intravenosa
de K+-Cl-, com um total de 240 meq nas primeiras 18 horas e admi-
©2013, AMGH Editora Ltda. Todos os direitos reservados.
15-9
PARTE II
Principais Manifestações e Apresentações das Doenças
nistração intravenosa de 5 gramas de sulfato de magnésio. A infusão de várias “minibolsas” de 100 mL contendo 20 meq cada uma
permitiu fazer o monitoramento cardíaco e medições frequentes dos
eletrólitos plasmáticos. Cabe ressaltar que o K+-Cl– intravenoso deveria sempre ser administrado em soluções salinas, tendo em vista que
as soluções contendo dextrose podem elevar os níveis insulínicos e
exacerbar a hipocalemia.
Este caso ilustra a dificuldade para prever déficits corporais totais de K+ em pacientes hipocalêmicos. Na ausência de redistribuição anormal de K+ o déficit total se correlaciona com a concentração
plasmática de potássio, que cai em aproximadamente 0,27 mM para
cada redução de 100 mmol nos estoques totais do corpo. No caso
deste paciente, esse fato poderia sugerir um déficit de –650 meq de
K+ na concentração plasmática de potássio de 1,7 meq/L por ocasião da admissão. Entretanto, é importante observar que a alcalemia
induz um modesto deslocamento intracelular do K+ em circulação,
de maneira que a concentração plasmática de potássio inicial deste
paciente não era um indicador ideal do déficit total de potássio. Neste caso, seja qual for a fisiopatologia subjacente, o monitoramento
rigoroso da concentração plasmática de potássio é sempre essencial
durante a correção de hipocalemia grave para medir a adequação da
hipervolemia e evitar correções excessivas.
O gerenciamento subsequente da síndrome de Cushing e da
secreção ectópica de ACTH deste paciente foi complicado por problemas respiratórios. Esse tipo de prognóstico em pacientes com
secreção ectópica de ACTH depende da histologia tumoral e da presença ou da ausência de metástases distantes. Excepcionalmente, este
paciente apresentou um mau prognóstico com carcinoma pulmonar
de pequenas células amplamente metastático cujo tratamento não
foi bem sucedido. Outros pacientes com secreção ectópica de ACTH
causada por tumores isolados mais benignos, em geral tumores carcinoides brônquicos, apresentam melhores prognósticos. Na ausência
de ressecções cirúrgicas bem sucedidas do tumor causativo, o gerenciamento dessa síndrome inclui adrenalectomia cirúrgica ou terapia
médica para bloquear a produção de esteroides adrenais.
CASO 9
Um homem de 22 anos de idade com estupor foi admitido com histórico de comportamento estranho. Seus amigos informaram que ele
havia passado por problemas emocionais recentes decorrentes de um
relacionamento mal sucedido e que havia ameaçado cometer suicídio. Embora houvesse um histórico de abuso de bebidas alcoólicas,
seus amigos desconheciam o consumo recente de álcool. A obnubilação do paciente na admissão não revelou a presença de déficits neurológicos focais evidentes. O restante do exame físico não mostrou
nada excepcional.
Dados laboratoriais
Na+
140
meq/L
5
meq/L
95
meq/L
HCO3
10
meq/L
Glicose
125
mg/dL
BUN
15
mg/dL
Creat
0,9
mg/dL
2+
Ca ionizado
4,0
mg/dL
Osmolalidade plasmática
325
mosmol kg/H2O
+
K
-
Cl
-
O exame de urina revelou a presença de cristalúria, com uma
mistura de cristais com forma de envelopes e de agulhas.
■ ABORDAGEM DIAGNÓSTICA
Este paciente apresentou-se com manifestações no SNC e com histórico de comportamento suspeito, sugerindo ingestão de alguma
toxina. O nível elevado do hiato aniônico de 35 meq/L era assustador.
15-10
O ⌬HA de 25 excedia de forma significativa o ⌬HCO3– de 15. O fato
de que os valores de delta sejam significativamente distintos indica
que o diagnóstico ácido-base mais provável neste paciente seja um
misto de acidose metabólica com hiato aniônico elevado e alcalose
metabólica. Neste caso, a alcalose metabólica pode ter sido resultado
de vômitos. Não obstante, a descoberta mais útil é que o hiato osmolar era elevado. O hiato osmolar de 33 (diferença entre a osmolalidade medida e a osmolidade calculada ou 325 – 292) em face de uma
acidose metabólica com hiato elevado é diagnóstico de metabólitos
osmoticamente ativos no plasma. Diferenças acima de 10 mosmol/kg
indicam concentrações significativas de osmólitos não medidos. Os
exemplos de osmólitos tóxicos incluem etileno glicol, dietileno glicol,
metanol e propileno glicol.
Vários avisos de alerta se aplicam na interpretação dos hiatos
aniônicos e osmolares no diagnóstico diferencial de ingestões tóxicas de álcool. Em primeiro lugar, os osmólitos neutros não medidos
também podem se acumular na acidose láctica e na cetoacidose alcoólica, isto é, hiatos osmolares elevados não são específicos de acidoses com hiato aniônico associadas a ingestões tóxicas de álcool. Em
segundo lugar, os pacientes podem se apresentar com metabolização
extensiva das toxinas ingeridas, com hiato osmolar inexpressivo, porém com um grande hiato aniônico, ou seja, a ausência de um hiato
osmolar elevado não exclui a ingestão tóxica de álcool. Em terceiro
lugar, o inverso pode ser observado em pacientes que se apresentam
logo após a ingestão da toxina, isto é, um grande hiato osmolar com
elevação mínima do hiato aniônico. Finalmente, os médicos deveriam ter consciência do efeito da coingestão de etanol, que por si
mesma poderá elevar o hiato osmolar e reduzir o metabolismo dos
álcoois tóxicos por meio da inibição competitiva através da álcool
desidrogenase (ver abaixo), atenuando, consequentemente, a elevação esperada no hiato aniônico.
Usualmente, o etileno glicol é comercializado como anticongelante ou solvente e pode ser ingerido por acidente ou em tentativas de suicídio. O metabolismo do etileno glicol através da álcool
desidrogenase gera ácidos como o glicoaldeído, o ácido glicólico e o
ácido oxálico. Os efeitos iniciais da intoxicação no SNC, nos estágios
mais precoces, imitam inebriação, embora possam progredir rapidamente para coma totalmente desenvolvido. Atrasos no tratamento
são as causas mais comuns de mortalidade com envenenamento tóxico por álcool. Os rins mostram evidências de lesão tubular aguda
com deposição generalizada de cristais de oxalato de cálcio dentro
das células epiteliais tubulares. A presença de edemas cerebrais é comum, assim como a deposição de cristais no cérebro. A deposição de
cristais é irreversível.
A ocorrência simultânea de cristalúria é típica em casos de intoxicação por etileno glicol. Tanto os cristais de oxalato de cálcio de
monohidrato em forma de agulha como de monohidrato em forma
de envelope são observados na urina durante a evolução do processo. O oxalato em circulação também pode criar situações complexas com o cálcio plasmático, reduzindo o nível de cálcio ionizado, a
exemplo do que ocorre neste caso.
A intoxicação por etileno glicol deve ser verificada pela medição
de seus níveis. Entretanto, é importante iniciar a terapia imediatamente nesse quadro com risco de vida. Embora a terapia possa ser
iniciada com um determinado grau de confiança no caso de ingestões conhecidas ou observadas, raramente esse tipo de histórico está
à disposição do médico. Consequentemente, a terapia deverá se iniciada em pacientes com acidose metabólica grave e hiatos aniônicos e
osmolares elevados. Outras características diagnósticas, como hipocalcemia e insuficiência renal aguda com cristalúria, podem produzir
confirmações importantes para as terapias empíricas de urgência.
■ ABORDAGEM DE GERENCIAMENTO
Levando-se em consideração que todos os quatro álcoois tóxicos osmoticamente ativos – etileno glicol, dietileno glicol, metanol e propileno glicol – são metabolizados através da álcool desidrogenase
gerando produtos tóxicos, a inibição competitiva dessa importante
enzima é comum no tratamento de todas os quatro tipos de intoxicação. Nessas circunstâncias, o fomepizol (4-metil-pirazol) é o inibidor
mais potente da álcool desidrogenase e o medicamento de escolha.
©2013, AMGH Editora Ltda. Todos os direitos reservados.
BIBLIOGRAFIA
DuBose TD Jr: Acid-base disorders, in Brenner and Rector’s The Kidney, 8th
ed, B Brenner (ed), Philadelphia, W.B. Saunders, 2008
———: A 42-year-old woman with flaccid paralysis. Am J Kidney Dis 54:965,
2009
———: Acidosis and alkalosis, in Harrison’s Principles of Internal Medicine,
18th ed, DL Long et al (eds). New York, McGraw-Hill, 2012
Kraut JA, Kurtz I: Toxic alcohol ingestions: Clinical features, diagnosis, and
management. Clin J Am Soc Nephrol 3:208, 2008
———, Madias NE: Serum anion gap: Its uses and limitations in clinical medicine. Clin J Am Soc Nephrol 2:162, 2007
Mount DB: Fluid and electrolyte disorders, in Harrison’s Principles of Internal
Medicine, 18th ed, DL Long et al (eds). New York, McGraw-Hill, 2012
———, Krahn TA: Hyponatremia: Case vignettes. Semin Nephrol 29:300,
2009
———, Zandi-Nejad K: Disorders of potassium balance, in Brenner and
Rector’s The Kidney, 8th ed, B Brenner (ed). Philadelphia, W.B. Saunders,
2008, pp 547–558
Perianayagam A et al: DDAVP is effective in preventing and reversing inadvertent overcorrection of hyponatremia. Clin J Am Soc Nephrol 3:331,
2008
Schrier RW et al: Tolvaptan, a selective oral vasopressin V2-receptor antagonist, for hyponatremia. N Engl J Med 355:2099, 2006
Desequilíbrios entre Líquidos e Eletrólitos e Desequilíbrios entre Ácido e Base
©2013, AMGH Editora Ltda. Todos os direitos reservados.
CAPÍTULO e15
O fomepizol deve ser administrado por via intravenosa, sendo que
dose de carga (15 mg/kg) deve ser seguida por doses de 10 mg/kg, a
cada 12 horas para quatro doses e, partir de então, 15 mg/kg a cada 12
horas, até que os níveis de etileno glicol sejam reduzidos para menos
de 20 mg/dL e o paciente se torne assintomático e com pH normal.
Componentes adicionais muito importantes no tratamento de intoxicação por ingestão alcoólica incluem ressuscitação com líquidos,
tiamina, piridoxina, folato, bicarbonato de sódio e hemodiálise. A
função da hemodiálise é remover os compostos básicos e os metabólitos tóxicos, além da remoção do fomepiazol administrado, sendo necessário ajustar a dose com frequência. A aspiração gástrica, a
êmese induzida ou o uso de carvão ativado somente são eficazes se o
início ocorrer entre 30 a 60 minutos após a ingestão da toxina. Nos
casos em que o fomepiazol não estiver disponível, o etanol, que tem
afinidade dez vezes maior para a álcool desidrogenase em comparação com outros álcoois, pode ser uma opção bastante eficaz. A administração intravenosa de etanol permite atingir um nível sanguíneo
de 22 meq/L (100 mg/dL). Uma das desvantagens do etanol é a obnubilação que ocorre depois da administração, que é um efeito adicional aos efeitos do etileno glicol no sistema nervoso central. Além
disso, nos casos em que a hemodiálise for utilizada, é necessário incrementar a taxa de infusão de etanol, considerando que é dialisado
muito rapidamente. De maneira geral, a hemodiálise é recomendada
para uso em todos os pacientes com intoxicação por etileno glicol
quando o pH arterial for inferior a 7,3 ou o hiato osmolar exceder 20
mosmol/kg H2O.
15-11