HEMOSTASIA E COAGULAÇÃO SANGUÍNEA
Hemostasia significa prevenção de perda sanguínea. Com o rompimento de um vaso, a
hemostasia é provocada por diversos meios: (1) constrição vascular, (2) formação de tampão
de plaquetas, (3) formação de coágulo sanguíneo, como resultado da coagulação do sangue,
(4) eventual crescimento de tecido fibroso no coágulo para fechamento permanente da
ruptura.
Imediatamente após o corte, a parede muscular lisa do vaso se contrai, reduzindo o
fluxo sanguíneo pelo vaso lesado. Essa contração resulta principalmente de um (1) espasmo
miogênico local (que de acordo com o trauma, pode durar de minutos a horas, dando tempo
para a formação de tampões plaquetários e para a coagulação sanguínea); (2) fatores
autacoides liberados pelos tecidos locais e pelas plaquetas, principalmente no caso de vasos
menores, que são mais sensíveis a substância vasoconstritora tromboxano A liberada pelas
plaquestas e (3) reflexos nervosos desencadeados por impulsos nervosos dolorosos ou outros
impulsos sensoriais. Essas pequenas lesões vasculares ocorrem centenas de vezes ao dia no
corpo naturalmente, sendo reparadas pelo mecanismo de formação de tampão plaquetário.
As plaquetas são formadas pela fragmentação dos megacariócitos (células
extremamente grande das séries hematopoieticas na medula) na medula óssea ou, de modo
especial, no momento em que eles se espremem nos capilares, encontrando-se na
concentração de 150.000 a 300.000/microlitro no sangue. Elas são anucleadas e, portanto,
incapazes de se reproduzir, embora contenham diversas características de uma células normal:
citoplasma contendo proteínas contráteis actina, miosina trombostenina (um tipo especial de
proteína contrátil), resíduo de RE e Golgi que produzem enzimas e armazenam íons cálcio,
mitocôndrias capazes de realizar respiração celular, capazes de sintetizar prostaglandinas ou
outros hormônios que vausam reações vasculares e teciduais locais, a proteína fator
estabilizadorde fibrina e o fator de crescimento, que promove o crescimento de células do
endotélio, musculatura lisa e fibroblasto vasculares, reparando os danos. A membrana celular
das plaquetas também possui uma camada de glicoproteínas que impede a aderência ao
endotélio normal, enquanto favorece a adesão as áreas lesionadas (ligam-se à fibras colágeno
na parede interna do vaso). São removidas no baço, assim como as hemácias, a cada 8-12 dias.
Ao entrar em contato com o tecido lesionado, as plaquetas mudam sua conformação,
dilatando-se e criando pseudópodos que se projetam sobre área lesada. Suas proteínas
contráteis ficam muito ativas, provocando a liberação de fatores ativos que assumem um
aspecto pegajoso, se aderindo ao colágeno dos tecidos e a proteina (fator de von Willebrand).
Elas também secretam grande quantidade de ADP e suas enzimas formam o tromboxano A2,
que atuam na aticação das plaquetas vizinhas, formando um tampão plaquetário. Inicialmente
o tampo não é fixo, assim se tornando com a formação de filamentos de fibrina, que se
prendem firmemente às plaquetas.
A formação do coágulo sanguíneo é estimulada por substâncias ativadoras produzidas
pela parede vascular traumatizada, plaquetas e proteínas sanguíneas aderidas ao tampão
plaquetário (começa a se desenvolver de 15-20 segundos em feridas grandes, levando mais
tempo nas menores). De 3 a 6 minutos, se a abertura não for muito grande, ela já é totalmente
ocupada pelo coágulo, que se retrai após 20min-1h, fechando ainda mais o vaso.
O coágulo formado pode se dissolver ou ser invadido por fibroblastos, formando tecido
conjuntivo por todo o coágulo. Em pequenos orifícios nos vasos, a invasão por fibroblastos é
promovida por fgf’s liberados pelas plaquetas, continunado até a completa organização do
coágulo em tecido fibroso (1 a 2 semanas). Em locais de grande extravasamento de sangue
para os tecidos, coágulos podem ser formados em locais indevidos, ativando fatores internos
que os dissolvem.
O balanço dos fatores anticoagulantes e pró-coagulantes no sangue é o que promove a
regulação do processo de coagulação. Geralmente, o sangue possui maior quantidade de
fatores anticoagulantes, o que se inverte no local de lesão endotelial.
A primeira etapa da coagulação consiste de uma cascata de reações química (com
participação de vários fatores prócoagulantes) para formar a protrombina em resposta a lesão
do vaso ou problemas relacionado ao próprio sangue – essa protrombina se fixa incialmente a
receptores específicos na membrana das plaquetas. A segunda etapa é a formação da
trombina a partir da protrombina pelo ativador de protrombina, formado com a liberação de
substâncias especiais no sangue ou pela lesão do vaso – essa reação necessita da presença de
Ca2+ . A trombina atua como uma enzima, convertendo fibrinogênio em fibras de fibrina,
formando um emaranhado de plaquetas, células sanguíneas e plasma para formar o coágulo.
A protrombina é uma proteína plasmática da classe alfa-2-globulina, presente numa
concentração de 15mg/dL no plasma normal. Ela é produzida no fígado de forma contínua e,
quando ativada, divide-se em proteínas menores, como a trombina. A ativação da protrombina
no fígado conta com a vitamina K, bem como a formação de outros fatores pró-coagulantes
nesse orgão. A falta dela associada a doença hepática tendem a aumentar sangramentos.
O fibrinogênio é uma proteína plasmática que está em concentração normal de 100 a
700 mg/dL no plasma. Ele é formado no fígado e circula pela corrente sanguínea, não sendo
normalmente encontrado no líquido intersticial, dado seu grande tamanho impossibilitar a
passagem pelos orifícios capilares. Em situações em que essa permeabilidade é aumentada,
ele vaza para o interstício e promove a coagulação desses líquidos. A trombina remove
monômeros de fibrina de cada molécula de fibrinogênio, que se polimerizam para formar as
fibras de fibrina, que constituem o retículo do coágulo.
Inicialmente os monômeros interagem por ligações de hidrogênio fracas, e as fibras
recém-formadas não se ligam entre si. O fator estabilizador de fibrina, presente também em
pequena quantidade no plasma e liberado em maior escala pelas plaquetas no tampão
plaquetário, também é ativado pela trombina e atua na formação de ligações covalentes entre
os monômeros de cada fibra e entre elas próprias.
A retração do coágulo é promovida principalmente pelas plaquetas. Além de liberar o
fator estabilizador de fibrinas, a atividade das suas proteínas contráteis atuam sobre as
espículas plaquetárias associadas a rede de fibrina. Essa contração é ativada e acelerada pela
trombina/Ca2+ (o íon possui um reservatório nas mitocondrias, RE e Golgi plaquetários).
A coagulação pode começar à partir de 2 mecanismos –
1. Via extrínseca : O tecido traumatizado libera o fator tecidual ou tromboplastina
tecidual - composto por fosfolipídios das membranas dos tecidos + complexo
lipoproteico que atua como enzima proteolítica. Esse complexo se combina ao
fator VII e a íons cálcio para ativar o fator X. O fator X se combina a fosfolipídeos
teciduais e plaquetários e ao fator V para formar o ativador de protrombina. A
formação de trombina e sua ação enzimática ativam o fator V (que encontra-se
inativo no complexo ativador de protrombina), acelerando a ativação (feedback
positivo).
2. Via intrínseca: O trauma sanguíneo (contato com superfície molhável, como vidro)
ou exposição do sangue ao colágeno leva a ativação do fator XII e liberação dos
fosfolipídios das plaquetas + lipoproteína fator plaquetário 3. O fator XII ativa o
fator XI (necessita de APM e é acelerado pela pré-calicreína), que ativa o fator IX,
que atua junto com o fator VIII + fosfolipídeos plaquetário + fator 3 na ativação do
fator X. A ausência de fator VIII é uma das causas da hemofilia clásica, motivo pelo
qual ele é chamado de fator anti-hemofílico. A partir do fator X, procede da
mesma forma que a via extrínseca.
Os íons cálcio são necessários para a promoção/aceleração de todas as reações de
coagulação sanguínea (exceto as 2 primeiras da intrínseca). As duas vias atuam
concomitantemente na maioria dos casos, interagindo entre elas. Porém, a via extrínseca é
mais rápida que a intrínseca.
A uniformidade da superfície das células endoteliais, que impedem a ativação da via
intrínseca, a camada de glicocálice do endotélio, que repele os fatores de coagulação e
plaquetas e a proteína de membrana trombomodulina que liga-se a trombina, retirando-a do
sangue e ativando a proteína C, que inativa os fatores V e VIII ativados, são fatores
anticoagulantes fisiológicos. As fibras de fibrina formadas pela trombina são capazes de
adsorver, sem inativar, cerca de 85 a 90% dessa proteína, ajudando a prevenir o crescimento
do coágulo. A trombina que não é adsorvida liga-se à antitrobina III, que impede sua ação
sobre o fibrinogênio.
Em associação a heparina, a antitrombina III é capaz de remover não só a trombina
com mais eficácia, mas também fatores ativados. Essa proteína é sintetizada principalmente
pelos mastócitos localizados no tecido conjuntivo pericapilar de todo o corpo, que a secretam
continuamente no sangue (essa mesma função é realizada pelos basófilos, porém esses
leucócitos estão presentes no sangue, não no tecido conjuntivo). Os mastócitos estão
significativamente presentes no fígado e pulmão, evitando o crescimento dos coágulos
embólicos recebidos por esses orgãos.
Os tecidos lesados liberam lentamente o ativador do plasminogênio tecidual (AP-t),
que converte o plasminogênio (ou pró-fibrinolisina) em plasmina (ou fibrinolisina) em alguns
dias após a lesão, quando o coágulo já terá interrompido o sangramento. A plasmina é uma
enzima proteolítica capaz de digerir as fibras de fibrina, fibrinogênio, fatores de coagulação e a
protrombina. Esse mecanismo é importante na desobstrução de pequenos vasos periféricos, o
que pode ocorrer com a formação do coágulo devido a seu pequeno diâmetro.
EFEITOS DA DEFICIÊNCIA DE VITAMINA K –A maioria dos fatores de coagulação são
formados no fígado, sendo a vitamina K uma coenzima necessária para a formação completa
da protrombina, dos fatores VII, IX e X e da proteína C. Essa vitamina torna-se inativa após essa
reação, sendo reativada com a ação da enzima VKOR c1. Doenças como hepatite, cirrose e
atrofia amarela aguda, assim como a deficiência na captação de vitamina K, podem levar uma
grave tendência de sangramento.
Essa vitamina é constantemente produzida pela flora bacteriana intestinal, logo é raro
haver sua deficiência dada uma dieta pobre em vitamina K. Entretanto, os principais
mecanismos que levam a essa deficiência são problemas na absorção de gorduras, como na
falha do fígado de secretar bile (o que ocorre na obstrução dos ductos biliares ou doença
hepática). Por esse motivo, a vitamina K é injetada em pacientes cirúgicos com doença
hepática ou cálculos biliares.
HEMOFILIA – É causada, em 85% dos casos, pela anormalidade ou deficiência do fator
VIII, denominando-se hemofilia clássica. Em 15% dos casos, é causada por deficiência do fator
IX. Os dois fatores são transmitidos geneticamente pelo cromossomo feminino (herança
recessiva), sendo, portanto, menor sua prevalência em mulheres. Ela existe em diversos graus,
em geral não levando ao sangramento, exceto em caso de trauma. O fator VIII purificado é o
único tratamento eficaz para sangramento prolongado e grave no hemofílico, porém seu custo
é muito alto (a produção de fator VIII recombinante tende a mudar isso).
TROMBOCITOPENIA- significa presença de concentrações muito baixas de plaquetas
no sangue circulante. Pessoas com essa doença apresentam também tendência hemorrágica,
principalmente em vênulas pequenas e capilares, ao contrário da hemofilia, que pode ocorrer
em grandes vasos. Várias pequenas hemorragias puntiformes deixam a pele com diversas
manchas arroxeadas, dando À doença o nome de púrpura trombocitopênica. A transfusão
sanguínea pode ser eficaz para parar os sangramentos de 1 a 4 dias, enquanto a esplenectomia
é um tratamento mais eficaz, uma vez que o baço remove grande parte das plaquetas.
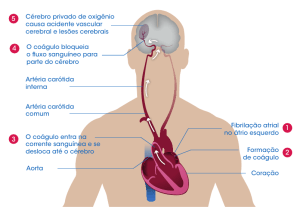
CONDIÇÕES TROMBOEMBÓLICAS NO SER HUMANO – Um coágulo anormal que se
desenvolve no vaso sanguíneo é denominado trombo. O fluxo sanguíneo leva a sua liberação e
escoamento pelo sangue, tornando-se um êmbolo. Os êmbolos formados nas grandes artérias
ou no lado esquerdo do coração podem ocluir artérias ou arteríolas no cérebro, nos rins e
outros locais. Já os êmbolos originados no sistema venoso, geralmente fluem para o pulmões e
causam embolia pulmonar. As causas são geralmente duas – a superfície endotelial áspera de
um vaso (arteriosclerose, trauma ou infecção) desencadeia um processo de coagulação, sendo
que o sangue só coagula no fluxo lento, onde pequenas quantidades de trombina e outros prócoagulantes estão sendo formados. O uso de AP-t fabricado pela engenharia genética já é
utilizado no tratamento de tromboembolismo.
O mecanismo de coagulação pode ser ativado em áreas disseminadas da circulação,
dando origem à coagulação intravascular disseminada. Com frequência ocorre pela presença
de grande quantidade de tecido traumatizado ou necrótico, que liberam grandes quantidades
de fator tecidual no sangue. Em especial, pode ocorrer em pacientes com septicemia
disseminada, nas quais as toxinas bacterianas ativam mecanismos de coagulação. Esses
pequenos coágulos disseminados bloqueiam a circulação nos vasos periféricos menores. A
remoção de vários fatores pró-coagulantes pode, ainda, causar sangramento nesse indivíduo.



![[editar] Hemostasia Primária](http://s1.studylibpt.com/store/data/002169050_1-068c83c7b19b32328fa4a39d5d21a00b-300x300.png)