Nome
Nº
Série
3a
Disciplina
Professor
Química 2
Natureza
Regina
Código / Tipo
Apostila 4
Trimestre / Ano
Ensino
Turma
NOTA
Médio
Data
Ap/ I
Tema
Valor da avaliação
Reações Orgânicas - Oxidação
------
Reações de oxidação são reações que ocorrem com o oxigênio. Esse assunto se encontra na
página 303, capítulo 18 do livro adotado. Estudaremos as principais delas:
1) Combustão
2) Oxidação de álcoois – página 319
3) Oxidação de alcenos – página 303
1) Combustão
É a reação de oxidação mais comum.É denominado de combustível o reagente que se queima
e de comburente, o oxigênio. Nessa reação, o hidrogênio presente no combustível, se
transforma em água e o carbono em CO2, CO e/ou C. Existem 3 tipos de combustão:
a) Completa – Todo o carbono presente no combustível é convertido em gás carbônico (CO2).
É o tipo de combustão mais desejável pois, dentre as três, é a que polui menos.
C4H10 + 13/2 O2 → 4 CO2 + 5 H2O
b) Incompleta – O carbono presente no combustível é convertido em monóxido de carbono
(gás inodoro que se une à hemoglobina, inutilizando-a para o transporte de gás oxigênio,
levando à morte por asfixia) ou carbono (material particulado, finamente dividido que provoca
problemas respiratórios).
C5H10 + 5 O2 → 5 CO + 5 H2O
C5H10 + 5/2 O2 → 5 C + 5 H2O
2) Oxidação de álcoois
As reações de oxidação em álcoois ocorrem na presença de KMnO 4 (permanganato de
potássio) ou K2Cr2O7 (dicromato de potássio) concentrados, em meio ácido e à quente. Nessas
condições, essas substâncias liberam o oxigênio nascente [O] que ataca os hidrogênios (H)
ligados ao carbono da hidroxila (-OH).
OH
|
—C—H
|
OH
|
— C — OH
|
[O]
H2O
2.1) Oxidação de álcool primário
Oxidação parcial
Álcool primário
[O]
Aldeído +
H2O
oxidação total
[O]
Ácido carboxílico
O
||
— C + H2O
|
Exemplo:
OH
|
H3C — C — H
|
H
etanol
[O]
H2O
O
||
H3C — C — H
Aldeído acético
ou etanal
O
||
H3C — C — OH
Ácido acético ou
ác. etanóico
[O]
Ler, no livro adotado, sobre química ao seu redor – bafômetro (pág320) e azedamento do
vinho (pág 321 e 322).
2.2) Oxidação de álcool secundário
[O]
Álcool secundário
Cetona
Exemplo:
OH
|
H3C — C — CH3
|
H
isopropanol
[O]
H2O
2.3) Oxidação de álcool terciário
[O]
Álcool terciário
O
||
H3C — C — CH3
Propanona
ou acetona
[O]
Não reage
não reage
O álcool terciário não apresenta H ligado ao carbono da hidroxila e por isso não sofre
oxidação.
Fazer os exercícios do livro - páginas 327 e 328 e páginas 329 (exercícios 7 ao
20).
Exercício desafio página 331 (exercícios 3, 4 e 5).
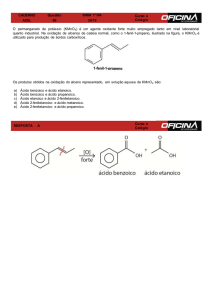
3) Oxidação de alcenos
Existem 3 tipos de oxidação para hidrocarbonetos insaturados: branda, ozonólise e a
enérgica.
3.1) Oxidação branda
O oxidante é uma solução aquosa de KMnO4 diluída, a frio, em meio neutro ou levemente
alcalino.
2 KMnO4 + H2O → 2 KOH + 2 MnO2 + 3 [O]
Nessas condições, a solução de KMnO4 é chamada de REATIVO DE BAYER e apresenta
uma cor violeta intensa. É muito utilizada na diferenciação de alcenos (alquenos) de cicloalcanos
que são isômeros de cadeia. Como os alcenos possuem uma ligação pi, somente eles sofrerão
reação de oxidação, descolorindo a solução de KMnO4.
Alceno + KMnO4 → solução incolor com precipitado de MnO2, de cor marrom.
Cicloalcano + KMnO4 → solução violeta vivo (a solução não sofre descoramento).
O ataque à ligação pi do alceno pelo oxigênio, proveniente do KMnO 4, formará um diálcool.
CH2 ═ CH2 + [O] + H2O →
Oxigênio
nascente
proveniente
do KMnO4
H2C
CH2
|
|
OH OH
Etileno-glicol
Adição de 2 hidroxilas em cada carbono da insaturação.
3.2) Ozonólise
É uma reação de oxidação pelo ozônio (O3) seguida de hidratação na presença de zinco
(Zn). O zinco destrói o peróxido de hidrogênio (H2O2) que se forma durante a reação, impedindo
que o aldeído formado se oxide e se transforme em ácido carboxílico. A água serve para
hidrolisar o composto intermediário da reação originando aldeídos ou cetonas.
O
O
O
||
O3
H2O
CH
―
C― H
3
CH3 ― CH ― O ― C ― CH3
CH3 ― CH ═ C ― CH3
Zn
|
|
+
CH3
CH3
O
||
Ozonídeo ou ozoneto =
CH
―
C ― CH3
3
composto intermediário
+
H2O2
Resumindo:
R ― C ═ C ― R
|
|
H
R
+
O3
H2O/ Zn
O
||
R ― C ― H
+
O
||
R ― C ― R
+
H2O2
Nos reagentes:
A adição de “=O” em carbonos primários e secundários insaturados originam aldeídos.
A adição de “=O” em carbonos terciários insaturados originam cetonas.
3.3) Oxidação enérgica
O oxidante é uma solução aquosa de KMnO4 ou de K2Cr2O7 concentrada, a quente, em
meio ácido.
2 KMnO4 + 3 H2SO4 → K2SO4 + 2 MnSO4 + 3 H2O + 5 [O]
ou
K2Cr2O7 + 4 H2SO4 → K2SO4 + Cr2(SO4)3 + 4 H2O + 3 [O]
O oxigênio formado atacará a ligação pi do alceno, quebrando-a.
CH3 ― CH ═ C ― CH3
|
CH3
+
3[O]
CH3 ― C ═ O
|
OH
+
O ═ C ― CH3
|
CH3
CH3 ― CH ═ CH2
+
5[O]
CH3 ― C ═ O
|
OH
+
CO2
+
Resumindo:
H
R
|
|
R ― C ═ C ― R
[o]
O
||
R ― C ― OH
+
O
||
R ― C ― R
A adição de “=O” em carbonos primários insaturados originam CO2 e H2O.
A adição de “=O” em carbonos secundários insaturados originam ácidos.
A adição de “=O” em carbonos terciários insaturados originam cetonas.
Fazer os exercícios do livro páginas 307 e 308 – exercícios 1 ao 9.
Página 309 – exercícios 1 ao 11.
Página 310 – exercícios 1 ao 7.
H2O