Química Solucionada
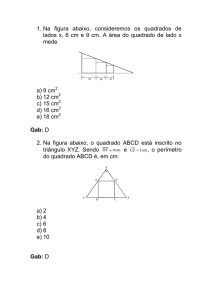
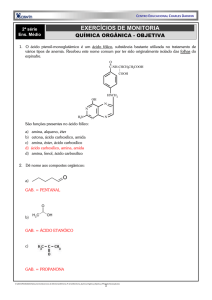
9.9999.0111 / 9.8750.0050 / 9.9400.5166 / 9.8126.0630
Título: Reações Inorgânicas
Data:
/
/ 2017
QS
1
Exercícios de fixação
01 - (IFSP)
A decomposição térmica do calcário, CaCO3, produz
CO2 e CaO, ou seja, nessa transformação, um
a) sal produz um óxido ácido e um óxido básico.
b) sal produz dois óxidos ácidos.
c) sal produz dois óxidos básicos.
d) ácido produz dois óxidos ácidos.
e) ácido produz um óxido ácido e um óxido básico.
02 - (UFGD MS)
Sódio metálico reage violentamente com água, resultando
em hidróxido de sódio e hidrogênio, conforme a seguinte
equação química:
Naº + H2O NaOH + 1/2 H2
Assinale a alternativa que apresenta a classe de reação
na qual se enquadra essa transformação.
a) Reação de dupla troca.
b) Reação iônica.
c) Reação de complexação.
d) Reação de polimerização.
e) Reação de oxirredução.
03 - (UDESC SC)
Analise as equações:
I.
K2S(aq.) + 2 HClO3(aq.) 2 KClO3(aq.) +
H2S(aq.)
II.
Zn(OH)2(s) ZnO(s) + H2O(l)
III. Cl2(g) + 2 HI(aq.) I2(s) + 2 HCl(aq.)
A classificação da reação equacionada e o nome do
composto em negrito são respectivamente:
a) em II, reação de simples troca e óxido de zinco.
b) em III, reação de simples troca e ácido perclórico.
c) em I, reação de dupla troca e cloreto de potássio.
d) em II, reação de decomposição e hidróxido de
zinco.
e) em I, reação de dupla troca e clorato de potássio.
04 - (CEFET PR)
O universo está a todo o momento fervilhando de
reações químicas. Por exemplo, neste exato momento,
as estruturas metálicas que suportam o seu peso, na
cadeira em que você está sentado, estão sendo
atacadas pelo oxigênio do ar, segundo a reação:
Fe(s) + O2(g) Fe2O3(s)
(não balanceada)
Outra reação que está ocorrendo neste exato momento é
a transformação do amido, que você pode ter ingerido no
café da manhã, na forma de glicose, em gás carbônico,
água e energia. Esta reação pode ser representada por:
enzima
CO2(g) + H2O(l)
C6H12O6(s) + O2(g)
(não balanceada)
Estas reações podem ser classificadas respectivamente
como:
a) combustão e síntese.
b) redox e síntese.
c) oxidação e dupla troca.
d) síntese e combustão.
e) formação e simples troca.
05 - (UDESC SC)
Determinadas reações ocorrem devido à ação externa de
agentes físicos, como o calor, a luz e a eletricidade.
www.quimicasolucionada.com.br
Abaixo são dados alguns exemplos desses tipos de
reações.
I. O fermento químico (bicarbonato de amônio),
também conhecido como carbonato ácido de
amônio, quando misturado à massa, para
preparação de um bolo, e levado ao forno,
decompõe-se, produzindo gás dentro da massa, o
que deixa o bolo crescido e fofo.
II. Os vegetais sintetizam os chamados polissacarídios,
por meio da fotossíntese. Essa reação é
indispensável à manutenção da vida sobre a Terra.
O mecanismo da reação foi esclarecido pelo
cientista Melvin Calvin, o que lhe valeu o Prêmio
Nobel de Química, em 1961.
III. A reação de decomposição do cloreto de sódio
sólido é realizada para se obter sódio metálico e
cloro gasoso, utilizando para isso a eletricidade.
IV. O óxido de cálcio, também denominado cal viva ou
cal virgem, pode ser preparado pela decomposição
térmica do carbonato de cálcio.
Com base na análise dos enunciados acima, assinale a
alternativa que classifica corretamente as reações, de
acordo com o agente físico que provocou tal reação;
respectivamente:
a) pirólise; fotólise; pirólise; eletrólise.
b) fotólise; pirólise; eletrólise; fotólise.
c) pirólise; fotólise; eletrólise; pirólise.
d) pirólise; eletrólise; fotólise; pirólise.
e) eletrólise; fotólise; pirólise; fotólise.
06 - (UFRR)
Observe as reações químicas a seguir:
I. AgNO3(aq) NaCl(aq) AgCl (s) NaNO3(aq)
II. 2HCl (aq) Mg (s) MgCl 2(aq) H 2(g)
III. Zn (s) CuSO 4 (aq) ZnSO 4 (aq) Cu (s)
IV. Mg (s) O 2(g) 2MgO(s)
Analisando as alternativas de cima para baixo podemos
afirmar que, os tipos de reação são:
a) I-Dupla troca, II-simples troca, III-dupla troca, IVsíntese;
b) I-Dupla troca, II-síntese, III-simples troca, IV-simples
troca;
c) I-Dupla troca, II-simples troca, III-simples troca, IVsíntese;
d) I-Dupla troca, II-síntese, III-dupla troca, IV-síntese;
e) I-Dupla troca, II-dupla troca, III-síntese, IV-síntese.
07 - (UFU MG)
Observe as equações a seguir:
2KO3Cl 2KCl 3O2
I.
II.
2NO2 N 2O4
III.
Na2CO3 2HCl 2NaCl H2O CO2
IV. 2Mg 2AgNO3 Mg( NO3 ) 2 2Ag
Assinale a alternativa que representa, respectivamente, a
seqüência das reações de síntese, análise, simples troca
e dupla troca:
a) II, I, IV, III
b) I, II, III, IV
c) IV, I, II, III
d) II, I, III, IV
[email protected] 1
Química Solucionada
08 - (UFGD MS)
Para ilustrar as propriedades metálicas de certo
elemento, um estudante mergulhou uma placa metálica
em um recipiente apropriado contendo água ultrapura (a
25 ºC) isenta de gás. Após alguns minutos, pôde-se
observar a liberação de bolhas de gás e a formação de
um precipitado no fundo do recipiente.
De acordo com essas informações, assinale a opção
que apresenta o metal constituinte da placa.
a) Magnésio
b) Ferro
c) Níquel
d) Cádmio
e) Chumbo
09 - (ITA SP)
Borbulha-se gás cloro em solução aquosa diluída de
hidróxido de sódio a 25 ºC. Assinale a opção que
contém apenas produtos clorados resultantes.
a)
b)
Cl , ClO 3
–
–
OCl , Cl
c)
ClO 3 , ClO 4 , Cl
d)
ClO 3 , OCl
e)
ClO 4 , ClO 3
–
–
–
10 - (Unievangélica GO)
Os ácidos são compostos inorgânicos que liberam em
meio aquoso como cátion principal o H 3 O . Na reação
com metais, o ácido libera um gás característico,
confirmado pelo aparecimento de bolhas.
Qual das reações abaixo contém um ácido como
reagente e liberação do gás acima mencionado?
a) NaOH + Li LiOH + Na
2–
b) H2SO4 + 2Cl HCl + SO4
c) CaO + 2K K2O+ 1/2O2
d) HCl + Na NaCl + 1/2H2
11 - (UDESC SC)
Analise a série de reatividade dos metais abaixo.
Assinale a alternativa que contém a reação que irá
ocorrer espontaneamente.
a) Fe(s) + Ca(NO3)2(aq)
b) Ni(s) + 2 KCl(aq)
c) Mg(s) + CuSO4(aq)
d) 2Ag(s) + NiSO4(aq)
e) Cu(s) + ZnSO4(aq)
12 - (PUC RS)
Adicionou-se uma porção de magnésio a uma solução
de ácido clorídrico em um frasco de erlenmeyer. Na
boca do frasco adaptou-se um balão de borracha
bastante flexível. Após algum tempo, o balão encheu-se
de gás. O balão ascendeu após ter sua ponta amarrada
e ser solto no ar. Ao se aproximar dele um palito de
fósforo aceso, o balão explodiu.
Com base nessas informações, é correto afirmar que
a) o gás formado na primeira reação é o óxido de
magnésio.
b) o produto gasoso formado na reação de
combustão é mais denso que o ar, em idênticas
condições.
c) a reação da combustão do gás é representada por
H2(g) +1/2 O2(g) H2O(g).
d) na reação com o ácido, o metal sofre redução do
seu estado de oxidação.
www.quimicasolucionada.com.br
e)
9.9999.0111 / 9.8750.0050 / 9.9400. / 9.8126.0630
a necessidade da chama indica que a reação de
combustão não é espontânea.
13 - (UEA AM)
Um dos métodos de produção de hidrogênio em
laboratório é pela reação de ácidos com certos metais.
Um metal que reage com ácido clorídrico produzindo
esse gás é
a) o zinco.
b) a platina.
c) o ouro.
d) o cobre.
e) a prata.
14 - (UNIR RO)
Considere o seguinte experimento:
Em um tubo de ensaio contendo uma certa quantidade
de zinco em pó, colocou-se uma quantidade suficiente de
solução aquosa de sulfato de cobre II. Na sequência, o
tubo foi agitado.
Depois de certo tempo de repouso, o que é possível
observar?
a) O sistema libera gás e torna-se incolor.
b) O sistema absorve energia deixando o tubo
congelado.
c) O zinco em pó volta a se depositar no fundo do tubo.
d) Deposita-se cobre metálico no fundo do tubo e a
solução torna-se incolor.
e) Não ocorre qualquer reação química e o sistema
permanece inalterado.
15 - (UFTM MG)
Uma lâmina de zinco desgasta-se, com efervescência,
se for mergulhada em uma solução aquosa 1,0 mol/L a
25ºC de
a) NaCl.
b) HCl.
c) KNO3.
d) CuSO4.
e) NH4CH3COO.
16 - (CEFET PR)
O alumínio se dissolve em ácido clorídrico aquoso, mas
não em ácido nítrico. O ácido nítrico é um poderoso
oxidante e fonte de oxigênio, de modo que oxida
rapidamente a superfície do alumínio, formando uma
película que protege o metal contra ataque ácido. A
proteção é tão eficiente que o ácido nítrico pode ser
transportado em veículos com tanque de alumínio.
Indique a alternativa que apresenta a equação
equilibrada do alumínio com ácido clorídrico.
a) 3 HCl(aq) + Al(s) AlCl3(aq) + H2O(l)
b) 3 HCl(aq) + Al(s) AlCl3(aq) + 3 H2(g)
c) 6 HCl(aq) + 2 Al(s) 2 AlCl3(aq) + 3 H2(g)
d) 6 HCl(aq) + 2 Al(s) 2 AlCl3(aq) + H2O(l)
e) 6 HCl(aq) + Al2O3(s) 2 AlCl3(aq) + 3 H2O(l)
17 - (UFMG)
Num laboratório, foram feitos testes para avaliar a
zinco, Zn.
Para tanto, cada um desses metais foi mergulhado em
Cu(NO3)2, uma de nitrato de magnésio, Mg(NO3)2, e uma
de nitrato de zinco, Zn(NO3)2.
Neste quadro, estão resumidas as observações feitas ao
longo dos testes:
[email protected] 2
Química Solucionada
a)
b)
c)
Considerando-se essas informações, é CORRETO
afirmar que a disposição dos três metais testados,
segundo a ordem crescente de reatividade de cada um
deles, é
a) Cu / Mg / Zn .
b) Cu / Zn / Mg .
c) Mg / Zn / Cu .
d) Zn / Cu / Mg .
18 - (Mackenzie SP)
O escurecimento de uma corrente de prata, devido à
formação de sulfeto de prata, decorre de sua exposição
ao ar. Esse escurecimento pode ser eliminado,
colocando-se a corrente, por certo tempo, em uma
panela de alumínio contendo solução aquosa de
bicarbonato de sódio (NaHCO3). Desse processo,
equacionado abaixo, pode-se afirmar que
água
a)
b)
c)
d)
e)
Ag2S A A 2S3 Ag
(equação balanceada)
o alumínio é menos eletropositivo que a prata,
deslocando-a.
após a retirada das manchas escuras, a massa de
prata da corrente será bem menor que a massa de
prata inicial.
forma-se sulfato de alumínio.
a prata é reduzida, voltando a depositar-se na
corrente, de modo que a massa final de prata na
corrente é igual à massa inicial.
o bicarbonato de sódio em água torna o meio ácido,
protegendo a panela.
d)
9.9999.0111 / 9.8750.0050 / 9.9400. / 9.8126.0630
O cartum sugere que a urina promove a oxidação do
ferro e do alumínio. Os dois óxidos formados nesse
processo, quando em contato com a água, levam a
um pH alcalino.
A fórmula molecular do acido úrico é C5H6N4O3.
A excreção da uréia na urina ocorre por sua alta
solubilidade em água, o que é explicado pelas fortes
interações de van der Walls entre o soluto e o
solvente.
A uréia pode ser obtida pelo aquecimento do
hidróxido de amônio.
20 - (UFSCAR SP)
Na Classificação Periódica, a coluna 1 refere-se aos
elementos alcalinos e a coluna 17 refere-se aos
halogênios. Metais alcalinos como Lítio, Sódio e Césio
reagem com gases halogênios como Cl2. Os produtos
das reações dos metais Lítio,
Sódio e Césio com o gás Cl2 são sólidos iônicos cujas
fórmulas são, respectivamente,
a) LiCl2, NaCl, CsCl.
b) LiCl, NaCl2, CsCl.
c) LiCl2, NaCl2, CsCl2.
d) LiCl3, NaCl3, CsCl3.
e) LiCl, NaCl, CsCl.
TEXTO: 1 - Comum à questão: 21
Alguns metais sofrem risco de escassez na natureza, e
por isso apresentam um alto valor agregado. A
recuperação dos metais de resíduos industriais e de
laboratórios torna-se importante porque associa dois
fatores: o econômico e a redução do impacto ambiental,
causado pelo descarte dos metais diretamente na
natureza. A figura representa um fluxograma para
recuperação dos metais Al, Mg e Cu, de 88,0 kg de
resíduo de uma liga metálica utilizada na aviação.
19 - (UEG GO)
A uréia e o ácido úrico podem ser encontrados na urina
de alguns animais, como resultado do metabolismo dos
compostos nitrogenados. Esses dois compostos, por
causa do alto teor de nitrogênio, são empregados,
respectivamente, em nutrição animal e fertilizantes. Suas
estruturas estão mostradas na figura a seguir.
H
O
O
N
21 - (FGV SP)
A soma dos coeficientes estequiométricos da equação
balanceada da reação que ocorre na dissolução do Mg
com HCl é igual a
a) 5.
b) 7.
c) 8.
d) 9.
e) 10.
NH
O
H2N
N
N
H
H
O
NH2
Uréia
Ácido úrico
Com base no cartum, nas informações fornecidas pelo
texto e nas representações das estruturas químicas do
ácido úrico e da uréia, é CORRETO afirmar:
www.quimicasolucionada.com.br
TEXTO: 2 - Comum à questão: 22
O Carvão foi uma das primeiras fontes de energia e, em
pleno século XXI, ainda é muito empregado, haja vista a
possibilidade de instalação no Pará de uma termoelétrica
alimentada por carvão mineral. Sua composição média
varia muito, porém valores comuns são: 4% de umidade,
5% de matéria volátil, 81% de carbono e materiais
[email protected] 3
Química Solucionada
minerais diversos que levam, após a combustão, à
formação de aproximadamente 10% de cinzas. Estas
cinzas ou “pó do carvão” são muito leves e, para que não
levantem poeira, devem ser armazenadas em ambiente
com umidade controlada. As cinzas são constituídas de
uma série de elementos, normalmente expressos na
forma de óxidos: SiO2, Al2O3, TiO2, Fe2O3, CaO, MgO,
K2O, Na2O, P2O5, Mn3O4, BaO. Além desses, outro óxido
importante é o SO3, produzido e liberado na forma
gasosa durante o processo de combustão.
22 - (UFPA)
Considerando a presença de P2O5 na cinza armazenada,
sua reação com a umidade do ambiente pode ser
classificada como
a) oxi –redução.
b) neutralização.
c) simples troca.
d) dupla troca.
e) síntese.
b)
c)
d)
e)
9.9999.0111 / 9.8750.0050 / 9.9400. / 9.8126.0630
desprendimento de gás, formação de sólido e
liberação de energia.
formação de sólido, formação de sólido e liberação
de energia.
desaparecimento de sólido, desaparecimento de
sólido e absorção de energia.
desprendimento de gás, formação de sólido e
absorção de energia.
TEXTO: 5 - Comum à questão: 25
Em 18 de Fevereiro de 2015, o Google Doodle fez uma
homenagem ao 270º aniversário do inventor da pilha
elétrica, Alessandro Volta, um físico italiano que tinha
como uma de suas paixões a eletricidade. A unidade
elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve
grande importância no que diz respeito à pilha elétrica.
TEXTO: 3 - Comum à questão: 23
O carbonato de sódio anidro, conhecido comercialmente
como barrilha, é um sal branco e translúcido, utilizado
nas indústrias de sabão, vidro, têxtil, tintas e outras.
Industrialmente a barrilha pode ser obtida por meio do
Processo Solvay, que utiliza como matérias primas o
cloreto de sódio, o amoníaco e o carbonato de cálcio, de
acordo com as reações representadas pelas equações
químicas abaixo:
eq. 1 NaCl (aq) + NH3 (g) + CO2 (g) + H2O (l)
NaHCO3 (s) + NH4Cl (aq)
eq. 2 CaCO3(s) CaO (s) + CO2 (g)
eq. 3 CaO (s) + 2 NH4Cl (aq) 2 NH3 (g) + CaCl2 (aq) +
H2O (l)
eq. 4 NaHCO3(s) Na2CO3 (s) + H2O (l) + CO2 (g)
23 - (UFPA)
A última etapa do processo Solvey (eq. 4) é uma reação
classificada como
a) síntese.
b) simples troca.
c) decomposição.
d) dupla-troca.
e) combustão.
TEXTO: 4 - Comum à questão: 24
Um professor de química, para abordar o tema
“transformações químicas” durante uma aula prática,
realizou junto com seus alunos três experimentos. Para
os experimentos I e II foram anotadas na lousa as
equações das reações químicas envolvidas e para o
experimento III foram medidas a temperatura inicial (dos
reagentes) e a temperatura final (logo após a mistura
dos reagentes).
I.
reação entre zinco e solução de HCl:
Zn (s) + 2 HCl (aq) ZnCl2 (aq) + H2 (g)
II.
reação entre soluções de nitrato de chumbo(II) e
iodeto de potássio:
Pb(NO3)2 (aq) + 2 KI (aq) PbI2 (s) + 2 KNO3 (aq)
III. reação entre soluções de H2SO4 e NaOH:
temperatura inicial: 25 ºC
temperatura final: 29
ºC
24 - (FAMECA SP)
As evidências das transformações químicas para os
experimentos I, II e III são, respectivamente,
a) desprendimento de gás, desaparecimento de
sólido e absorção de energia.
www.quimicasolucionada.com.br
Na imagem, podemos observar uma pilha e duas
semirreações que representam os processos de
oxidação e de redução, envolvidos na confecção dessa
pilha, cujos potenciais padrão de redução são:
2+
I.
Zn /Zn: –0,76 V
+
II.
2H /H2: 0,00 V
Um dos materiais usados na confecção da pilha é o
zinco, cujo símbolo é Zn e apresenta
Número atômico: 30
Massa atômica: 65,4 u
Ponto de fusão: 419,5 °C
Ponto de ebulição: 907 °C
Configuração por camadas:
K L M N
2 8 18 2
25 - (FATEC SP)
A imagem apresenta duas semirreações, sendo uma de
um elemento não metálico. Dada a fila de reatividade de
metais:
alcalinos>alcalinoterrosos>Al>Zn>Fe>H2>Cu>Ag>Pt>Au ,
é correto afirmar que, a substância simples desse
elemento pode ser obtida por meio da reação de
a) simples-troca, numa reação entre o metal zinco e o
ácido sulfúrico.
b) deslocamento, numa reação do metal prata com
ácido clorídrico.
c) dupla-troca, numa reação entre dois sais.
d) neutralização, entre um ácido e uma base
inorgânicos.
e) esterificação entre um ácido e um álcool, ambos
orgânicos.
GABARITO:
1) Gab: A; 2) Gab: E; 3) Gab: E; 4) Gab: D; 5) Gab: C; 6) Gab: C
7) Gab: A; 8) Gab: A; 9) Gab: B; 10) Gab: D; 11) Gab: C; 12) Gab: C
13) Gab: A; 14) Gab: D; 15) Gab: B; 16) Gab: C; 17) Gab: B
18) Gab: D; 19) Gab: A; 20) Gab: E; 21) Gab: A; 22) Gab: E
23) Gab: C; 24) Gab: B; 25) Gab: A.
[email protected] 4