ETIOLOGIA DA CANDIDÍASE ESOFÁGICA E AVALIAÇÃO DO EFEITO
ANTIFÚNGICO DO EXTRATO DE PRÓPOLIS IN VITRO E IN VIVO
DANIELLE PATRÍCIA CERQUEIRA MACÊDO
RECIFE
2011
UNIVERSIDADE FEDERAL DE PERNAMBUCO
CENTRO DE CIÊNCIAS BIOLÓGICAS
DEPARTAMENTO DE MICOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA DE FUNGOS
ETIOLOGIA DA CANDIDÍASE ESOFÁGICA E AVALIAÇÃO DO EFEITO
ANTIFÚNGICO DO EXTRATO DE PRÓPOLIS IN VITRO E IN VIVO
Danielle Patrícia Cerqueira Macêdo
Tese apresentada ao Programa de Pós-Graduação
em Biologia de Fungos do Departamento de
Micologia do Centro de Ciências Biológicas da
Universidade Federal de Pernambuco, como parte
dos requisitos para a obtenção do título de Doutor
em Biologia de Fungos.
Área de Concentração: Micologia Aplicada
Orientador: Rejane Pereira Neves
Co-orientadores: Neiva Tinti de Oliveira
José Vitor Moreira Lima Filho
RECIFE
2011
Macêdo, Danielle Patrícia Cerqueira
Etiologia da candidíase esofágica e avaliação do efeito antifúngico do
extrato de própolis in vitro e in vivo/ Danielle Patrícia Cerqueira Macêdo. –
Recife: O Autor, 2011.
117 folhas : il., fig., tab.
Orientador: Rejane Pereira Neves
Co-orientadores: Neiva Tinti de Oliveira
José Vítor Moreira Lima Filho
Tese
(doutorado)
–
Universidade
Federal
de
Pernambuco. Centro de Ciências Biológicas. Micologia
aplicada, 2011.
Inclui bibliografia
1. Candidíase 2. Própolis 3. Micologia I. Título.
579.5
CDD (22.ed.)
UFPE/CCB-2011-166
DEDICO
Ao verdadeiro Mestre e Pai, ao amado Filho e ao Espírito Santo de amor.
Aos meus pais Alfredo e Liliane e ao meu irmão Paulo,
pelo amor dedicado.
OFEREÇO
Ao meu amado esposo Alexandre, meu verdadeiro companheiro
e à minha linda filha Clara,
fontes de inspiração e perseverança na caminhada.
Amo vocês!
"Nada te perturbe
Nada te espante
Tudo passa,
Só Deus não muda.
A paciência
Tudo alcança
Quem a Deus tem,
Nada lhe falta
Só Deus basta."
(Santa Teresa d'Ávila)
AGRADECIMENTOS
À Universidade Federal de Pernambuco, por toda minha formação profissional
repleta de incríveis momentos de aprendizagem e realizações.
Ao Departamento de Micologia pela acolhida desde minha graduação até hoje,
sempre me encantando através do maravilhoso mundo dos fungos e de seus dedicados
profissionais.
Ao Programa de Pós-graduação em Biologia de Fungos por todo apoio científico,
financeiro e pela confiança nos projetos por mim propostos.
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela
confiança e apoio financeiro durante estes quatro anos de muito trabalho.
Ao meu esposo Alexandre e à minha filha Clara, pela paciência e companheirismo,
estando lado a lado nos desafios enfrentados e nas muitas provas do amor de Deus para
comigo.
Aos meus pais Alfredo e Liliane e ao meu irmão Paulo, pela constante preocupação
e cuidado nos momentos de luta.
À minha querida orientadora e amiga Rejane Neves, pelo amor à sua profissão e
aos seus alunos, capaz de inspirar toda minha formação profissional e pessoal, dando-me
coragem e incentivo para a concretização desta obra.
Aos professores Oliane Magalhães, Cristina Souza Motta, Armando Marsden,
Neiva Tinti, Maria Auxiliadora Cavalcanti, Leonor Costa Maia, Elaine Malosso, Uided
Cavalcanti e Lusinete Aciole de Queiroz (in memorian) pelos ensinamentos e
contribuições valiosas.
Ao amigos do Laboratório de Micologia Médica pela amizade e fidelidade por
todos estes anos, em especial Aline Mary, Vanessa Karina, Reginaldo Gonçalves, André
Ferraz, Patrícia Cariolano, Fabíola Marques, Elvislene, Nadja Lopes, Ana Maria Rabelo,
Carol, Ildnay, Nadyr, Suanni Lemos, Caroline Sanuzi, Heloísa, Helton, entre tantos outros
queridos.
Aos meus colegas e amigos do Departamento de Micologia: Suzane Chang,
Micheline, Patrícia, Marielle, Paula, Vilma, Indra, Catarina, Filipe, Bruno Tomio, André
Santiago, Philipe, Tatiana, Rodrigo, Juliana e tantos outros, por toda alegria e ajuda.
Aos profissionais do Setor de Endoscopia Digestiva do Hospital Universitário
Oswaldo Cruz, na pessoa da Drª Ana Botler Wilhein, por toda atenção e contribuição a esta
pesquisa.
Ao meu co-orientador, Prof. José Vitor Lima-Filho (UFRPE), por todos os
ensinamentos, atenção e valiosas contribuições.
À Roberta Ventura, Ayrles Brandão e Taciana Ralph pela valiosa amizade e ajuda
incansável (LAMIN-UFRPE).
Ao Dr. David Bousfield, por seus ensinamentos e colaboração na revisão criteriosa
de nossos artigos publicados.
Ao senhor Edivaldo Pacheco, pelas amostras de própolis fornecidas e por sua
disponibilidade em colaborar com a pesquisa.
Às queridas religiosas da Instrução Cristã pelo apoio e orações durante todos os
momentos.
Aos colegas do Departamento de Medicina Tropical da Universidade Federal de
Pernambuco, pela compreensão e torcida.
Aos familiares que me acompanharam e ajudaram a perseverar nos momentos de
cansaço: Fátima Militão, Maria Jaqueline Militão, Ana Carolina e sobrinhos, Flávia
Regina, Diógenes, Débora Ferreira, Saulo e Juliana Medeiros, Filipe, Daniela Dubeux, e
aos meus irmãos queridos que me fazem acreditar em um Sonho.
RESUMO GERAL
Candidíase esofágica (CE) é uma infecção oportunista comum em hospedeiros
imunossuprimidos. Devido à identificação inadequada e imprecisa, o surgimento de
espécies não-C. albicans como patógenos potenciais tem sido subestimado. Assim, os
objetivos deste trabalho foram isolar espécies de Candida da cavidade oral e mucosa
esofágica de pacientes diagnosticados para esofagite, comparar as amostras isoladas por
marcadores moleculares e avaliar in vitro e in vivo o efeito antifúngico do extrato de
própolis vermelha. Um total de 1.482 pacientes com sintomas gastrointestinais foi
examinado. Destes, 42 apresentaram lesões sugestivas para CE durante a endoscopia.
Amostras da cavidade oral e do esôfago foram obtidas e cultivadas em Sabouraud dextrose
ágar. A identificação foi realizada por métodos clássicos e moleculares. As espécies
isoladas da mucosa oral e esofágica foram C. albicans, C. glabrata, C. parapsilosis, C.
tropicalis, C. krusei, C. guilliermondii, C. kefyr e Trichosporon inkin. O polimorfismo
inter e intraespecífico dos isolados de Candida foi avaliado pela técnica de PCR com
primer derivado de regiões dos espaços intergênicos (T3B), e primers microssatélites
(GTG)5 e (GACA)4. O primer (GACA)4 revelou variabilidade inter e intraespecífica e
nenhuma similaridade foi observada entre os isolados orais e esofágicos, demonstrando a
independência na patogênese entre a candidíase oral e CE. Testes in vitro conduzidos pelo
M27-A3 (CLSI) apresentaram concentrações inibitórias mínimas entre 32-512 µg ml-1 para
própolis vermelha (Rp) e 0,125-16 µg ml-1 para fluconazol (Flz), respectivamente. Para
realização dos testes in vivo, camundongos foram imunossuprimidos com doses diárias de
dexametasona (0,5 mg/animal) por via intraperitoneal durante 14 dias, com intervalos de
três dias. A infecção foi realizada, após o período de imunossupressão, com 1x108 células
viáveis de C. albicans URM6285 por swab via intra-esofágica seguida pela administração
intragástrica de 0,2 mL desta suspensão. Sete dias após a infecção, os camundongos foram
divididos em 6 grupos (n = 5) e tratados diariamente por via oral com Flz e Rp em
diferentes concentrações. O tratamento exclusivo com Rp 150 mg/kg/dia e doses
combinadas com Flz:Rd em diferentes concentrações eliminou a levedura da língua e
mucosa do esôfago. Este estudo destaca a possível utilização do extrato de própolis
vermelha isoladamente ou em combinação com medicamentos antifúngicos comerciais
para o tratamento da CE.
Palavras-chave:
Candidíase
esofágica,
diagnóstico
antifúngica, modelo experimental, própolis vermelha.
micológico,
susceptibilidade
ABSTRACT
Candida esophagitis (CE) is a common opportunistic infection in immunocompromised
hosts. Due to inadequate and inaccurate identification, the emergence of non-Candida
albicans species as potential pathogens has been underestimated. The objectives of this
study were isolate Candida species from oral and esophageal mucosa from patients
diagnosed with esophagitis, compare the isolated strains using molecular markers,
determine the main risk factors for disease and evaluate the in vitro and in vivo antifungal
effect of red propolis extract. A total of 1482 patients with gastrointestinal symptoms were
examined. Of these patients, 42 had lesions suggestive of CE during endoscopy. Samples
of the oral cavity and esophagus were obtained and cultured on Sabouraud dextrose agar.
The identification was performed by classical and molecular methods. The isolated species
from the oral and esophageal mucosa were C. albicans, C. glabrata, C. parapsilosis, C.
tropicalis, C. krusei, C. guilliermondii, C. kefyr and Trichosporon inkin. The inter and
intraspecific polymorphism of Candida isolates was evaluated by PCR method with a
primer derived from intergenic space regions (T3B), and microsatellite primers (GTG)5
and (GACA)4. Primer (GACA)4 revealed inter and intraspecific variability and no
similarity was found between esophageal and oral isolates, demonstrating the
independence in the pathogenesis of oral candidiasis and CE. In vitro tests conducted by
the M27-A3 (CLSI) had minimal inhibitory concentrations between 32-512 mg ml-1 for red
propolis (Rp) and 0.125-16 mg ml-1 for fluconazole (Flz), respectively. To perform the in
vivo tests, 30 mice were immunosuppressed with intraperitoneal daily doses of
dexamethasone (0.5 mg/animal) for 14 days with intervals of three days. The infection was
performed after the period of immunosuppression with 1x108 viable cells of C. albicans
URM6285 via esophageal swab followed by intragastric administration of 0.2 mL of this
suspension. Seven days after infection, the mice were divided into six groups (n = 5)
treated daily with oral fluconazole (Flz) and red propolis extract (Rp) at different
concentrations. The exclusive treatment with Rp 150 mg/kg/day and the combined doses
with Flz:Rp at different concentrations eliminated the yeast from the tongue and
esophagus. This study highlights the potential use of red propolis extract alone or in
combinations with antifungal commercial drugs for the treatment of CE.
Key-words: Esophageal candidiasis, mycological diagnosis, antifungal susceptibility,
experimental model, red propolis.
LISTA DE PUBLICAÇÕES
Macêdo, D.P.C., Silva, V.K.A., Farias, A.M.A., Melo, L.R.B., Wilheim, A.B., Neves, R.P.
2008. Candida glabrata esophagitis: new case reports and management. Brazilian Journal
of Microbiology, 39: 279-281. (Artigo publicado)
Macêdo, D.P.C., Oliveira, N.T., Farias, A.M.A., Silva, V.K., Wilheim, A.B., Couto, F.M.,
Neves, R.P. 2010. Esophagitis caused by Candida guilliermondii in diabetes mellitus: first
reported case. Medical Mycology, 48(6): 862-865. (Artigo publicado)
Macêdo, D.P.C., Oliveira, N.T., Silva, V.K., Farias, A.M.A., Lima-Neto, R.G., Wilheim,
A.B., Oliveira, P.C., Pedi, N., Andrade, S.L., Neves, R.P. 2011. Trichosporon inkin
esophagitis: an uncommon disease in a patient with pulmonary cancer. Mycopathologia,
171(4), 279-283. (Artigo publicado)
Macêdo, D.P.C., Oliveira, N.T., Farias, A.M.A., Chang, S.C., Wilheim, A.B., Neves, R.P.
DNA fingerprinting of Candida species from oral and esophageal mucosa: risk factors and
molecular relation with esophagitis pathogenesis. Fungal Genetics and Biology, Maio de
2011. (Artigo submetido e em análise)
Macêdo, D.P.C., Lima-Neto, R.G., Oliveira, P.C., Silva, V.K., Farias, A.M.A., Leal,
A.F.G., Pacheco, E., Neves, R.P. In vitro antifungal activity of Brazilian red propolis: a
therapeutic option against esophageal candidiasis. Letters in Applied Microbiology. (Artigo
a ser submetido)
Macêdo, D.P.C., Lima-Filho, J.V.M., Leal, A.F.G., Andrade, S.L., Ventura, R.F., Silva,
A.F.B., Ralph, M.T., Pacheco, E., Pontes-Filho, N.T., Neves, R.P. In vivo activity of red
propolis and fluconazole against Candida esophagitis: therapeutic effects of simple and
combined administration. Clinical Microbiology and Infection. (Artigo a ser submetido)
LISTA DE FIGURAS
Capítulo 3
Pág.
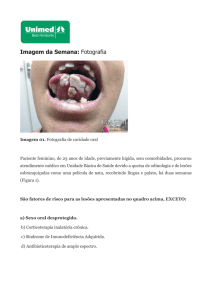
Figura 1. Aparência endoscópica da esofagite por Candida glabrata grau II de
Wilcox (A), apresentando placas brancas e exsudato característicos de
esofagite por Candida e exame direto da lesão, clarificado com solução de
hidróxido de potássio a 20% exibindo numerosos blastoconídeos (B)................ 50
Capítulo 4
Fig. 1 Aspecto endoscópico de esofagite por Candida guilliermondii grau II de
Wilcox (A), exibindo placas brancas e exame microscópico do agente
apresentando numerosos blastoconídeos e pseucomicélio (B)............................. 57
Capítulo 5
Fig 1. Aparência endoscópica de esofagite grau I de Wilcox (a) e numerosos
artroconídios (indicados) ao exame direto (b). Aspectos macroscópico (c) e
microscópico (d) de Trichosporon inkin em ágar fubá (X 400)........................... 66
Capítulo 6
Figura 1. Perfil de amplificação dos isolados de Candida albicans e C. glabrata
(22A-B, 32A-B) obtidos a partir da cavidade oral e esôfago com iniciador
(GACA)4. Linha M: marcador de 100pb. (A: isolados orais; B: isolados
esofágicos) ........................................................................................................... 76
Figura 2. Perfil de amplificação dos isolados de Candida albicans e C. glabrata
(22A-B, 32A-B) obtidos a partir da cavidade oral e esôfago com iniciador
(GTG)5. Linha M: marcador de 100pb. (A: isolados orais; B: isolados
esofágicos) ........................................................................................................... 77
Figura 3. Perfil de amplificação dos isolados de Candida albicans e C. glabrata
(22A-B, 32A-B) obtidos a partir da cavidade oral e esôfago com iniciador
T3B. Linha M: marcador de 100pb. (A: isolados orais; B: isolados esofágicos). 78
Capítulo 8
Figura 1. Modelo experimental de candidíase esofágica em camundongos
imunossuprimidos com dexametasona, apresentando ao exame direto do
tecido da mucosa do esôfago (A) e língua (C) numerosos blastoconídeos,
pseudomicélio e micélio verdadeiro típicos de Candida e numerosas células
de leveduras viáveis infectando toda a mucosa do esôfago (B) e da língua (D)
ao exame histopatológico corado com hematoxilina-eosina (400X).................. 95
Figura 2. Modelo experimental de candidíase esofágica em camundongos tratados
oralmente com extrato de própolis vermelha, apresentando redução
qualitativa e quantitativa das estruturas de Candida albicans ao exame direto
da mucosa do esôfago (A) e língua (C) e células de leveduras fragmentadas
com sinais de normalização da camada serosa da mucosa do esôfago (B) e
língua (D) ao exame histopatológico corado com hematoxilina-eosina (400X). 96
Figura 3. Contagem de Unidades Formadoras de Colônias (UFC) de Candida
albicans viáveis na língua e esôfago de camundongos suíços com candidíase
esofágica. A concentração do inóculo foi de 1 x 108 UFC/mL. Após diluições
seriadas dos órgãos infectados foi realizado plaqueamento em ágar Sabourand
Dextrose, sendo a quantificação realizada após 48 horas a 37ºC........................ 97
LISTA DE TABELAS
Capítulo 4
Pág.
Tabela 1. Perfil fisiológico distinguindo C. guilliermondii de C. famata e C.
fermentati ................................................................................................................... 58
Capítulo 6
Tabela 1. Espécies de Candida isoladas da mucosa oral e esofágica e fatores de
risco associados com a candidíase ........................................................................... 75
Capítulo 7
Tabela 1. Determinação da concentração inibitória mínima de fluconazol e
própolis vermelha frente a espécies de Candida associadas com candidíase
esofágica .................................................................................................................... 86
SUMÁRIO
Pág.
1. INTRODUÇÃO ...................................................................................................................... 14
2. FUNDAMENTAÇÃO TEÓRICA .......................................................................................... 16
2.1. HISTOLOGIA E FISIOLOGIA DA MUCOSA ORAL E ESOFÁGICA........................... 16
2.1.1 Mucosa Oral................................................................................................................... 16
2.1.2 Mucosa Esofágica ......................................................................................................... 17
2.2. COLONIZAÇÃO POR ESPÉCIES DE Candida: RISCO PARA INFECÇÃO.................. 17
2.3. CANDIDÍASE ESOFÁGICA .............................................................................................. 19
2.3.1 Fatores predisponentes para candidíase esofágica......................................................... 22
2.3.2 Sinais, sintomas e casos clínicos da candidíase esofágica............................................. 25
2.4. DIAGNÓSTICO DA CANDIDÍASE ESOFÁGICA ........................................................... 30
2.5. ESOFAGITE EXPERIMENTAL ........................................................................................ 32
2.6. TERAPIA ANTIFÚNGICA NA CANDIDÍASE ESOFÁGICA ......................................... 33
2.7. NOVOS COMPOSTOS COM POTENCIAL ANTIFÚNGICO: FITOTERAPIA
ALTERNATIVA ................................................................................................................. 38
2.7.1 Própolis.......................................................................................................................... 38
3. ESOFAGITE POR CANDIDA GLABRATA: NOVOS CASOS RELATADOS E
CONDUTA TERAPÊUTICA .............................................................................................
45
4. ESOFAGITE CAUSADA POR CANDIDA GUILLIERMONDII NO DIABETES
MELLITUS: PRIMEIRO CASO RELATADO .................................................................
51
5. ESOFAGITE POR TRICHOSPORON INKIN: UMA DOENÇA RARA EM PACIENTE
COM CANCER DE PULMÃO ............................................................................................. 59
6. IDENTIFICAÇÃO DO DNA DE ESPÉCIES DE CANDIDA DA MUCOSA ORAL E
ESOFÁGICA: FATORES DE RISCO E SUA RELAÇÃO MOLECULAR COM A
PATOGÊNESE DA ESOFAGITE .....................................................................................
67
7. ATIVIDADE FUNGICIDA IN VITRO DA PRÓPOLIS VERMELHA BRASILEIRA:
UMA OPÇÃO TERAPÊUTICA CONTRA A CANDIDÍASE ESOFÁGICA...................... 79
8. ATIVIDADE IN VIVO DA PRÓPOLIS VERMELHA E FLUCONAZOL CONTRA
ESOFAGITE POR CANDIDA: EFEITOS TERAPÊUTICOS DA ADMINISTRAÇÃO
SIMPLES E COMBINADA .................................................................................................. 87
9. CONSIDERAÇÕES GERAIS................................................................................................. 98
REFERÊNCIAS BIBLIOGRÁFICAS ........................................................................................ 99
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
1. INTRODUÇÃO
Candidíase esofágica é uma infecção fúngica oportunista, inicialmente subaguda,
comum em imunocomprometidos e rara em imunocompetentes, e se caracteriza por
apresentar placas pseudomembranosas esbranquiçadas aderidas à parede do esôfago.
Detectada através de endoscopia digestiva alta, apresenta como agentes várias espécies de
Candida, organismos comensais do trato gastrointestinal que colonizam o esôfago em
aproximadamente 20% dos adultos saudáveis (Lott et al., 2005). C. albicans é a espécie
mais freqüente, embora C. tropicalis, C. parapsilosis, C. krusei e outras possam estar
envolvidas (Olmos et al., 2005).
Alterações no estado de hidratação, pH, concentração de nutrientes, microbiota
local da membrana mucosa, defeitos específicos no sistema imune do hospedeiro, em
especial na imunidade mediada por células, bem como o uso de esteróides, antibióticos de
largo espectro, inibidores de ácidos gástricos e imunossupressores favorecem o
estabelecimento desta micose (Karmeli et al., 1995, Barbaro et al., 1996, Weerasuriya;
Snape, 2006, Macêdo et al., 2010).
No curso desta doença podem ocorrer complicações com episódios de
sangramentos, perfurações no trato digestivo, desnutrição ou até disseminação, a qual pode
acometer aproximadamente 15% dos pacientes com leucemia e 11% dos transplantados
renais. Em imunocompetentes a candidíase esofágica está relacionada ao uso de inibidores
da bomba de prótons e antagonista do receptor de histamina, gerando hipocloridria e
alteração da microbiota da cavidade oral, aumentando assim o risco de infecção (Gupta et
al., 1994, Karmeli et al., 1995, Gaissert et al., 1999, Underwood et al., 2003).
As variadas espécies de Candida representam uma grave ameaça aos pacientes
imunocomprometidos e a disseminação da candidíase esofágica para regiões mais
profundas pode ser fatal. Este fato fundamenta a urgência do diagnóstico e o início
tratamento (Traeder et al., 2008). A conduta laboratorial adequada através de exame direto
e cultura auxiliam no diagnóstico clínico e tratamento, entretanto esses métodos estão
sendo complementados por métodos moleculares como estratégia de diagnóstico rápido
uma vez que características fenotípicas comuns entre algumas espécies de leveduras
dificultam a taxonomia desses organismos (Reis, 1998, Mannarelli; Kurtzman, 1998,
Sullivan et al., 1999, Alves et al., 2000).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
15
Muitas técnicas de biologia molecular (DNA fingerprinting) têm sido usadas para
definir populações fúngicas. A amplificação de microssatélites com um alto nível de
polimorfismo permite uma discriminação precisa entre indivíduos proximamente
relacionados com a utilização de iniciadores homólogos, que amplificarão as regiões
localizadas entre os microssatélites (Inter Seqüências Simples Repetidas-ISSR) que
também apresentam polimorfismo permitindo diferenciação intra-específica (Gupta et al.,
1994, Barros Lopes et al., 1996, Becerra; Paredes, 2000, Dalzoto et al., 2003).
O conhecimento da variabilidade genética entre os isolados de Candida, além das
pesquisas com novos agentes antifúngicos, tem contribuído para o controle das infecções
fúngicas, uma vez que as drogas atualmente utilizadas apresentam limitações devido aos
efeitos citotóxicos e desenvolvimento de resistência (Lacaz et al., 2002, Resende et al.,
2004, Vasquez, 2010).
A resistência ao fluconazol, droga de escolha para tratamento de candidíase
esofágica, é um problema emergente (Vazquez, 2010). As opções terapêuticas são
limitadas nos pacientes resistentes aos azoles, particularmente quando há resistência
cruzada a outros triazoles e intolerância aos seus componentes (Walsh et al., 2000).
Novos compostos antifúngicos têm sido propostos como alternativas para
minimizar as ações hepatotóxica e nefrotóxica causadas pelas drogas convencionais, a
partir de pesquisas com substâncias popularmente conhecidas por suas propriedades
terapêuticas (Queiroz et al., 2008).
Apesar de ainda se apresentar em fase de estudos preliminares, a própolis vermelha
foi citada por exibir propriedades antifúngicas, antibacteriana, anti-inflamatória,
antioxidante e antineoplásica comprovadas. Constitui-se em uma substância resinosa
produzida por abelhas (Apis mellifera) a partir de Dalbergia ecastophyllum (L) Taub.,
vegetação bastante encontrada no litoral da região Nordeste do Brasil e em países como
Cuba. Este produto de origem natural apresenta-se rico em flavonóides, aldeídos, cetonas,
ácidos aromáticos, graxos, ésteres, terpenos, esteróides, aminoácidos, polissacarídeos,
hidrocarbonetos, álcoois, hidroxibenzeno e vários outros compostos ainda em tipificação
(Basnet et al., 1997, Kanazawa et al., 2003, Trusheva et al., 2006, Aslan et al., 2007,
Daugsch et al., 2007, Franchi-Júnior et al., 2007).
Diante do exposto, esta pesquisa teve como objetivos isolar diferentes espécies de
Candida da cavidade oral e da mucosa esofágica de pacientes diagnosticados para
esofagite, comparar as amostras isoladas por meio de marcadores moleculares e avaliar in
vitro e in vivo o efeito antifúngico do extrato de própolis vermelha.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
16
2. FUNDAMENTAÇÃO TEÓRICA
2.1 HISTOLOGIA E FISIOLOGIA DA MUCOSA ORAL E ESOFÁGICA
As mucosas da cavidade oral, do esôfago, do estômago e do intestino delgado
compõem o trato gastrointestinal superior, o qual abriga uma grande variedade de microorganismos como vírus, protozoários, bactérias e fungos que, em determinadas condições,
podem causar infecções (Repentigny et al., 2004, Lamps, 2008).
2.1.1 Mucosa Oral
A mucosa oral apresenta características histológicas semelhantes às mucosas
vaginal e esofágica incluindo epitélio escamoso estratificado superficial e lâmina própria
abaixo de tecido colagenoso denso, separado pela membrana basal (Ross et al., 1995,
Eroschenko, 2000, Squier; Kremer, 2001).
O revestimento das mucosas encontradas na região geniana, assoalho da boca,
região inferior da língua e palato mole, representa 60% da superfície da cavidade oral. O
epitélio escamoso estratificado nestas áreas apresenta a camada basal, uma camada
espinhosa e superficialmente uma camada granular geralmente não queratinizada e,
portanto, semelhante à do epitélio esofágico (Squier; Kremer, 2001, Repentigny et al.,
2004).
O epitélio oral varia, portanto, no grau de queratinização e cornificação encontrados
na gengiva, palato duro e superfície dorsal da língua, onde ocorrem forças de atrito criadas
por morder, mastigar e pela circulação de alimentos (Schroeder, 1991). A descamação
contínua dos queratinócitos e a presença de nódulos de tecido linfóide componentes da
superfície oral desempenham papel crucial na manutenção de uma mucosa oral saudável e
no controle da colonização e infecção por espécies de Candida (Samaranayake;
Samaranayake, 2001, Repentigny et al., 2004).
A depleção de células Langerhans e sua reduzida expressão de moléculas do
complexo principal de histocompatibilidade (MHC) classe II e interleucina 12
provavelmente alteram o desenvolvimento de linfócitos T CD4, imprescindíveis na
resposta imunológica adaptativa mediada por células na cavidade oral e mucosa do esôfago
(Repentigny et al., 2004).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
17
2.1.2 Mucosa Esofágica
O esôfago é considerado um órgão que conecta a faringe (localizado em oposição à
sexta vértebra cervical) à cárdia (à esquerda da décima primeira vértebra torácica). Fixa-se
acima da cartilagem cricóide e abaixo do diafragma, sendo ocluído na região superior pelo
esfíncter faringo-esofageano e na terminal, pelo esfíncter esofágico inferior. O
revestimento muscular é composto por uma camada externa, formada por fibras
longitudinais, e uma camada interna de musculatura circular, com a presença do plexo de
Auerbach entre as duas, sendo estriadas na porção superior do esôfago (Sheehan, 2008).
Sheehan (2008) afirma que no início da deglutição o alimento se desloca
voluntariamente da boca para a faringe, desenvolvendo uma onda peristáltica primária,
causando relaxamento do esfíncter esofágico superior e permitindo que o alimento penetre
no esôfago. A estimulação direta do esôfago promove peristalse secundária, a qual conduz
o conteúdo para o estômago, usualmente auxiliado pela gravidade. A falha de contração
faríngea e/ou relaxamento do esfíncter cricoesofageano é responsável pela maioria dos
casos de disfagia alta; entretanto, a disfagia baixa é causada mais freqüentemente por
obstrução.
Baseado em Iglesias e Gómez (2006), disfagia é citada como a dificuldade na
passagem dos alimentos desde a boca, onde se forma o bolo alimentar, até o estômago. É
uma sensação subjetiva que aparece durante ou imediatamente após a deglutição e variadas
causas podem provocar este sintoma. Estes autores concordam que a disfagia que começa
apenas para alimentos sólidos é indício de obstrução mecânica.
Aproximadamente 20% dos adultos saudáveis apresentam colonização do trato
gastrointestinal por micro-organismos comensais, incluindo cavidade oral e esôfago
(Simon et al., 1997, Baehr; Mcdonald, 1998). Contudo, há controvérsias acerca dos riscos
destes comensais tornarem-se patógenos e promoverem lesão esofágica.
2.2 COLONIZAÇÃO POR ESPÉCIES DE Candida: RISCO PARA INFECÇÃO
Baseado em estudos epidemiológicos, humanos estão expostos repetidamente às
leveduras do gênero Candida. Uma característica comum entre indivíduos colonizados é
que a espécie mais freqüente ainda é C. albicans com variações intra-específicas e outras
espécies de Candida com tropismo específico para o trato gastrointestinal, contudo, a
história natural da colonização permanece pouco compreendida (Boerlin et al., 1996).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
18
A significância da colonização esofágica por fungos é controversa, com escassez de
dados sobre este assunto (Andersen et al., 1992; Underwood et al., 2003). De acordo com
Péter e colaboradores (2000) colonização é definida como a não observância de placas
esofágicas sugestivas para micose com a presença de estruturas fúngicas ao exame direto
e/ou cultura positiva.
Na população dinamarquesa a prevalência de colonização do esôfago por Candida
foi estimada em 23% segundo Andersen et al. (1992). No mesmo estudo, desconsiderando
o número de colônias isoladas, os fungos foram encontrados em 60% dos pacientes com
aparência macroscópica normal da mucosa esofágica.
Hidratação alterada, pH, concentração de nutrientes e microbiota da membrana
mucosa, bem como alterações específicas do sistema imune especialmente a imunidade
mediada por células, permitem a colonização e invasão da mucosa pelas leveduras do
gênero Candida (Brodey, 1993; Richardson; Flörl, 2008).
Segundo Underwood et al. (2003), a colonização é inibida pela defesa exercida pela
salivação, clearance do conteúdo do lúmen esofágico, presença de barreira mucosa intacta
e manutenção da microbiota bacteriana e fúngica normais. Os antibióticos podem predispor
os pacientes imunocompetentes à infecção fúngica através da colonização e crescimento
exacerbado das espécies da microbiota (Thapa; Kumar, 1989, Wilcox; Karowe, 1994).
As leveduras sobrevivem como comensais em sítios anatômicos, de acordo com o
ambiente em que se encontram e a pressão ambiental exercida sobre estas. Em superfícies
mucosas, a limitação dos nutrientes e a competição entre as bactérias e fungos pertencentes
à microbiota normal, exercem uma pressão seletiva, o que resulta na eliminação dos microorganismos menos adaptados (Calderone; Fonzi, 2001).
Segundo Alexander et al. (1990), qualquer variável que provoque o desequilíbrio
da microbiota ou lesão da mucosa gastrointestinal pode ser um agente facilitador de
translocação de espécies de Candida até os capilares mesentéricos. Sendo assim, fatores
que aumentem a colonização intestinal por estes micro-organismos (uso de antibióticos,
oclusão intestinal) ou determinem atrofia ou lesão de mucosa intestinal (jejum prolongado,
nutrição parenteral total, hipotensão, quimioterapia) pode potencializar o fenômeno de
translocação no tubo gastrointestinal.
Um número significativo de autores acredita que infecções por Candida resultam
de colonização endógena da microbiota (Reagan et al., 1990, Grauhan et al., 1994, Voss et
al., 1994). Contudo, de acordo com Wey et al. (1989), a colonização não exerce influência
no prognóstico, sendo considerada um fator independente para subseqüente micose.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
19
Péter et al. (2000) sugerem associação direta entre colonização e esofagite por
fungos e que estudos moleculares podem contribuir para verificação de similaridade entre
os isolados, uma vez que a presença de fungos na orofaringe é um fator preditivo para
colonização esofágica ou esofagite.
2.3 CANDIDÍASE ESOFÁGICA
Em 1956, Andrén e Theander foram os primeiros a descrever candidíase
(anteriormente denominada monilíase) esofágica através de técnicas de raios X. Desde
então, um grande número de relatos têm sido descritos, abordando características clínicas e
epidemiológicas desta doença ( Eras et al., 1972, Laufer, 1982, Kliemann et al., 2008).
Esta micose é considerada uma infecção fúngica oportunista, inicialmente
subaguda, comum em imunocomprometidos e rara em imunocompetentes, e se caracteriza
por apresentar placas pseudomembranosas esbranquiçadas aderidas à parede do esôfago
(Lott et al., 2005, Macêdo et al., 2008).
Wingard et al. (1993) e Ortuño et al. (1997) relataram que o aumento na taxa de
colonização relaciona-se com a severidade da doença de base com a permanência no
ambiente hospitalar e o uso de antibióticos de largo espectro, os quais eliminam
determinadas bactérias que competem com a microbiota fúngica.
Reagan et al. (1990) e Voss et al. (1994) afirmam que a colonização por cepas
idênticas de Candida frequentemente desenvolvem infecções disseminadas. Segundo estes
autores, os fungos podem invadir algum nível da parede do esôfago e a invasão dos vasos
sanguíneos da mucosa e submucosa pode ocasionar candidíase invasiva.
A candidíase esofágica é observada na obstrução funcional ou mecânica do esôfago
com estase o que favorece o crescimento excessivo do fungo (Wilcox; Karowe, 1994, Yee;
Wall, 1994). Para atingir a corrente sangüínea as leveduras do gênero Candida necessitam
translocar as barreiras físicas, tais como as camadas de células epiteliais, seja através de
penetração ativa e/ou da endocitose induzida (Zakikhany et al., 2007).
Segundo os resultados obtidos por Filler e Kullberg (2002), uma vez no sangue a
levedura pode disseminar-se pelo organismo causando infecções sistêmicas em diversos
órgãos.
Diversos autores concordam que o trato gastrointestinal é considerado a maior porta
de entrada para candidíase disseminada, uma vez que leveduras deste gênero
freqüentemente superinfectam úlceras presentes na mucosa por outras causas clínicas. Por
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
20
esta razão, a candidíase sistêmica embora seja uma complicação incomum é passível de
ocorrer a partir da colonização do trato gastrointestinal e encontra-se associada a altas
taxas de mortalidade principalmente em pacientes cirúrgicos (Washington et al., 1991,
Prescott et al., 1992, Lamps et al., 2000).
A translocação da levedura através de sítios do trato gastrointestinal pode culminar
em candidemia. Acredita-se que a maioria dos casos seja adquirida por via endógena,
devido à rica colonização por Candida, o que ocorre em até 70% da população normal.
Métodos de genotipagem apresentam a similaridade entre cepas colonizantes e infectantes,
comprovando a provável origem endógena da maioria das infecções por tais patógenos
(Cole et al., 1996, Nucci; Anaisse, 2001).
Em 1963, eram conhecidas apenas cinco espécies como agentes de doenças em
humanos, incluindo C. albicans, C. parapsilosis, C. tropicalis, C. stellatoidea e C.
guilliermondii. Atualmente, são conhecidas cerca de dezessete espécies de Candida
agentes de micoses superficiais ou invasivas em seres humanos (Dignani et al., 2003).
As principais espécies de interesse clínico são: C. albicans, C. parapsilosis, C.
tropicalis, C. glabrata, C. krusei, C. guilliermondii e C. lusitaniae. Entretanto, número
progressivo de casos de doenças superficiais e invasivas, em diferentes sítios anatômicos,
relacionadas e espécies emergentes de Candida tem sido descrito com o isolamento de C.
dubliniensis, C. kefyr, C. rugosa, C. famata, C. utilis, C. lipolytica, C. norvegensis, C.
inconspicua entre outras (Coleman et al., 1998, Richardson; Flörl, 2008).
Em contraste com o que ocorre na América do Norte e Europa, C. parapsilosis e C.
tropicalis são as espécies responsáveis pela grande maioria das infecções por espécies nãoC. albicans no Brasil (Colombo et al., 1999, Antunes et al., 2004, Pasqualotto et al., 2005).
C. glabrata tem sido considerada um fungo sapróbio, relativamente não patogênico
que compõe a microbiota normal de indivíduos saudáveis, raramente causando infecções
graves em humanos. Todavia, devido ao aumento no uso de terapia imunossupressiva
associada à terapia antimicótica de amplo espectro, a freqüência de infecções de mucosa e
sistêmica causadas por esta espécie tem aumentado significativamente (Hitchcock et al.,
1993, Wingard et al., 1993, Knoke et al., 1997). De fato, dependendo do sítio de infecção,
C. glabrata é considerada a segunda ou terceira causa mais comum de candidíase seguindo
C. albicans.
Infecções invasivas por C. guilliermondii ainda são infreqüentes; contudo, esta
espécie vem sendo reconhecida por diferentes autores como agente emergente. A maioria
dos casos descritos relaciona-se a pacientes com câncer (Colombo; Guimarães, 2003).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
21
C. krusei exibe a capacidade de disseminar-se endogenamente a partir do trato
gastrointestinal, particularmente em pacientes com hematopatias malignas. Diversos
trabalhos relatam o aumento no número de pacientes granulocitopênicos com colonização
e infecção por esta espécie (Hautala et al., 2007, Richardson; Flörl, 2008).
O agente etiológico predominante da candidíase esofágica é C. albicans, um fungo
comensal da microbiota normal humana, capaz de causar um grande número de infecções
que variam desde superficiais mucosas a disseminadas (Sutclife et al., 1999, Traeder et al.,
2008). Todavia, de acordo com Kliemann et al. (2008), outras espécies tais como C.
tropicalis e C. krusei estão envolvidas.
Historicamente, C. albicans equivalia de 70 a 80% dos isolados obtidos de
pacientes infectados. C. glabrata e C. tropicalis equivaliam a aproximadamente 5 a 8% dos
isolados, enquanto outras espécies de Candida não-albicans raramente ocorriam. Contudo,
pesquisas revelam uma mudança micológica de C. albicans para as espécies não-albicans
tais como C. glabrata, C. tropicalis, C. parapsilosis e C. krusei, algumas destas altamente
resistentes aos antifúngicos convencionais (Wingard et al., 1993).
Nos últimos anos, vem aumentando o número de infecções esofágicas causadas por
espécies de Candida não-albicans e outras espécies de leveduras como Cryptococcus
neoformans. Ademais, fungos filamentosos como Aspergillus e Histoplasma capsulatum
também podem ser causa rara de infecções neste órgão (Lamps et al., 2000, Kliemann et
al., 2008).
De acordo com Hube e Naglik (2001), a primeira etapa para o sucesso da
colonização, com subseqüente infecção da superfície mucosa por C. albicans, é a adesão.
C. albicans não somente induz sua própria endocitose como também penetra ativamente
através dos tecidos. Enzimas hidrolíticas secretadas podem auxiliar a levedura durante o
processo de invasão através da destruição de componentes da superfície celular hospedeira
e fatores imunes ou através da extração de nutrientes para o próprio fungo.
Sanglard et al. (1997) e Felk et al. (2002) relatam que a invasão de C. albicans na
célula hospedeira é um processo multifatorial o qual precisa ser regulado apropriadamente.
A percepção de condições como o pH extracelular torna-se crucial, além da formação de
hifas pelos isolados, reduzida sob condições alcalinas.
Baseado nos achados de Gow (2002), outro fator de virulência importante de C.
albicans é a habilidade de mudança entre as formas de crescimento ovóide e hifal,
características do dimorfismo.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
22
Dignani et al. (2003) afirmam que C. albicans possui elevado potencial, cujos
principais fatores de patogenicidade e virulência são a capacidade de aderência a diferentes
mucosas e epitélios, o dimorfismo com produção de estruturas filamentosas que auxiliam
na invasão tissular, a termotolerância significativa e a produção de enzimas como proteases
e fosfolipases.
Hube (2004) propõe que células de leveduras são mais susceptíveis a realizar
infecção quando as formas hifais participam da invasão tecidual. Adicionalmente, a
habilidade de reconhecer e se adaptar às mudanças ambientais, como meios alcalinos ou
ácidos, são propriedades importantes de C. albicans. Este autor relata que, durante os
diferentes estágios da infecção por esta espécie no tecido hospedeiro, sob condições
favoráveis, a levedura expressa fatores de virulência específicos, adaptando-se como
parasita.
Apesar do modo de reprodução clonal de C. albicans há diferenças claras entre
isolados clínicos e nem todos isolados desta mesma espécie apresentam propriedades
biológicas semelhantes. Tipificação de seqüência multilocus foi usada para demonstrar que
pacientes adultos com fungemia são usualmente infectados com seus próprios isolados
endógenos e comensais de Candida. Ainda permanece em debate se variações genéticas
intra-específicas podem estar associadas com diferentes capacidades de virulência (Tavanti
et al., 2005, Odds et al., 2006).
Thewes et al. (2008) concluíram que diferenças fenotípicas observadas entre
isolados de C. albicans ocorrem devido a mudanças nos níveis de expressão de certos
genes e/ou devido às diferenças na função das proteínas codificadas (causadas por
modificações mínimas de seqüência). Estas diferenças exibem impacto na formação das
hifas, captação de ferro, resposta a estresses, metabolismo de fosfato e virulência desta
espécie. Estes mesmos autores verificaram que isolados desta levedura exibiram
características genéticas comuns com base em análises de rDNA, embora não se saiba
porque aparentes diferenças entre os isolados de uma mesma espécie influenciem na
capacidade de causar infecção.
2.3.1 Fatores predisponentes para candidíase esofágica
Baseado no trabalho de Simon et al. (1997), o uso prolongado de corticosteróides
inalantes pode promover o aparecimento de candidíase esofágica, usualmente precedida
por colonização ou lesão em cavidade oral causada por espécies de Candida. Os estudos de
23
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
Bailey et al. (1998) comprovam que pacientes tratados com esteróides apresentam risco
elevado de candidíase esofágica secundária à infecções pelo herpes simplex e
citomegalovírus.
Os
principais
fatores
predisponentes
para
candidíase
esofágica
são
imunossupressão, doença esofágica prévia e outras condições que aumentem o crescimento
de Candida no trato digestivo. Diversas doenças endócrinas, incluindo diabetes mellitus,
hipotireoidismo, hipoparatireoidismo e hipoadrenocorticismo (Phaosawasdi et al., 1986),
bem como câncer, terapia com corticosteróides ou drogas citotóxicas e, mais recentemente
a infecção pelo Vírus da Imunodeficiência Humana (HIV), são causas conhecidas de
imunossupressão e, desta forma, fatores de risco para esta micose (Gornig et al., 1997).
Interessantemente, desde o início da década de 80, a maioria dos estudos desta micose
envolvia pacientes HIV-positivos (López-Dupla et al., 1992, Chaisson et al., 1998).
Na era da terapia antiretroviral altamente ativa (HAART) ocorreu uma diminuição
das doenças oportunistas relacionadas à imunodeficiência (especialmente desordens
associadas com contagens de linfócitos T CD4+ abaixo de 50-100 células/µL), se
comparado com os anos que precederam a introdução de combinações antiretrovirais
potentes em 1996. Todavia, experiências recentes provaram que as infecções oportunistas
ainda são as maiores causas de morbidade e mortalidade na era HAART. Como
conseqüência a candidíase esofágica permaneceu como uma das doenças oportunistas mais
freqüentes em pacientes com AIDS, mesmo após uma década da introdução dos
antiretrovirais (Manfredi et al., 2001, Manfredi et al., 2007).
A má nutrição, alcoolismo, idade avançada e terapia com corticosteróides, tanto
sistêmicos como inalados, são fatores que facilitam o desenvolvimento desta patologia
segundo diversos pesquisadores (Baehr; Mcdonald, 1994, Wilcox; Karowe, 1994, Simon et
al., 1997, Weerasuriya; Snape, 2006). Corticosteróides administrados sistematicamente
predispõem à infecção, suprimindo tanto as funções dos linfócitos quanto dos granulócitos.
Além deste efeito, estas drogas inaladas podem depositar-se no esôfago após a deglutição e
facilitar colonização e subseqüente infecção por Candida (Baehr; Mcdonald, 1994, Simon
et al., 1997).
Wingard (1995) e Marr et al. (2000) relatam que C. tropicalis possui considerável
potencial biológico como agente oportunista quando o hospedeiro encontra-se
neutropênico, quando há supressão da microbiota bacteriana pelo uso de antimicrobianos e
danos na mucosa gastrointestinal.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
24
Inibidores de bomba de ácidos têm sido amplamente utilizados e alguns relatos
referem o uso de omeprazol com o desenvolvimento de candidíase esofágica (Larner;
Lendrum, 1992, Mosiman, 1993, Sood et al., 1995). Adicionalmente às propriedades dos
inibidores das bombas de prótons, o omeprazol tem apresentado efeito inibidor dos efeitos
citotóxicos dos linfócitos in vivo e da secreção salivar, facilitando o crescimento de
Candida na cavidade oral e subseqüente disseminação através do trato digestivo (Teare et
al., 1993, Scaringi et al., 1996).
Culturas quantitativas foram desenvolvidas por Karmeli et al. (1995) em amostras
de suco gástrico obtidas de 12 pacientes ambulatoriais com esofagite antes e um mês
depois de terapia com omeprazol. Aumento no número de pacientes com cultura positiva
foi observado. Segundo estes autores, o espectro de micro-organismos isolados do suco
gástrico foi idêntico ao da microbiota normal da cavidade oral, especialmente quanto às
bactérias e espécies de Candida, sendo reflexo da deglutição da microbiota oral capaz de
sobreviver em ambiente com pH ácido.
Martínez et al. (2000) investigaram o emprego de omeprazol em seis pacientes com
candidíase esofágica e relacionaram o desenvolvimento desta micose ao uso desta droga.
Além disso, os autores descreveram dados similares quando na presença de co-fatores tais
como neoplasias, antibiótico ou corticoidoterapia.
Segundo Jimenez-Alonso et al. (2003) e Ebert (2006), o esvaziamento insuficiente
do esôfago, terapia imunossupressora e supressão ácida predispõem à esofagite por
Candida.
Gupta et al. (1994) e Koh et al. (2008) afirmam que nos pacientes com câncer e
transplantados de medula óssea, as drogas anti-câncer administradas causam como efeito
indesejado a supressão do sistema imunológico humano. Esta condição permite que a
levedura se dissemine e cause infecções em sítios corpóreos variados, até mesmo
fungemia.
A candidíase esofágica em pacientes mais jovens sugere a associação entre esta
micose e o uso de esteróides inalatórios, antibióticos e terapia supressora da produção de
ácidos bem como diabetes mellitus, câncer e HIV (Chocarro; Martinez, 2000, Kanda et al.,
2003, Yakoob et al., 2003, Boktour et al., 2004, Khosravi et al., 2008).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
25
2.3.2 Sinais, sintomas e casos clínicos da candidíase esofágica
Sinais e sintomas de infecções fúngicas do trato gastrointestinal são geralmente
similares, independente das espécies envolvidas e incluem diarréia, vômitos, melena,
sangramento, dor abdominal e febre (Sheehan, 2008). Contudo, segundo Lamps (2008),
infecções fúngicas esofágicas usualmente apresentam sintomas característicos e podem
ocorrer devido à presença de doenças de base, seus tratamentos ou ambos.
Chen e colaboradores (2007) afirmam que pacientes com esofagite infecciosa aguda
usualmente apresentam no decorrer da doença odinofagia, disfagia e, algumas vezes,
complicações severas tais como sangramento, perfuração ou disseminação dos agentes
etiológicos.
Na candidíase esofágica, complicações severas como sangramento do trato
digestivo, perfuração e disseminação sistêmica são observadas como consta nos achados de
Gaissert et al. (1999). Candidíase sistêmica tem sido relatada em 15% dos pacientes com
leucemia e 11% dos transplantados renais (Gupta et al., 1994) e, de acordo com Cole et al.
(1996), devido aos riscos de disseminação, o estudo desta micose tem se tornado relevante.
Holt (1968) descreveu 13 casos de pacientes com neutropenia, 10 do sexo feminino
e três do masculino, que apresentaram esofagite por Candida. Em sete casos foram
diagnosticados como agente etiológico C. albicans e em um, C. krusei. Nos demais, os
agentes não foram identificados ao nível de espécie pelo autor. C. albicans era a única
espécie considerada agente etiológico desta doença, sendo o isolamento de C. krusei ponto
de partida para estudos mais detalhados acerca das possíveis espécies de Candida
emergentes.
Entre 3.501 indivíduos avaliados por Naito et al. (1988), 49 apresentaram sinais
para candidíase esofágica, incluindo 17 com câncer, 14 com desordens imunológicas,
quatro com diabetes mellitus, sete com outras doenças de base e sete aparentemente
saudáveis. Invasão sistêmica por fungo foi observada na maioria dos pacientes com câncer
envolvendo o sistema hematopoiético e tratados com corticóides, antibióticos ou agentes
anticâncer. Embora as complicações associadas com candidíase esofágica sejam raras, os
autores enfatizaram que pacientes com imunidade afetada deveriam ser cuidadosamente
examinados para esta micose, a fim de prevenir o desenvolvimento de formas invasivas.
Thapa e Kumar (1989) consideram candidíase esofágica uma doença incomum em
crianças, relacionando-a a alterações na defesa imunológica celular primária ou secundária,
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
26
como linfomas, leucemias e estados de imunossupressão. Todavia, os autores relataram
esta micose em duas crianças com sintomas de disfagia e dor retroesternal.
Vermeersch e colaboradores (1989) isolaram fungo no esôfago de 37% dos
pacientes selecionados para realizar endoscopia do trato gastrointestinal superior. Porém,
baseados em número de colônia acima de 100 e/ou presença de pseudohifa, apenas 11%
foram considerados com micose. Por outro lado, Kusne et al. (1994) reportaram a presença
de fungo no esôfago de 75% dos pacientes com doença hepática avançada, avaliados para
transplante; todavia, o método utilizado não fez referência aos casos com esofagite.
Young et al. (1993) avaliaram endoscopicamente sete pacientes diagnosticados para
esofagite fúngica por um período de 12 anos em hospital universitário de Taiwan,
República da China. O agente etiológico mais isolado foi C. albicans, seguido por C.
krusei, Trichosporon beigelii e Rhodotorula rubra, apesar de exibirem aspectos
endoscópicos semelhantes das lesões. A porção mais baixa do esôfago foi a mais
freqüentemente envolvida. Apenas um paciente apresentou lesão de cavidade oral. A
maioria dos pacientes não apresentou sintomas típicos de esofagite tais como disfagia ou
odinofagia.
Sutclife et al. (1999) descreveram um caso de bola fúngica no esôfago em mulher
iraniana de 54 anos que foi diagnosticada para leucemia promielocítica, iniciando sintomas
de disfagia durante o quarto ciclo de quimioterapia. Durante estado de neutropenia severa,
foi realizado tratamento empírico para esofagite por fungo ou viral com anfotericina B e
aciclovir. C. glabrata sensível ao fluconazol foi isolada do tecido biopsiado, iniciando-se
tratamento com derivado azólico.
Péter e colaboradores (2000) avaliaram 100 pacientes com doença hepática por
consumo de álcool, sendo 22 pacientes com sintomas dispépticos considerados como grupo
controle. 41,9% dos pacientes com a doença hepática e 13,6% do grupo controle
apresentaram fungo no esôfago. Segundo estes autores, significativamente mais pacientes
com doença hepática apresentaram esofagite por fungo e a taxa de colonização do esôfago
também foi mais elevada.
Underwood et al. (2003) revisaram 42 casos de pacientes com candidíase esofágica
diagnosticados por endoscopia para caracterizar a micose e suas condições predisponentes.
Apenas dois pacientes apresentaram associação com malignidade. Outros possíveis fatores
predisponentes foram terapia ácido-supressiva (14 pacientes), cirurgia gástrica prévia
(cinco), dano da barreira mucosa (quatro), uso de esteróides inalatórios (quatro), uso de
esteróide oral (três), desordens relacionadas à motilidade esofageal (três), doenças
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
27
reumatológicas (três), uso prévio de antibióticos (dois), diabetes mellitus (dois), ocorrendo
em alguns casos associação de mais de um fator.
Bonavina et al. (2003) estudaram a prevalência de colonização por Candida em 131
pacientes com doença esofágica que foram submetidos a processos cirúrgicos e em 40
voluntários saudáveis através de swab da cavidade oral e faríngea. Colonização por
Candida foi mais freqüente em pacientes com doença esofágica do que nos indivíduos
controle, sendo a prevalência mais alta em indivíduos com carcinoma do que naqueles com
doenças benignas.
Seis homens e quatro mulheres imunocompetentes com idade entre 48 e 82 anos,
foram diagnosticados para candidíase esofágica através de endoscopia por Cortés et al.
(2004). Seis pacientes apresentaram baixa contagem de linfócito T CD4 e sete tiveram
baixa contagem de linfócitos CD8. Todos os pacientes foram tratados com fluconazol oral
em doses de 150mg/dia por 14 dias, com completa resolução das lesões. Os autores
concluíram que pacientes com esta micose têm frequente alteração da imunidade celular
necessitando de diagnóstico precoce e tratamento adequado.
Baseado em Mocroft et al. (1997) e Vazquez (2003), esofagite por Candida ocorre
em 10-15% dos pacientes com AIDS e apresenta sintomas como disfagia, odinofagia e dor
retroesternal. Tipicamente diagnosticados em altas contagens de linfócitos T CD4 (Crowe
et al., 1991), esta doença estava associada com longevidade (Luo et al., 1995, Mocroft et
al., 1997), se comparada a outras doenças que definem AIDS.
Mocroft et al. (2005) descreveram as mudanças no uso de medicação antimicótica,
a incidência de candidíase esofágica e fatores de risco associados com esta doença antes e
depois do início da HAART. De um total de 9.873 pacientes que não apresentavam
esofagite por Candida no início das investigações, 537 (15,8%) subseqüentemente
desenvolveram esta micose após uso de anti-retrovirais. Pacientes mais velhos e aqueles
com baixa contagem de linfócitos T CD4 apresentaram a mais alta incidência de esofagite
por Candida na era pós-HAART.
Segundo Raufman (2005), na última década ocorreu redução significativa no
número de casos de candidíase esofágica em pacientes infectados pelo HIV, sendo
justificada pelos benefícios imunológicos obtidos a partir das terapias anti-retrovirais.
Esofagite por Candida é considerada um forte indício de prognóstico desfavorável
em pacientes idosos dos quais aproximadamente 50% morreram dentro de seis meses do
diagnóstico, enquanto 90% do controle sobreviveram por mais de um ano (Weerasuriya;
Snape, 2006).
28
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
Pasqualotto et al. (2006), no período de Outubro de 1997 a Outubro 2003, isolaram
C. guilliermondii das amostras clínicas obtidas por biópsia esofágica de oito pacientes,
especialmente com AIDS.
Iglesias e Gómez (2006) relataram um caso de uma mulher de 72 anos com disfagia
mecânica
causada
por
Candida,
etiologia
considerada
pouco
freqüente
em
imunocompetentes. Segundo estes autores, diversos fatores predisponentes se relacionam
com o aparecimento desta micose, devendo-se considerar a possibilidade mesmo na
ausência de uma doença de base. A paciente fez uso de antibiótico por oito dias, dois
meses antes da consulta e diagnóstico da esofagite, sendo considerado pelos autores o fator
de risco. A endoscopia digestiva alta auxiliou no diagnóstico, confirmando-se a etiologia
ao exame micológico.
Weerasuriya e Snape (2006) investigaram a ocorrência de candidíase esofágica em
população mais velha que 65 anos, comparando com pacientes controles de idade e sexo
compatíveis. Patologias associadas ao trato gastrointestinal superior, como candidíase, e os
riscos associados foram avaliados. Características clínicas clássicas associadas com doença
esofágica foram relativamente incomuns: disfagia em 14% dos casos, candidíase
orofaríngea em 2% e dispepsia em 2%, enquanto anemia e perda de peso foram as
principais indicações para endoscopia. Câncer, doença pulmonar obstrutiva crônica e o uso
de antibióticos estavam associados com esta micose, enquanto nenhuma associação foi
observada com diabetes mellitus.
Chen et al. (2007) descreveram um caso de esofagite combinada causada pelo vírus
herpes simplex e Candida em uma paciente urêmica de 57 anos, a qual realizava contínua
diálise peritoneal há três anos. A paciente veio a óbito após sépsis progressiva e falência
respiratória.
Cinco casos de candidíase esofágica foram descritos em pacientes com lúpus
eritematoso sistêmico em hospital suíço entre 1990 e 2004. O uso prolongado de
corticoidoterapia foi destacado pelos autores como principal fator de risco para esta micose
(Khalifaa et al., 2007).
Para os pacientes imunocomprometidos, os patógenos mais frequentemente
isolados são espécies de Candida, citomegalovírus e o vírus herpes simplex, embora
etiologias mais raras não possam ser excluídas (Mastroianni et al., 1999, Chen et al.,
2007).
Vidal et al. (2007) avaliaram biópsias esofagianas de 227 pacientes com AIDS,
identificaram os agentes e verificaram a associação entre os achados endoscópicos e
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
29
histológicos. Espécies de Candida foram os agentes mais encontrados, seguidas de
citomegalovírus, herpes e micobactérias. A presença de placas sugeriu o diagnóstico de
candidíase esofágica. Os autores reconhecem a alta prevalência e a importância de estudos
acerca desta micose neste grupo de pacientes.
Segundo Manfredi et al. (2007), baixa contagem absoluta de CD4+ nem sempre
pode ser considerada fator de risco independente em pacientes acometidos de candidíase
esofágica. Os autores reportaram esofagite por C. albicans em paciente com AIDS com
contagem de linfócitos CD4+ de 1.025 céls/μL, o qual apresentou dois episódios
recorrentes. Foram considerados como co-fatores a aderência insuficiente ao tratamento
com conseqüente replicação viral e imunossupressão celular.
Traeder et al. (2008) analisaram 15.000 pacientes internados com AIDS, entre 1985
e 2007, constatando aumento na incidência de espécies não-albicans como agentes de
candidíase esofágica e diminuição no número de casos de infecções oportunistas como
pneumonia por Pneumocystis carinii (atualmente denominado Pneumocystis jiroveci),
toxoplasmose cerebral, dentre outras, desde a introdução dos anti-retrovirais. Todavia, a
incidência de candidíase esofágica permaneceu tão elevada quanto nos anos antes da era
HAART. Segundo os autores, esta observação pode refletir o desenvolvimento de
resistência ao fluconazol através da seleção de espécies não-albicans como conseqüência
de terapia profilática em pacientes HIV+ ao longo dos anos.
De acordo com Kliemann et al. (2008), estudo realizado em centro médico
brasileiro no período de 18 meses identificaram 158 casos positivos para candidíase
esofágica de um total de 21.248 endoscopias do trato digestivo alto. A maioria das
infecções foi causada por C. albicans (96,2%), seguido por C. tropicalis (2,5%), C.
lusitaniae (0,6%) e C. glabrata (0,6%), acometendo com discreta predominância o sexo
feminino (51,3%) entre 21 e 88 anos de idade. Os autores concluíram que infecção por
espécies não-albicans não está relacionada à presença de nenhum fator predisponente
específico, ressaltando a importância de pesquisas neste sentido.
De acordo com o trabalho de Lamps (2008), infecções do esôfago ocorrem em
indivíduos aparentemente imunocompetentes; contudo, a maioria dos casos relaciona-se
fortemente ao grau de imunodeficiência ou doença de base.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
30
2.4 DIAGNÓSTICO DA CANDIDÍASE ESOFÁGICA
A endoscopia digestiva alta é o procedimento diagnóstico de eleição para
candidíase esofágica na atualidade; porém, a confirmação da esofagite deve ocorrer com o
histopatológico da mucosa ou exame citológico da raspagem esofágica (Wilcox; Schwartz,
1996, Vidal et al., 2007).
Os locais indicados para a realização de biópsias ou escovados para citologia,
histologia e culturas dependem dos achados endoscópicos (Wilcox; Karowe, 1994),
podendo ser observadas placas esbranquiçadas aderidas à mucosa esofágica, às quais
recobrem uma mucosa ulcerada. A resposta inflamatória associada varia desde mínima
reação tecidual (em pacientes imunocomprometidos) a infiltrados neutrofílicos
prominentes, formação de abscesso, erosão/ulceração e necrose; contudo, granulomas são
ocasionalmente vistos (Chandler; Watts, 1987, Attwood; Lamb, 2008).
A classificação endoscópica é utilizada para avaliar o grau de infecção por Candida
em: Grau 1 - caracterizado pela visualização de placas esparsas, comprometendo menos
que 50% da mucosa esofágica, sem ulceração; Grau 2 - placas esparsas, comprometendo
mais que 50% da mucosa esofagiana, sem ulceração; Grau 3 - placas confluentes, que
cobrem circunferencialmente pelo menos 50% da mucosa, com ulceração; e Grau 4 placas circunferenciais, presença de ulceração, estenose e estreitamento do lúmen, não
reversíveis à insuflação (Wilcox; Schwartz, 1996, Attwood; Lamb, 2008).
O diagnóstico desta micose é realizado através da demonstração de estruturas e
culturas fúngicas. Alguns autores afirmam que a análise da invasão tecidual pelo fungo é
menos sensível nos métodos que empregam fixação com formalina devido à provável
remoção das estruturas fúngicas superficialmente localizadas (Vermeersch et al., 1989,
Lamps, 2008).
Os fungos podem ser detectados através de exames histopatológicos; todavia, para
classificar o agente segundo a espécie a cultura é considerada o padrão ouro, além dos
testes fisiológicos de identificação taxonômica para leveduras. Outros métodos
diagnósticos podem ser considerados aliados à cultura como testes sorológicos,
antigênicos, imunohistoquímicos e moleculares (Lamps, 2008). A taxonomia clássica das
leveduras baseia-se fundamentalmente no uso de características morfológicas e fisiológicas
(Barnnet et al., 2000; De Hoog et al., 2000). No entanto, para detecção dos padrões de
similaridade intra-específica, estas características não são suficientes. Em contraste,
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
31
métodos moleculares são universalmente aplicados e fornecem segurança (Dendis et al.,
2003).
A tipagem do DNA de isolados de Candida obtidos de amostras clínicas de
pacientes com AIDS e candidíase oral e esofágica indica uma distribuição idêntica na
freqüência daqueles isolados presentes em indivíduos saudáveis. Isto sugere que candidíase
associada a AIDS não é causada por isolados virulentos particulares, mas provavelmente
resulta de falhas no mecanismo de defesa do hospedeiro (Boerlin et al., 1996).
Mannarelli e Kurtzman (1998), utilizando um sistema de primers espécieespecíficos, identificaram 14 espécies patogênicas de Candida e estabeleceram relação
evolutiva entre os isolados, comprovando ser esta técnica bastante rápida e de fácil
interpretação.
Walsh et al. (1988) destacaram a utilidade do espécime obtido por biópsia da
mucosa endoscopicamente diagnosticada. Em 1989, Vermeersch e colaboradores relataram
a importância da cultura da amostra clínica para o diagnóstico da espécie de fungo
envolvida na infecção; contudo alertaram para a possibilidade de resultados falso positivos,
através do isolamento de sapróbios.
Baehr e McDonald (1994) alertaram que o aparecimento de sinais esofágicos e
sintomas não ocorrem necessariamente devido a processos infecciosos e, possíveis
diagnósticos alternativos como danos induzidos por alta secreção de ácidos pépticos, ação
medicamentosa ou anormalidades estruturais/ funcionais do esôfago, não devem ser
excluídos nos pacientes imunodeficientes.
Um total de 933 pacientes com odinofagia e disfagia foi incluído em estudo
realizado por Badarinarayanan et al. (2000) na Índia. Endoscopia do trato gastrointestinal
superior foi realizada em todos os pacientes e amostras de tecidos obtidas por biópsia
foram retiradas dos locais das lesões. Após triagem, 56 pacientes foram positivos para
fungos como agentes etiológicos. A cultura foi considerada o método mais confiável. C.
albicans (87,5%) foi o patógeno predominante seguido por C. tropicalis (8,9%). Esta
investigação sugeriu a possibilidade de candidíase esofágica em pacientes mesmo na
ausência de fatores predisponentes, tais como infecção pelo HIV ou condições que
comprometam o sistema imune, sendo atribuídos os casos positivos à precariedade de
higiene pessoal e razões sócio-econômicas.
Paillaud et al. (2004) descreveram características clínicas classicamente associadas
com doença esofágica como odinofagia, disfagia, desconforto epigástrico e candidíase
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
32
esofágica. Estes achados sugerem que esta doença em pacientes idosos pode estar
relacionada à má nutrição por dieta pobre em proteínas.
Pesquisa realizada por Vidal et al. (2007) acerca das associações significativas
entre o diagnóstico histopatológico e os aspectos endoscópicos da esofagite, constataram
formação de placas por Candida em 89% dos pacientes.
De um total de 107 pacientes com leucemia investigados, Gorschlüter et al. (2008)
diagnosticaram clinicamente através de endoscopia alta 12 casos de esofagite
exclusivamente por Candida (11,3%) e quatro casos de esofagite por Candida associada
com doença de refluxo (3,8%). Interessantemente, este diagnóstico não foi confirmado
pelos autores em nenhum dos oito pacientes nos quais a indicação para a endoscopia foi
dor retroesternal ou suspeita para candidíase esofágica. Vale ressaltar que a incidência
desta micose nos pacientes investigados foi mais comum naqueles que receberam
antifúngico profilático (predominantemente itraconazol).
Woittiez et al. (2008) relataram caso de um homem caucasiano de 48 anos, com
sintoma de disfagia, dor, regurgitação após ingestão de alimentos sólidos e perda de peso.
Ao exame endoscópico, a mucosa estava revestida por placas esbranquiçadas, sugestivas
para candidíase esofágica. Uma vez que a hipótese diagnóstica era câncer, múltiplas
biópsias foram realizadas. Contudo, exame histopatológico revelou epitélio escamoso com
infiltração neutrofílica e presença de Candida sem sinais de malignidade.
2.5 ESOFAGITE EXPERIMENTAL
Hoshika e colaboradores testaram e comprovaram em 1996 a hipótese de que os
mecanismos de aderência em C. albicans com inserção subepitelial ocorrem devido ao
simples contato com a mucosa esofágica de animais imunocompetentes. Candidíase
esofágica foi observada em 14 dos 15 ratos que receberam suspensões da levedura por 13
dias.
Walsh et al. (2000) selecionaram, após teste de susceptibilidade in vitro, isolados
de C. albicans resistentes e sensíveis ao fluconazol para testes experimentais de candidíase
orofaríngea e esofágica. Após o tratamento com a referida droga, verificaram redução
significativa no número de unidades formadoras de colônias (UFC) obtidas de amostras
dos animais desafiados com isolados sensíveis ao fluconazol, quando comparados ao grupo
com isolados resistentes, os quais, neste último caso, resultaram em insucesso terapêutico.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
33
Em estudo com modelo animal imunocompetente, Arendrup et al. (2002) avaliaram
oito espécies de Candida quanto ao grau de patogenicidade, sendo C. albicans e C.
tropicalis consideradas as mais patogênicas, seguidas por C. glabrata, C. lusitaniae, C.
kefyr, C. parapsilosis, C. krusei e C. guilliermondii. Esta classificação hierárquica foi
baseada na mortalidade, número de rins infectados, contagem de UFC no tecido,
capacidade de envolvimento ocular e achados histopatológicos nos rins. Há algum tempo
sabe-se que diferentes cepas de C. albicans podem exibir níveis diferentes de virulência e
que a invasão dos isolados em modelo experimental de candidíase oral pode apresentar-se
variável (Bartie et al., 2004).
Ishibashi et al. (2007a), desenvolveram método experimental para candidíase
esofágica com sintomas locais característicos. Os camundongos foram imunossuprimidos
com o corticosteróide prednisolona. Sob sedação, foram infectados com concentração de 4
x 107 células viáveis de C. albicans através de seringa intra-esofágica. A partir do terceiro
dia de infecção, os autores observaram lesões características para a micose, sendo tratados
com solução oral de itraconazol. Estes autores reforçaram o sucesso terapêutico em
substituição de solução intra-gástrica deste antifúngico, a partir de trabalho posteriormente
desenvolvido (Ishibashi et al., 2007b).
Koh et al. (2008) imunossuprimiram os animais com drogas anti-câncer e
colonizaram o trato gastrointestinal de camundongos com C. albicans, concluindo que a
baixa contagem de neutrófilos, os danos no trato gastrointestinal, bem como a habilidade
da célula mudar da forma leveduriforme para a filamentosa, são necessários para causar
infecção sistêmica por C. albicans.
2.6 TERAPIA ANTIFÚNGICA NA CANDIDÍASE ESOFÁGICA
A terapia antifúngica na candidíase esofágica é comumente instituída através do
uso de antimicóticos sistêmicos incluindo polienos e principalmente, azólicos. A meta da
terapia é o alívio dos sintomas e prevenção de recidiva, uma vez que é rara a erradicação
da infecção (Barchiesi et al., 2003, Vazquez, 2003, Traeder et al., 2008).
O aumento em 30% desde 2000 na disponibilidade de agentes para o tratamento de
infecções fúngicas tem atingido apenas 15 fármacos atualmente aprovados para uso clínico
(Gogtay et al., 2008, Thompson et al., 2009).
Diferenças no espectro de atividade antifúngica, biodisponibilidade, formulação,
interações medicamentosas e efeitos colaterais são fatores que elegem a terapia ideal a ser
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
34
instituída sendo, portanto, indispensável o conhecimento detalhado das classes de drogas
(Traeder et al., 2008, Thompson et al., 2009).
De acordo com Graybill (1992), o primeiro agente antifúngico absorvido por via
oral foi o cetoconazol, mas seu emprego rotineiro para infecções por Candida tornou-se
restrito, em virtude de sua pequena absorção, numerosas interações medicamentosas e
efeitos colaterais como hepatotoxicidade, alteração da síntese de testosterona e de
esteróides. Igualmente, tratamentos tópicos a base de clotrimazol e nistatina para
candidíase esofágica mostraram-se pouco eficazes como relatado por Darouiche (1998).
Demuria et al. (1993), afirmam que triazóis exercem alterações na membrana
celular fúngica através da inibição do citocromo P450 e da enzima 14-α-demetilase,
impedindo a conversão de lanosterol para ergosterol. Este mecanismo resulta no acúmulo
de substâncias tóxicas e conseqüente inibição do crescimento celular e replicação,
resultando na ação fungistática ou fungicida in vitro espécie-dependente. Dentre os
triazóis, fluconazol é comumente utilizado na terapia de candidíase esofágica devido à sua
biodisponibilidade, penetração tecidual, tolerabilidade e reduzidos efeitos colaterais.
Ainda, este fármaco possui absorção oral inalterada mesmo em pacientes que recebem
terapia ácido-supressiva como os inibidores da bomba de prótons/H2-bloqueadores.
A introdução de agentes antifúngicos triazólicos orais como o fluconazol em 1990 e
o itraconazol em 1992, marcou um importante avanço no tratamento das infecções por
Candida, relacionado à eficácia e segurança. O fluconazol pode ser absorvido em qualquer
pH gástrico, com efeitos mínimos sob a síntese de esteróides (Redding et al., 1994,
Kauffman, 1996).
Existem opiniões que reforçam a escolha do fluconazol no tratamento da candidíase
esofágica. Barbaro et al. (1996) avaliaram a eficácia do fluconazol e itraconazol após
tratamentos por longos períodos em 2.213 humanos HIV-positivos com primeiro episódio
de candidíase esofágica. Os autores observaram cura endoscópica e clínica em 96% dos
doentes tratados com fluconazol e em 65,6% dos tratados com itraconazol, apresentando
clara diferença de sucesso terapêutico. Entretanto, algumas espécies de Candida
apresentam alta resistência intrínseca (C. krusei) ou resistência intermediária (C. glabrata)
ao fluconazol in vitro (Wingard et al., 1991, Redding et al., 1994).
Wilcox et al. em 1996 avaliaram por um período de 53 meses, através de um estudo
prospectivo com 134 pacientes HIV-positivos que apresentavam sinais e sintomas de
esofagite, a segurança e o custo benefício da introdução de fluconazol na profilaxia antes
do procedimento endoscópico. Destes, 68 pacientes receberam fluconazol profilático e em
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
35
uma semana, 56 (82%) apresentaram completa remissão dos sintomas. Dos 66 pacientes
submetidos à endoscopia, candidíase esofágica foi o achado mais comum em 42 pacientes
(64%), seguida de esofagite ulcerativa associada em 10 (15%). Segundo os autores, o
tratamento empírico foi mais vantajoso com relação ao custo benefício para pacientes HIVpositivos com sintomas esofágicos sugestivos.
Segundo Lange et al. (1997), itraconazol é outra opção terapêutica na esofagite, que
apesar de bem tolerado apresenta reações adversas, como a toxicidade, observadas em até
39% dos pacientes, exigindo assim a interrupção do tratamento. Em concordância,
Jaruratanasirikul e Kleepkaew (1997) confirmam o emprego positivo deste fármaco;
entretanto, ressaltam a necessidade durante o tratamento associado ao uso de antiácidos
(antagonistas de receptores de H2), da ingestão de alimentos e bebidas ácidas para uma
absorção máxima da droga.
Com base nos relatos de Samaranayake (1997), o uso excessivo de drogas
triazólicas, como o fluconazol (droga de escolha para candidíase esofágica) em pacientes
infectados pelo HIV contribui para o surgimento de espécies não-C. albicans como C.
krusei, que tem se destacado gradualmente como o patógeno mais comum em hospedeiros
imunossuprimidos. A autora enfatiza a importância da identificação do agente até o nível
de espécie, antes da instituição da terapia antifúngica.
Durante os primeiros anos da epidemia pelo HIV, poucos antifúngicos estavam
disponíveis (anfotericina B, nistatina, cetoconazol, fluconazol e itraconazol). Espécies de
Candida resistentes a estas drogas se espalharam rapidamente, tornando o insucesso
terapêutico um grande problema no final da década de 1980 até meados de 1990. A
introdução de suspensões de itraconazol em outubro de 1997 representou um avanço e, o
contínuo aprimoramento da terapia anti-retroviral, minimizou o problema das infecções
fúngicas por algum tempo (Smith et al., 1999, Koks et al., 2002).
De acordo com Bossche (1997) e Thakur et al. (2008) a falha terapêutica por
azólicos pode ser originada devido aos baixos níveis intracelulares da droga, gerando ação
insuficiente ou expressão acentuada das bombas de efluxo dos fármacos. Por outro lado,
Thakur et al. (2008) comprovaram que alterações genéticas na codificação de enzimas
responsáveis pela síntese de ergosterol causam diminuição da ação dos agentes
antifúngicos, especialmente de derivados triazólicos.
Silva et al. (2002) verificaram o aumento na freqüência de leveduras com
suscetibilidade diminuída ou resistentes aos antifúngicos e classificaram a resistência em
clínica e in vitro. Segundo os autores, a primeira pode ser conseqüência do baixo nível do
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
36
fármaco no sangue e diversos tecidos, devido à interação entre os fármacos ou à
imunodepressão do paciente. A resistência in vitro caracteriza-se quando cepas suscetíveis
se transformam em resistentes devido ao prévio contato com o antifúngico.
A análise de isolados de C. albicans, provenientes de pacientes com infecções
recorrentes, tem mostrado que a resistência ao fluconazol ocorre nas mesmas cepas que
anteriormente eram suscetíveis. Isso confirma os dados de estudos anteriores de que as
cepas são modificadas ao longo da exposição do paciente à droga (Morschhäuser, 2002).
Nucci e Colombo (2002) descreveram pacientes inicialmente infectados com
amostras suscetíveis de C. albicans que desenvolveram infecção pelo mesmo genótipo do
fungo, porém com concentração inibitória mínima (CIM) mais elevada após o uso do
fluconazol.
Böhme et al. (2003) consideram o fluconazol como droga de escolha para o
tratamento da candidíase esofágica pela sua segurança e tolerabilidade e por apresentar
uma rápida resposta clínica às infecções fúngicas. Todavia, profilaxia primária de rotina
não é recomendada desde 2003, como citado por Vazquez, devido à diminuição na eficácia
da medicação antifúngica e ao potencial para desenvolver resistência.
A resistência ao fluconazol por C. albicans é citada por Zardo e Mezzari (2004),
apresentando 93% de resistência cruzada ao itraconazol, podendo atingir até 45% dos
indivíduos que receberam tratamento prévio.
Pappas et al. (2004) enfatizam que fluconazol continua a ser a droga de escolha no
tratamento da candidíase orofaríngea e que pacientes que apresentem recidivas devem
permanecer em terapia profilática com este antifúngico até reconstituição total ou parcial
do sistema imunológico.
Goldman et al. (2005) avaliaram que o desenvolvimento de resistência ao
fluconazol, definido como a perda da resposta clínica a 200 mg de fluconazol por um
período de 14 a 21 dias, ocorreu em 4,1% dos pacientes que fizeram uso contínuo e em
4,3% daqueles que fizeram uso esporádico desta droga. Brion et al. (2007) destacaram a
importância do teste de sensibilidade a drogas antifúngicas in vitro para detectar espécies
resistentes e dose-dependentes.
A partir da década de 90, a ampla utilização do fluconazol na profilaxia e
tratamento de infecções fúngicas em pacientes imunocomprometidos tem resultado no
aumento da incidência de infecções por outras espécies de Candida diferentes de C.
albicans (Richardson; Flörl, 2008). Para Baddley et al. (2008), fluconazol é ativo contra
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
37
espécies de Candida, com exceção de C. krusei e alguns isolados de C. glabrata,
suscetíveis a doses mais elevadas.
Seguido à era HAART, o número de casos de esofagite por Candida atingiu os
níveis mais baixos em 1999. Porém, o número de casos voltou a aumentar nos anos
seguintes, excedendo atualmente àqueles da década de 1990. Como possível explicação
para este fenômeno, cita-se o uso de fluconazol profilático ou de manutenção.
Simultaneamente, a exposição prolongada a esta droga por uma população inteira pode
conduzir à emergência de diversas espécies de Candida (Traeder et al., 2008).
Traeder et al. (2008) relataram um caso de esofagite por Candida severa em
infectado pelo HIV, com 40 anos, com aderência incompleta à terapia antiretroviral e
contagem de células T CD4 variando entre zero e 150 células/mL. Após tratamento com
fluconazol, itraconazol, caspofungina, anidulafungina, posaconazole e anfotericina B
lipossomal apresentou insucessos terapêuticos com episódios recorrentes de candidíase
esofágica.
De 296 isolados de leveduras da cavidade oral de 292 pacientes infectados pelo
HIV com candidíase orofaríngea, atendidos no Muhimbili National Hospital da Tanzânia,
não foi observada diferença significante na distribuição das espécies entre os pacientes
com candidíase orofaríngea primária ou recorrente. Todavia, os isolados obtidos de
pacientes previamente tratados foram significantemente menos susceptíveis aos compostos
azoles fluconazol, itraconazol, miconazol, clotrimazol, anfotericina B e nistatina. C.
albicans foi a espécie mais frequente (84,5%) seguida por C. glabrata (6,8%) e C. krusei
(3,4%). Para os autores, candidíase orofaríngea recorrente e terapia antifúngica prévia
estão correlacionadas significativamente com susceptibilidade reduzida aos azólicos
(Hamza et al., 2008).
De acordo com Richardson e Flörl (2008), o reconhecimento das mudanças
epidemiológicas nas infecções por Candida é de grande valor para o cuidado com o
paciente e condições como severidade da imunossupressão, exposição prévia a drogas
antifúngicas e o conhecimento da espécie envolvida devem ser levadas em consideração
para escolha do tratamento.
Tratamento prolongado gera efeitos tóxicos ao organismo, visto que os antifúngicos
também agem sobre outras células eucarióticas como as somáticas, sendo indispensável o
desenvolvimento de estratégias terapêuticas com fitoterápicos (Bendazzoli, 2000, Giordani
et al., 2001, García et al., 2003, Fernández-Torres et al., 2006, Traeder et al., 2008).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
38
2.7 NOVOS COMPOSTOS COM POTENCIAL ANTIFÚNGICO: FITOTERAPIA
ALTERNATIVA
As pesquisas utilizando produtos naturais visam obter novos princípios ativos que
possam se tornar fármacos ou modelos para síntese de novas drogas, além de possibilitar a
avaliação dos efeitos farmacológicos, toxidade potencial, bem como analisar a relação
entre os efeitos metabólicos, imunológicos e hormonais (Bendazolli, 2000, De Moura et
al., 2001).
Segundo Antunes et al. (2004), Barros et al. (2007) e Queiroz et al. (2008), os
últimos anos têm sido caracterizados pela retomada aos estudos com produtos naturais,
demonstrando que a busca por substâncias fitoterápicas alternativas permanece, como
ocorre nos estudos dos variados tipos de própolis.
2.7.1 Própolis
Atenção especial tem se voltado para derivados naturais, com base no
conhecimento da produção de compostos antifúngicos, visando o desenvolvimento de
novas alternativas terapêuticas e agregando valor econômico auto-sustentável, podendo ser
alcançado com a exploração da própolis (Castro; Higashi, 1995, Park et al., 1996,
Burdock, 1998, Park et al., 1998, Gurgel et al., 2005).
A própolis é um complexo resinoso produzido por abelhas, com aparência que varia
a depender de diversos fatores naturais como a espécie das abelhas, a flora local ou até
mesmo a variabilidade genética da abelha rainha. O material de origem vegetal é coletado
por abelhas Apis mellifera a partir de botões florais ou outras partes de árvores sendo o
produto final utilizado por estes insetos como uma importante arma de defesa contra
micro-organismos patogênicos (Park et al., 1998). O nome deriva do grego, pro “a favor,
em defesa de” e polis “cidade” (Salatino et al., 2005). A própolis bruta apresenta em sua
composição básica cerca de 50% de resinas vegetais, 30% de cera de abelhas, 10% de
óleos essenciais, 5% de pólen e 5% de detritos de madeira e terra (Monti et al., 1983,
Cirasino et al., 1987).
O espectro de vôo de uma abelha A. mellifera abrange um raio de cerca de 4-5 km
em torno da colméia, de onde abelhas campeiras coletam pólen e néctar para alimentação,
bem como resina para a própolis. Não são conhecidos os fatores que direcionam a
preferência das abelhas coletoras de resina por uma determinada fonte vegetal, mas se sabe
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
39
que estas são seletivas nesta coleta (Salatino et al., 2005; Teixeira et al., 2005).
Possivelmente, esta escolha esteja relacionada com a atividade antimicrobiana da resina,
uma vez que as abelhas utilizam própolis como um anti-séptico (Sahinler; Kaftanoglu,
2005).
A amplitude das atividades farmacológicas da própolis é maior em regiões tropicais
do planeta e menor nas regiões temperadas, refletindo a diversidade fitogeográfica
(Bankova, 2005a). De acordo com Silici e Kutluca (2005b), variações na composição
química da própolis também foram observadas entre amostras de própolis coletadas em
uma mesma região, por diferentes raças de A. mellifera, a partir da grande diversidade de
plantas envolvidas e das reservas de néctar e pólen. Como conseqüência, além da
composição química diferenciada, ocorre também uma variação nas atividades
farmacológicas.
Tradicionalmente, a própolis é usada na medicina popular por sua ação
antibacteriana; todavia outras propriedades como antiviral, antifúngica, anti-inflamatória e
imunoestimulante também têm sido descritas (Park et al.,1998, Marcucci et al., 2001,
Kartal et al., 2003, Beyer; Melzig, 2005).
A composição da própolis varia sazonalmente em uma mesma localidade, sendo
determinada principalmente pelas características fitogeográficas existentes ao redor da
colméia de onde o material vegetal para produção da própolis é coletado (Sforcin et al.,
2000, Kumazawa et al., 2004).
De acordo com Park et al. (2002), esta resina tem sido usada na medicina
tradicional desde a antigüidade. Segundo os autores, vários fatores interferem na
composição química da própolis brasileira como o clima, espécie da abelha e flora local, os
quais refletem, de maneira decisiva, nas propriedades biológicas do produto e classificação
em 12 grupos.
A própolis de coloração vermelha tem sido reportada por ser típica de Cuba cuja
planta de origem é a Clusia nemorosa (G. Mey) e da Venezuela a partir da C. scrobiculata
(Benoist) (Cuesta-Rubio et al., 2002, Trusheva et al., 2004). No Brasil, a própolis verde ou
do alecrim do campo é a mais explorada, originadas da Baccharis dracunculifolia (Slatino
et al., 2005, Teixeira et al., 2005). Contudo, melhores resultados terapêuticos têm sido
atingidos com a própolis vermelha, cuja principal fonte botânica no Brasil é a Dalbergia
ecastophyllum (L. Taub.), conhecida como rabo-de-bugio, localizadas nos estados da
região nordeste do país, tais como Paraíba, Pernambuco, Alagoas, Sergipe e Bahia
(Daugsch et al., 2007).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
40
A composição química da própolis depende fortemente da estação do ano (Sforcin
et al., 2001) e de sua origem botânica (Bankova et al., 2000). Própolis da região tropical
contém flavonóides, di e triterpenos, lignina e outras substâncias fenólicas, ácido prenil-pcumárico, acetofenonas, açúcares, açúcares-álcoois, ceras, vitaminas e minerais. Também
vários compostos voláteis como monoterpenos e sesquiterpenos são encontrados (Bankova
et al., 1994). Contudo, a própolis originária de zona temperada é geralmente composta de
50% de resinas e bálsamos, 30% de cera, 10% de essência e óleos aromáticos, 5% de
pólen, e 5% de outras substâncias, como ácidos alifáticos, ésteres, ácidos aromáticos,
ácidos graxos, carboidratos, aldeídos, aminoácidos, cetonas, chalconas, diidrochalconas,
terpenóides, vitaminas (B1, B2, B6, C e E) e minerais (alumínio, antimônio, cálcio, césio,
cobre, ferro, lítio, manganês, mercúrio, níquel, prata, vanádio e zinco) (Marcucci, 1995,
Park et al., 1996, Burdock, 1998, Bankova et al., 2000, Almeida; Menezes, 2002, Sahinler;
Kaftanoglu, 2005).
Daugsch e colaboradores (2008) estudaram a origem botânica e a composição
química de seis amostras de própolis vermelha oriundas de cinco estados do nordeste do
Brasil. A produção desta própolis estava localizada em regiões de mangue ao longo do
litoral ou margens de rios. As abelhas foram observadas coletando exsudatos na Dalbergia
ecastophyllum (L) Taub. (Leguminosae). Segundo estes autores a própolis vermelha
brasileira contêm teor elevado de isoflavonóides.
Os isoflavonóides são de distribuição bastante restrita no reino Plantae e ocorre
quase que exclusivamente na família Leguminosae (Piccinelli et al., 2005). Donnelly et al.
(1973) foram os primeiros a constatar a presença destes compostos em D. ecastophyllum.
Segundo Nunes et al. (2009), após análise dos constituintes da própolis vermelha
brasileira, os metabólitos secundários majoritários foram os derivados fenólicos
(flavonóides, antraquinonas) e terpenos (monoterpenos, sesquiterpenos, triterpenos e
esteróides), além da presença de açúcares. Flavonóides como quercetina, kaempferol,
luteolina e apigenina não foram detectados, mesmo sendo reportados na literatura como
presentes em outras própolis (Pietta et al., 2002, Salatino et al., 2005).
Atribui-se a ação antifúngica (fungistática e fungicida) aos ácidos fenólicos,
terpenos e flavonóides, sendo a atividade fungicida relacionada a este último composto.
Estas substâncias são encontradas principalmente na própolis vermelha brasileira (Park et
al., 2002, Daugsch et al., 2007, Marcucci et al., 2007, Silva et al., 2007).
Os flavonóides são compostos fenólicos que compreendem um amplo grupo de
substâncias naturais não sintetizadas pelos animais, e a presença e concentração destes
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
41
compostos são utilizadas como índice de qualificação de amostras de própolis (Havsteen,
2002, Beecher, 2003, Lu et al., 2004, Manach et al., 2004).
A ingestão de flavonóides interfere em diversos processos fisiológicos, auxiliando
na absorção e na ação de vitaminas, atuando nos processos de cicatrização como
antioxidantes, além de apresentarem atividade antimicrobiana e moduladora do sistema
imune (Williams et al., 2004).
A composição química da própolis é um dado extremamente importante, pois suas
distintas atividades farmacológicas podem também decorrer do sinergismo entre seus
diversos compostos químicos (Krol et al., 1993). Apesar dos flavonóides serem os
componentes da própolis mais extensivamente estudados, não são os únicos responsáveis
pelas suas propriedades farmacológicas (Awale et al., 2005).
Nas amostras brasileiras, segundo Beyer e Melzig (2005) e Fernandes et al. (2007),
outras classes de compostos bioativos
são descritas, tais como ácidos fenólicos e
terpenóides específicos e, devido a esta grande variedade de componentes químicos, a
padronização química é extremamente difícil.
De acordo com Reynaud et al. (2005), isoflavonóides são os componentes
antimicrobianos mais importantes da própolis vermelha, especialmente com atividade
frente a Candida albicans. Os achados dos autores são reforçados pela presença de
pterocarpanos, compostos conhecidos pela ação antifúngica de defesa das próprias plantas.
Como decrito por Bankova (2005b) e Trusheva et al. (2006), a maioria dos
constituintes da própolis vermelha brasileira tem atividade antimicrobiana e antioxidante,
independentemente da planta de origem.
Embora existam relatos atribuindo à própolis as mais variadas aplicações em
medicina popular e veterinária (Gacs et al., 1993, Heinze et al., 1998, Barros et al., 2007),
os estudos vêm corroborando que esta resina possui um grande potencial terapêutico em
relação às atividades anti-inflamatória, antimicrobiana, antineoplásica e antioxidante.
A capacidade da própolis em inibir o crescimento de micro-organismos é a
atividade farmacológica mais conhecida. A despeito de suas distintas composições,
amostras de própolis da Europa são muito similares em relação à atividade antimicrobiana
quando comparadas com amostras de própolis provenientes do Brasil (Popova et al., 2004,
Barros et al., 2007).
Ensaios de antibiose realizados por Antunes et al. (1996) com a própolis verde
frente a 10 cepas de bactérias gram-positivas e 20 de gram-negativas, comprovaram que a
atividade antibacteriana desta própolis é mais efetiva sobre as gram-positivas.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
42
Atividade antiprotista foi observada por Castro e Higashi (1995), em camundongos
infectados com Trypanosoma cruzi. Além disso, a ação antibacteriana em culturas de
Staphylococcus aureus, Bacillus subtilis, Salmonella typhimurium e S. enteritides foi
demonstrada em várias pesquisas (Bankova et al., 1995, Serra; Escola, 1995, Mazzuco et
al., 1996, Park et al., 1998).
A inibição de crescimento de Helicobacter pylori foi observada por Ohsugi et al.
(1997), Hashimoto et al. (1998), Banskota et al. (2000) e Boyanova et al. (2005) e, em
concordância com estes trabalhos, a inibição de úlceras gástricas através da ingestão de
própolis, possivelmente está relacionada com a atividade anti-helicobacter, tendo em vista
que esta bactéria é reconhecidamente associada a úlceras.
Ensaios in vitro avaliando o efeito da própolis sobre a proliferação de vírus da gripe
de aves (Barros et al., 2007) resultaram na inibição destes vírus. Harish et al. (1997) e Park
et al. (2000) também descreveram atividade inibitória da própolis sobre a replicação do
vírus HIV-1 em culturas celulares de linfócitos T CD4.
A ação de vários tipos de própolis, exceto a vermelha, foi avaliada quanto à
capacidade de inibir o crescimento de isolados clínicos de Candida. Através dos resultados
a propriedade antifúngica foi constatada em todos os tipos de própolis testados,
destacando-se a ação da própolis verde (Sosa et al., 1997, Hegazi et al., 2000, Sforcin et
al., 2001, Chee, 2002, Cushnie; Lamb, 2005, Uzel et al., 2005).
Ota et al. (2001) avaliaram a atividade antifúngica da própolis verde em 80 isolados
do gênero Candida, como C. albicans, C. tropicalis, C. krusei e C. guilliermondii. As mais
sensíveis foram C. albicans seguida de C. tropicalis, C. krusei e C. guilliermondii. Os
pacientes avaliados que utilizavam próteses dentárias e foram submetidos ao uso de extrato
hidroalcoólico desta própolis apresentaram diminuição de colonização e doença por estas
leveduras.
Sawaya et al. (2002) compararam diversos métodos microbiológicos a fim de
determinar qual o mais sensível para testar a atividade do extrato de própolis produzido por
Apis mellifera, independente de sua origem botânica, contra espécies de Candida. Os
autores concluíram que o método de diluição em placas apresentou os resultados mais
expressivos devido à presença de composto ativo diferente, valorizando os métodos de
padronização a partir de análises cromatográficas.
Martins e colaboradores (2002) testaram a susceptibilidade de isolados de C.
albicans, obtidos de pacientes HIV positivos com candidíase oral, ao extrato alcoólico de
própolis verde e compararam à ação inibitória de antifúngicos comerciais como nistatina,
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
43
clotrimazol, econazol e fluconazol. Resultados significativos foram observados entre a
ação do extrato de própolis quando comparados ao fluconazol e nistatina. Este fato sugere
que o extrato de própolis pode ser um tratamento alternativo em casos de candidíase em
pacientes HIV positivos. Os autores ressaltaram a necessidade de estudos in vivo.
Leveduras isoladas de amostras clínicas de pacientes com micoses superficiais
foram testadas por Silici et al. (2005a) contra amostras de própolis coletadas de diferentes
regiões da Turquia por raças de abelhas diversas. Os resultados obtidos apresentaram que
C. albicans, C. glabrata, espécies de Trichosporon e Rhodotorula foram susceptíveis a
baixas concentrações de própolis, demonstrando alta susceptibilidade. A própolis coletada
por Apis mellifera caucasica apresentou ação antifúngica mais significativa.
Santos e colaboradores (2005) avaliaram a eficácia do extrato alcoólico de própolis
verde brasileira contra candidíase oral em 12 pacientes que faziam uso de prótese dentária,
comprovando sua ação antifúngica. Estes mesmos autores em 2008 testaram uma
formulação em gel a base de própolis verde em pacientes com estomatite dentária. Dos 30
pacientes com estomatite, 15 receberam higiene diária com miconazol gel e 15 receberam
tratamento com própolis gel. Em ambos os tratamentos houve completa remissão do edema
e eritema, apresentando eficácia comparável.
Baseado nos experimentos in vivo realizados com camundongos por Hu et al.
(2005), tanto o extrato aquoso como o alcoólico de uma própolis chinesa, cuja origem
botânica era o Populus sp., exibiram significante efeito anti-inflamatório. Os mecanismos
para este efeito provavelmente envolvem a diminuição nos níveis de prostaglandinas e
óxido nítrico e a inibição da ativação e diferenciação de macrófagos mononucleares.
Oliveira et al. (2006) constataram o efeito fungistático da própolis da região de
Maringá na concentração de 5x102 mg/mL sobre espécies de Candida, Trichosporon e
Geotrichum isoladas de escamas ungueais de casos de onicomicoses, seguindo o protocolo
de referência M27-A do CLSI (2005). O efeito fungicida foi obtido na concentração de
20x102mg/mL com perfis de susceptibilidade diferentes entre as espécies das leveduras.
De acordo com os testes de susceptibilidade realizados por Fernandes et al. (2007),
um isolado padrão de Cryptococcus neoformans foi inibido por extrato alcoólico de
própolis verde em concentrações de 0,2 mg/mL e 1,6 mg/mL, consideradas fungicidas.
Aslan e colaboradores (2007) realizaram estudo para investigar os efeitos da
própolis de origem turca na colite experimental. Após indução de colite distal, os animais
foram tratados com própolis via lavagem intragástrica (600mg/kg). A maioria dos animais
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
44
tratados apenas com a própolis apresentou histologia normal com redução da reação
inflamatória.
Siqueira et al. (2009), ao testar a atividade antifúngica in vitro de própolis verde e
vermelha contra diferentes espécies de Trichophyton, referiram que o extrato alcoólico da
própolis vermelha apresentou-se mais eficiente que o da própolis verde. O potencial
antifúngico do extrato alcoólico da própolis vermelha foi apresentado como alternativa
para o tratamento das dermatofitoses causadas por espécies de Trichophyton.
Dalben-Dota e colaboradores (2010) avaliaram a atividade antifúngica in vitro de
extrato de própolis comercial frente à C. albicans e não-albicans isoladas de secreção
vaginal, em comparação à nistatina. Todas as leveduras foram inibidas por baixas
concentrações de própolis, inclusive um isolado resistente a nistatina, representando uma
nova alternativa terapêutica nos casos de candidíase vulvovaginal.
Ledón et al. (2002) avaliaram o potencial alergênico de extrato de própolis
vermelha de Cuba e os animais testados não apresentaram irritação dermatológica no teste
de toxicidade dérmica e ocular, porém o teste de alergia de contato mostrou resposta
moderada (presença de eritema, porém não apresentaram edemas ou outras reações
alérgicas). Em humanos as reações alérgicas causadas pela própolis de Cuba foram muito
baixas (De Campos et al., 1998).
De acordo com Santos e Cruz (2001), quando associados a agentes
quimioterápicos, os antioxidantes presentes na própolis minimizam a toxicidade causada
pelas drogas quando interagindo com radicais livres.
Dessa maneira, a expansão da indústria de própolis vermelha só será possível, de
forma segura, com a padronização da matéria-prima e dos produtos acabados, levando-se
em conta a diversidade da vegetação regional, a atividade de coleta das diferentes
variedades de abelhas e com o estabelecimento da eficácia e segurança dos produtos
obtidos. A proposta atual de alguns grupos de pesquisa é fracionar a própolis vermelha
para isolar os marcadores e assim, através de cálculos matemáticos, tipificá-la. A
descoberta de outros compostos com atividades biológicas variadas incluirá a própolis
vermelha na tipificação, viabilizando a proposta de novos medicamentos com risco
reduzido ao paciente, através de um rígido controle de qualidade e pesquisa aplicada
(Lustosa et al., 2008).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
45
3. ESOFAGITE POR CANDIDA GLABRATA: NOVOS CASOS RELATADOS E
CONDUTA TERAPÊUTICA 1
1
Artigo publicado: Macêdo, D.P.C., Silva, V.K.A., Farias, A.M.A., Melo, L.R.B., Wilheim, A.B., Neves,
R.P. 2008. Candida glabrata esophagitis: new case reports and management. Brazilian Journal of
Microbiology, 39: 279-281.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
46
RESUMO
Esofagite por Candida (CE) é uma infecção oportunista comum em hospedeiros
imunossuprimidos. C. glabrata é raramente citada como agente de CE e tem sido
subestimada devido à falta de identificação adequada. No presente estudo, dois casos de
esofagite por C. glabrata em pacientes com AIDS e doença de Chagas são relatados. O
diagnóstico de espécies de Candida deve ser considerado como requisito para a escolha da
terapia antifúngica ideal contra esta micose.
Palavras-chave: Candida glabrata, esofagite, AIDS, doença de Chagas.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
47
Esofagite por Candida (CE) é uma infecção oportunista comum nos pacientes
imunossuprimidos. Acredita-se que esta micose também ocorra em pacientes debilitados
que receberam antibióticos de amplo espectro, corticóides e imunossupressores (Laine;
Boncini, 1994, Wilcox; Karowe, 1994, Weerasuriya; Snape, 2006).
Espécies de Candida são organismos comensais do trato gastrointestinal. Elas
colonizam o esôfago em aproximadamente 20% dos adultos saudáveis. C. albicans é o
micro-organismo considerado o mais comum e virulento nos casos de CE. Outras espécies,
incluindo C. tropicalis, C. krusei e C. stellatoidea, também já foram isoladas (Simon et al.,
1997). C. glabrata atualmente ocupa o segundo ou terceiro lugar como agente causador de
infecções superficiais (oral, esofágica, vaginal, urinária) ou sistêmicas, as quais são muitas
vezes de origem nosocomial (Neves et al., 2002). Esta espécie é raramente citada como
agente de CE e tem sido subestimada devido à falta de identificação adequada (Fidel et al.,
1999, Martinez et al., 2002, Tran et al., 2003).
Vários distúrbios endócrinos e condições clínicas tem sido associadas com CE
como a obstrução funcional ou mecânica do esôfago acompanhada de estase e crescimento
excessivo da levedura (Wilcox; Karowe, 1994, Yee; Wall, 1994). Este trabalho relata dois
casos de esofagite causada por C. glabrata em pacientes imunossuprimidos, diagnosticados
no Hospital Oswaldo Cruz, em Recife, Pernambuco, Brasil. O primeiro caso foi um
paciente do sexo masculino com 46 anos de idade, infectados pelo HIV, que apresentou
disfagia e regurgitação acompanhada de perda de peso. Ele não estava fazendo uso de
medicamentos anti-retrovirais e exibia graves déficits imunológicos. O segundo caso foi
uma mulher com 82 anos, portadora da doença de Chagas, que se apresentou com disfagia
tanto a sólidos como a líquidos, durante os últimos dois anos. A regurgitação ocasional
com aspiração e odinofagia intermitente foram os sintomas associados. Houve também
queixa de febre, dor torácica e perda significativa de peso no ano anterior ao exame
endoscópico. Ambos os pacientes não obtiveram resposta terapêutica eficaz através de
tratamento profilático com fluconazol e foram examinados quanto ao agente causador da
infecção.
CE foi diagnosticada quando placas características de colônias Candida foram
identificadas a endoscopia (esôfago-gastro-duodenoscopia) (Fig. 1A). Os pacientes foram
submetidos a endoscopia do trato digestivo e amostras de fragmentos da mucosa esofágica
foram coletadas com instrumento especial em condição estéril, e em seguida processadas
no Laboratório de Micologia Médica (Departamento de Micologia, Universidade Federal
de Pernambuco) para a confirmação micológica do agente etiológico.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
48
As amostras foram clarificadas com hidróxido de potássio (KOH) a 20% para
ajudar a dissolver os resíduos, facilitando a observação através da microscopia direta de
elementos fúngicos. Para a cultura, os espécimes foram inoculados em meio Ágar
Sabouraud Dextrose (SDA) (Difco) acrescido de cloranfenicol (50mg/L) contido em placas
de Petri e incubados a 28ºC por 72 horas sendo a identificação realizada com base em suas
características morfofisiológicas e exames bioquímicos, como auxanograma, zimograma e
produção de ácido e urease, de acordo com Barnett et al. (2000) e De Hoog et
al. (2000). A identificação foi confirmada pelo método automatizado do VITEK 120
(bioMérieux).
O exame direto das amostras apresentou blastoconídeos hialinos, isolados e de
dimensões menores que a maioria da estruturas de leveduras (1 a 4 mm) (Figura 1B). À
cultura produziram colônias de coloração creme e textura lisa, características relativamente
indistinguíveis de outras espécies de Candida, com exceção do tamanho celular reduzido.
De fato, C. glabrata é a única espécie de Candida que não forma pseudomicélio em
temperaturas acima de 37ºC (Fidel et al., 1999). Glicose, trealose e sulfato de amônio
foram assimilados como fontes de carbono e nitrogênio, e a fermentação destes açúcares
foi observada, apesar de não ter ocorrido produção de ácido e urease.
As reações bioquímicas de C. glabrata também são bastante distintas. Em contraste
com C. albicans, a qual fermenta e/ou assimila uma série de açúcares, C. glabrata
fermenta e assimila apenas glicose e trealose. De fato, entre as espécies de levedura mais
comumente isoladas em um laboratório de micologia clínica, C. glabrata é a única que
utiliza a trealose, mas não sacarose (Kreger-Van Rij, 1984).
Esofagite por C. glabrata grau II de Wilcox (Wilcox; Karowe, 1994) foi
diagnosticada em ambos os casos pela presença de achados endoscópicos característicos,
tais como placas esbranquiçadas e exsudato (Fig. 1A), e pela confirmação micológica das
espécies envolvidas.
Até recentemente, C. glabrata foi considerada um fungo comensal relativamente
não patogênico presente na mucosa humana. No entanto, com o aumento do uso dos
agentes imunossupressores, o número de infecções de mucosa e sistêmicas causadas por
este fungo tem aumentado significativamente, especialmente na população infectada pelo
HIV. Um importante desafio nestas infecções é a sua resistência inata à terapia
antimicótica com azólicos, a qual é bastante eficaz no tratamento de infecções causadas por
outras espécies de Candida (Laine; Boncini, 1994, Wilcox, et al., 1996).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
49
As formas digestivas da doença de Chagas são as dilatações que ocorrem ao longo
do trato digestivo prejudicando o trânsito normal ou até mesmo impedindo-o
completamente. Embora o desenvolvimento da candidíase no esôfago obstruído seja
incomum, algumas revisões de literatura e relatos de casos raros sugerem tal associação.
Este relato reforça o fato de que a estase de longa duração no esôfago pode levar a
infecções oportunistas
secundárias como a esofagite (Crema et al., 2002). Segundo
Praveen et al. (2007), em aproximadamente 25% dos casos de doenças de base que
conduzam à estase, como por exemplo o megaesôfago, ocorre aumento de colonização
fúngica.
Baseado em Westwater et al. (2007), cepas de C. glabrata colonizam o trato
digestivo e penetram no estrato queratinizado do tecido gástrico diferindo, contudo, de C.
albicans. Segundo estes autores esta levedura é considerada incapaz de infectar o tecido
oroesofágico. Este comportamento pode explicar a capacidade de C. glabrata em persistir
nos tecidos infectados e sobreviver como um comensal do aparelho digestivo.
Em resumo, ambos os casos de CE por C. glabrata desenvolveram resistência ao
fluconazol. Assim, esta espécie emergente pode estar sendo subestimada devido à falta de
uma correta identificação podendo ser isolada mais facilmente devido, em parte, ao
impacto da terapia com fluconazol sobre a ecologia das espécies de leveduras orais
(Martinez et al., 2002, Yakoob et al., 2003). A associação do megaesôfago com a esofagite
por Candida é rara e um diagnóstico precoce é indispensável para o tratamento adequado
de ambas as enfermidades e para prevenção do risco de metaplasia. Endoscopia com
amostragem para avaliação microbiológica foi, no entanto, a maneira conclusiva para
estabelecer o diagnóstico (Wilcox et al., 1996, Crema et al., 2002).
Estes resultados sugerem que esofagite por C. glabrata pode estar relacionada à
pacientes imunossuprimidos, especialmente com doenças crônicas, previamente tratados
com antibióticos, corticosteróides ou omeprazol (Martinez et al., 2000). O diagnóstico das
espécies de Candida deve ser considerado um importante procedimento para a escolha de
antifúngicos ideais ao tratamento desta micose.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
50
Figura 1. Aparência endoscópica da esofagite por Candida glabrata grau II de Wilcox (A),
apresentando placas brancas e exsudato característicos de esofagite por Candida e exame
direto da lesão, clarificado com solução de hidróxido de potássio a 20% exibindo
numerosos blastoconídeos (B).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
51
4. ESOFAGITE CAUSADA POR CANDIDA GUILLIERMONDII NO DIABETES
MELLITUS: PRIMEIRO CASO RELATADO 2
2
Artigo publicado: Macêdo, D.P.C., Oliveira, N.T., Farias, A.M.A., Silva, V.K., Wilheim, A.B., Couto,
F.M., Neves, R.P. 2010. Esophagitis caused by Candida guilliermondii in diabetes mellitus: first reported
case. Medical Mycology, 48(6): 862-865.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
52
Resumo
Pacientes diabéticos estão mais vulneráveis a adquirir infecções do esôfago como aquelas
causadas por membros do gênero Candida. Neste trabalho foi descrito um caso de
isolamento de C. guilliermondii a partir da mucosa do esôfago de um paciente com
diabetes mellitus não controlada. Devido à identificação inadequada e imprecisa, o
surgimento de espécies não-C. albicans como patógenos potenciais tem sido subestimado.
Este deve ser um motivo de preocupação, uma vez que
C. guilliermondii é um
componente da microbiota humana. A identidade do isolado foi confirmada por suas
características morfofisiológicas e pela amplificação de rDNA utilizando oligonucleotídeos
espécie-específicos. Tratamento com fluconazol não produziu melhora dos sintomas do
esôfago sendo confirmada a resistência do agente etiológico através de testes in vitro. Este
é considerado o primeiro caso documentado de esofagite por C. guilliermondii em um
paciente com diabetes mellitus.
Palavras-chave: Esofagite, Candida guilliermondii, espécies emergentes, diabetes
mellitus.
53
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
Introdução
O trato gastrintestinal superior, incluindo o esôfago, estômago e intestino delgado,
abriga uma ampla variedade de agentes patogênicos em potencial (Lamps, 2008). Embora
ainda considerada por alguns autores uma doença incomum, esofagite por Candida (CE)
está
sendo
reconhecida
devido
ao
aumento
de
freqüência
em
hospedeiros
imunossuprimidos, principalmente como resultado do uso de endoscopia digestiva alta
(Frokjaer et al., 2007). CE tem sido associada com condições que causam depressão
imunológica e vários distúrbios endócrinos, incluindo diabetes mellitus, hipotireoidismo,
hipoparatireoidismo e hipoadrenocorticismo (Phaosawasdi et al., 1986, Yee; Wall, 1994,
Lamps, 2008).
Curiosamente, pesquisas com pacientes diabéticos relacionadas à patologias
esofágicas se concentram especialmente em disfunções da motilidade, de acordo com
Kapoor et al. (2009), desconsiderando-se que pacientes diabéticos estão em maior risco
para uma série de outras doenças do esôfago. O aumento da incidência de refluxo
gastroesofágico, bem como infecções por Candida são exemplos de dois fatores
agravantes. Além disso, uma série de mudanças estruturais ocorrem no esôfago de
pacientes diabéticos (Frokjaer et al., 2007).
Tem sido observado um aumento na proporção de infecções do esôfago causadas
por espécies não-C. albicans. O surgimento de casos por espécies não-C. albicans é uma
grande preocupação uma vez que alguns desses micro-organismos, particularmente C.
glabrata, C. krusei, C. lusitaniae, C. parapsilosis, C. tropicalis, podem ser altamente
resistentes às drogas antifúngicas comerciais (Antunes et al., 2004, Pasqualotto et al.,
2006a, Pasqualotto et al., 2006b, Macêdo et al., 2008). Por esta razão, uma identificação
rápida e confiável das leveduras ao nível de espécie é extremamente importante.
C. guilliermondii é um componente da microbiota normal humana não sendo
comumente citada como agente da CE, provavelmente devido à identificação inadequada
deste micro-organismo. Devido à sua baixa freqüência, as infecções causadas por esta
espécie são relativamente menos estudadas em comparação com aquelas causadas por
outras espécies de Candida (Pasqualotto et al., 2006a).
54
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
Relato de caso
A paciente era uma mulher de 56 anos, diabética, que apresentou disfagia
acompanhada de perda de peso. A endoscopia foi realizada, após período de jejum de 12
horas, com um endoscópio EXERA 1600 (Olympus Corp, Lake Success, NY) que tinha
sido desinfectado com uma solução de glutaraldeído a 2,6%. Após a observação direta de
placas esbranquiçadas e exsudatos na mucosa do esôfago (Fig. 1A), foram coletados
fragmentos das lesões com pinça Medglobe® sob condições assépticas. As amostras foram
posteriormente imersas em água destilada esterilizada contendo cloranfenicol (50 mg/L) e
processadas para diagnóstico micológico no Laboratório de Micologia Médica
(Departamento de Micologia da Universidade Federal de Pernambuco).
Uma parte dessa amostra clínica foi tratada com hidróxido de potássio (KOH) a
20%
para facilitar a observação da morfologia dos elementos fúngicos através da
microscopia direta. Além disso, a outra parte das amostras foi inoculada em meio Ágar
Sabouraud Dextrose (SDA, Difco) com cloranfenicol (50 mg/L) contido em placas de Petri
e incubados a 30°C e 37°C por 15 dias. A identificação da levedura isolada foi conduzida
de acordo com Barnett et al. (2000) e De Hoog et al. (2000) baseado nas características
morfofisiológicas, nos resultados dos testes bioquímicos (método clássico), VITEK 120bioMérieux (método automatizado) e dados da biologia molecular (PCR com primer
espécie-específico) (Mannarelli; Kurtzman, 1998). O teste de susceptibilidade ao
fluconazol foi realizado utilizando o método de microdiluição em caldo descrito pelo
Clinical Laboratory Standards Institute (2008).
Exame microscópico direto com KOH revelou células de leveduras hialinas
isoladas e em brotamento, esféricas a elipsoidais. Colônia cremosa de coloração branca a
creme e formação de pseudomicélio a partir de um conjunto de células em brotação (Figura
1B) foram observadas na cultura e sua microscopia. As características morfofisiológicas e
o VITEK 120, identificaram C. guilliermondii.
A reação de PCR, utilizando oligonucleotídeos espécie-específicos a partir do
rDNA
genômico
(forward
GCCTTGCCTTCGTGGCGGGGTGA
e
reverse
GGGATCATTATGCCAGCATCCTTGAT) gerou um fragmento de aproximadamente
175bp.
Embora poucos métodos diferenciem C. guilliermondii de C. famata e C. fermentati
(Vaughan-Martini et al., 2005), estas espécies podem ser distinguidas com base em seus
perfis fisiológicos como indicado na Tabela 1.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
55
Esofagite por C. guilliermondii grau II de Wilcox (Wilcox e Karowe, 1994) foi
diagnosticada e nenhuma outra espécie de Candida foi isolada em cultura. O paciente foi
tratado com fluconazol oral em doses de 150 mg/dia durante 14 dias sem melhora dos
sintomas esofágicos. A resistência do isolado a este antifúngico foi confirmada através do
teste de susceptibilidade in vitro, com concentração inibitória mínima (MIC) de 64 µg/mL.
A tentativa para uso de outras opções terapêuticas não foi possível porque a paciente não
retornou ao serviço de saúde.
Discussão
Infecções orais causadas por C. guilliermondii tem sido descritas em pacientes
diabéticos (Dorko et al., 2005), e naqueles com estomatite pelo uso de próteses dentárias
(Dorko et al., 2001). Em um relato, um paciente imunocompetente apresentou abcesso
dento-alveolar em que C. guilliermondii foi considerado um co-patógeno, juntamente com
duas bactérias orais (McManners; Samaranayake, 1990). Colonização oral também foi
descrita em indivíduos saudáveis (Rasool et al., 2005), pacientes com câncer (Tekeli et al.,
2002), bem como aqueles tratados com corticosteróides inalatórios (Komiyama et al.,
2004).
Esofagite por C. guilliermondii não é considerada comum (Tacconelli et al., 2002,
Melo et al., 2004) como verificada durante estudo brasileiro multicêntrico o qual avaliou
130 pacientes com AIDS e CE (Sant’ana et al., 2002). Neste contexto, diversos casos já
foram relatados por Takasawa et al. (2007) e outros pesquisadores em que diabetes era o
único fator predisponente para o desenvolvimento de CE (Underwood et al., 2003, Goto et
al., 2007, Lamps, 2008), embora nenhum desses casos tenha sido causado por C.
guilliermondii.
O presente relato destaca C. guilliermondii como um agente etiológico emergente e
recém-descrito de CE associado com diabetes mellitus não controlada. O paciente não
respondeu à terapia com fluconazol, provavelmente porque a levedura foi resistente a este
antifúngico. Isolados desta espécie são freqüentemente referidos por apresentarem
concentrações inibitórias mínimas maiores aos antifúngicos, incluindo o fluconazol. Esta
pode ter sido a causa da falha terapêutica com nossa paciente, e em outras situações pode
estar relacionado ao desenvolvimento de neoplasias ou até mesmo óbito (Arendrup et al.,
2002, Pappas et al., 2004, Domingues-Ferreira et al., 2009).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
56
Segundo alguns autores, o método padrão para cultura e diferenciação das espécies
de Candida são demorados e podem não estabelecer distinção entre as espécies não-C.
albicans e, por estas razões o diagnóstico por técnicas moleculares pode ser
particularmente útil em laboratórios clínicos (Mannarelli; Kurtzman, 1998, VaughanMartini et al., 2005, Rocha et al., 2008). No entanto, procedimentos taxonômicos
convencionais de fermentação e assimilação foram capazes de distinguir positivamente C.
guilliermondii, C. famata e C. fermentati.
O surgimento de espécies de Candida como agentes de esofagite ressalta a
importância do diagnóstico laboratorial micológico e estudos epidemiológicos para o
controle desta micose, especialmente nos pacientes imunossuprimidos.
Agradecimentos
Agradecemos ao Dr. David Bousfield pela revisão deste artigo e à Coordenação de
Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pelo apoio financeiro.
Declaração de interesse: Nenhum.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
57
Fig. 1 Aspecto endoscópico de esofagite por Candida guilliermondii grau II de Wilcox
(A), exibindo placas brancas e exame microscópico do agente apresentando numerosos
blastoconídeos ( ) e pseucomicélio ( ) (B).
58
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
Tabela 1. Perfil fisiológico distinguindo C. guilliermondii de C. famata e C. fermentati.
Fontes
Reações fisiológicas
Espécies de leveduras
Candida guilliermondii
C. fermentati
F
G
F
G
C. famata
F
G
D-Galactose
+
+
+
+
-
+
L-Sorbose
0
+
0
+
0
-
Maltose
+
+
+
+
-
-
Sacarose
+
+
+
+
-
+
Celobiose
+
+
-
+
-
-
α, α -Trealose
+
+
+
+
-
+
Melibiose
+
+
-
+
-
-
Melicitose
-
+
-
+
-
-
Rafinose
+
+
+
+
-
+
Inulina
+
+
+
+
-
-
D-Xilose
-
+
-
+
-
+
L-Arabinose
0
+
0
+
0
-
D-Ribose
0
+
0
+
0
-
L-Rhamnose
0
+
0
-
0
-
Me α –D-glicosídeo
+
+
-
+
-
-
D-Glucosamina
0
+
0
+
0
-
Nitrito
0
+
0
-
0
+
Biotina & Tiamina
0
+
0
-
0
+
F- Teste de fermentação; G- Perfil de crescimento; 0- Não realizado.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
59
5. ESOFAGITE POR TRICHOSPORON INKIN: UMA DOENÇA RARA EM
PACIENTE COM CANCER DE PULMÃO3
3
Artigo publicado: Macêdo, D.P.C., Oliveira, N.T., Silva, V.K., Farias, A.M.A., Lima-Neto, R.G.,
Wilheim, A.B., Oliveira, P.C., Pedi, N., Andrade, S.L., Neves, R.P. 2011. Trichosporon inkin esophagitis: an
uncommon disease in a patient with pulmonary cancer. Mycopathologia, 171(4), 279-283.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
60
Resumo
Espécies de Trichosporon são conhecidas como patógenos oportunistas. Aqui, nós
apresentamos um caso de esofagite por T. inkin em mulher com 54 anos, com câncer de
pulmão e neutropenia grave nos quais o perfil de sensibilidade do isolado contra azóis e
polienos foi verificado. O paciente foi diagnosticado com esofagite grau de I Wilcox,
apresentando placas esbranquiçadas esparsas e exsudatos nos dois terços superiores do
esôfago. Terapia antifúngica com fluconazol oral (150 mg/dia durante 14 dias) foi ineficaz.
In vitro, o isolado apresentou sensibilidade a este medicamento e à anfotericina B. Uma
vez que T. inkin tem exibido importância crescente como agente de infecções invasivas em
pacientes imunossuprimidos, ressalta-se que o diagnóstico de esofagite por esta espécie
deve ser seguido por uma avaliação da sensibilidade antifúngica do isolado envolvido.
Palavras-chave: Trichosporon inkin, esofagite, imunocomprometidos, diagnóstico, perfil
antifúngico
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
61
Introdução
Esofagite é uma condição inflamatória, envolvendo irritação ou inchaço do esôfago,
que pode ser causada por uma grande variedade de micro-organismos, incluindo vírus,
bactérias, fungos e outros parasitas (Lamps, 2008).
Os casos de esofagite fúngica são freqüentemente relatados em pacientes que
sofrem de doença neoplásica, que estão fazendo uso de antibioticoterapia prolongada, ou
que tenham diabetes mellitus, Síndrome da Imunodeficiência Adquirida (AIDS), dentre
outras condições (Underwood et al., 2003, Manfredi et al., 2007, Traeder et al., 2008,
Macêdo et al., 2010).
Infecções fúngicas esofágicas geralmente se apresentam com odinofagia, disfagia e
muitas vezes são parte de um processo disseminado da doença. Quando causada por
espécies de leveduras, a infecção se apresenta como placas brancas que, dependendo do
grau do dano, pode ser removida revelando uma mucosa ulcerada abaixo (Wilcox; Karowe,
1994, Lamps, 2008).
Embora as espécies de Candida sejam consideradas os micro-organismos
causadores de esofagite mais comuns, outras leveduras também podem ocorrer, tais como
as representantes do gêneros Trichosporon, um fungo basidiomiceto isolado do solo,
vegetais, mamíferos, aves e também considerado como um membro da microbiota normal
da boca, unhas e pele. Estes micro-organismos têm sido citados como agentes de infecções
superficiais e profundas em humanos (Lacroix; Chauvin, 2005, Koyanagi et al., 2006,
Carvalho et al., 2008).
Esofagite por Trichosporon é considerada rara, tendo sido relatada infecções neste
sítio corpóreo somente por T. asahii (Lo Passo et al., 2001) e T. cutaneum (anteriormente
considerada T. beigelii) (Gueho et al., 1994). O objetivo deste trabalho é descrever um
caso incomum de esofagite por T. inkin.
Relato de Caso
A paciente era uma mulher de 54 anos de idade, hipertensa, diabética que se
apresentou com queixas de tosse, dispnéia e estado geral precário por aproximadamente 2
meses. Ela foi diagnosticada através de exame histopatológico com carcinoma pulmonar
diferenciado, ulcerando e invadindo a mucosa brônquica, no lobo médio direito. A paciente
foi tratada com ciclos de quimioterapia resultando em sintomas posteriores como disfagia
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
62
acompanhada de perda de peso. A avaliação do trato gastrointestinal superior foi feita
utilizando um endoscópio (EXERA 1600 Olympus Corp, Lake Success, NY), previamente
desinfectado com solução de glutaraldeído a 2,6%. Anestesia tópica da faringe (xilocaína
2% spray) foi utilizada para evitar refluxo no ato do exame.
Fragmentos de tecido foram coletados das lesões com pinça (Medglobe®), em
condições estéreis e as amostras foram analisadas, bem como a solução desinfetante de
glutaraldeído. As amostras foram então colocadas em água destilada esterilizada contendo
cloranfenicol (50 mg/L) e enviadas para o Laboratório de Micologia Médica da
Universidade Federal de Pernambuco/Brasil para diagnóstico microbiológico, identificação
definitiva e teste de susceptibilidade.
Materiais e Métodos
Isolamento do agente etiológico
Para exame micológico, os espécimes clínicos foram clarificados com solução de
hidróxido de potássio (KOH) a 20% e observados ao microscópio. Para a solução de
glutaraldeído, microscopia direta foi realizada sem clarificante. Simultaneamente, as
amostras clínicas e a solução desinfetante foram inoculadas/semeadas em meio Sabouraud
Dextrose Ágar (Difco) com cloranfenicol (50 mg/L) e incubadas a 30 e 37ºC por 10 dias.
Caracterização fenotípica e molecular do fungo
Culturas puras foram identificadas com base em suas características morfofisiológicas, fermentação de carbohidratos e auxanograma, crescimento em fontes de
nitrogênio, crescimento em temperaturas variadas e na capacidade de hidrolisar uréia
(Barnett et al., 2000, De Hoog et al., 2000), VITEK 120-bioMérieux (método
automatizado) e nas características da biologia molecular das regiões ITS do DNA
ribossomal as quais foram amplificadas com os primers ITS-1 (5’-TCCGTA GGTGAA
CCTGCG-3’) e ITS-4 (5’- CCTCCGCTTATTGATATGC-3’) (Diaz e Fell, 2004).
Os testes de suscetibilidade foram avaliados para fluconazol (Pfizer Incorporated,
Nova York, NY) com intervalos de concentração de 0,125-64µg/mL e anfotericina B
(Sigma Chemical Corporation, St. Louis, MO) de 0,03-16 µg/mL. Os testes foram
realizados utilizando método de microdiluição em caldo de acordo com o documento M27A3 (CLSI, 2008). As cepas controle de C. krusei (ATCC 6528) e C. parapsilosis (ATCC
22019) também foram incluídas. A concentração inibitória mínima (MIC) para fluconazol
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
63
foi considerada a menor concentração da droga causando uma redução de
aproximadamente 50% no crescimento, e para a anfotericina B foi considerada a menor
concentração de droga testada capaz de evitar qualquer crescimento visível (CLSI, 2008).
Resultados
O paciente foi diagnosticado como tendo esofagite grau I de Wilcox, apresentando
placas esbranquiçadas espassas e exsudato nos 2/3 superiores da mucosa do esôfago sem
disseminação aparente da infecção ao longo do trato gastrointestinal (Fig. 1a). A
preparação do tecido do esôfago com KOH apresentou células com brotamentos e hifas
com artroconídios desarticulados (Fig. 1b). A cultura das amostras de tecido exibiram
colônias de coloração branca a creme e relevo cerebriforme após 48 h de incubação (Fig.
1c) apresentando, na análise microscópica do agente, cadeias de artroconídios cilíndricos
(Fig. 1d).
A assimilação de fontes de carbono pela cepa diferenciou-a de outras espécies
fenotipicamente semelhantes como T. asahii e T. mucoides. No entanto, o isolado não foi
capaz de realizar fermentação. A PCR utilizando os iniciadores ITS1 e ITS4 gerou
fragmentos de aproximadamente 530 pb. Os resultados bioquímicos, identificação pelo
sistema VITEK 120-bioMérieux (99% de especificidade) e biologia molecular
confirmaram T. inkin como agente etiológico.
O paciente foi tratado com fluconazol oral em doses de 150 mg/dia por 14 dias e
não revelou melhora dos sintomas esofágicos. A resistência a esta droga não foi
confirmada após o teste de susceptibilidade, uma vez que o MIC foi 8 µg/mL para
fluconazol. Por outro lado, T. inkin foi sensível à anfotericina B na concentração de 0,125
µg/mL. As amostras de glutaraldeído analisadas não apresentaram crescimento de
quaisquer micro-organismos.
Discussão
Este caso demonstra a capacidade de T. inkin em invadir a mucosa e causar
esofagite infecciosa grau I de Wilcox. Wilcox e Karowe (1994) destacaram o valor
diagnóstico da endoscopia e da identificação do agente etiológico a partir de biópsia.
Infecções por Trichosporon são incomuns na esofagite (Gueho et al., 1994, Lo
Passo et al., 2001), e não há nenhuma citação de dano à mucosa esofágica causada pelo T.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
64
inkin. Por outro lado, esta espécie tem sido isolada como agente de piedra branca
(Madariaga et al., 2003), pneumonia (Wynne et al., 2004), abscesso pulmonar (Piwoz et
al., 2000), infecção por cateter contaminado (Moretti-Branchini et al., 2001), endocardite
(Chaumentin et al., 1996, Ramos et al., 2004), peritonite (Lopes et al., 1997, Crowther et
al., 2003, Madariaga et al., 2003), nódulos cutâneos (Song et al., 2007, David et al., 2008),
e durante diagnóstico post mortem (Koyanagi et al., 2006). De acordo com o exame
endoscópico, esofagite por Trichosporon não pode ser clinicamente diferenciada daquela
causada por espécies de Candida.
Fatores de risco para trichosporonosis incluem imunossupressão, rompimento da
integridade da mucosa, uso de cateter venoso central e outras condições, tais como
malignidade hematológica, AIDS, transplantados, pacientes queimados, prematuros de
baixo peso e pacientes neutropênicos com câncer que recebem tratamentos citotóxicos
(Girmenia et al., 2005, Lacroix; Chauvin, 2005). No entanto, até o momento não há
qualquer citação de T. inkin causando esofagite em pacientes com câncer de pulmão.
O dano esofágico é uma condição localizada, embora possa resultar de uma causa
secundária. Segundo Ramos et al. (2004) e Song et al. (2007), a via de infecção por
Trichosporon provavelmente começa com a colonização da superfície da mucosa e quebra
de sua integridade, risco mais comum durante os ciclos de quimioterapia. No caso descrito,
o procedimento de desinfecção utilizado à endoscopia foi considerado totalmente seguro.
Considerando-se que as amostras de glutaraldeído estavam isentas de contaminantes, a
esofagite por T. inkin deve ter sido causada após infecção por outra via.
As opções terapêuticas para essa micose incluem fluconazol, ravuconazol,
posaconazol, voriconazol e anfotericina B (Chaumentin et al., 1996, Matsue et al., 2006,
Bayramoglu et al., 2008). Embora voriconazol possa ser considerada uma opção em
infecções por Trichosporon, a introdução deste medicamento no esquema terapêutico foi
difícil, devido à indisponibilidade deste antifúngico no hospital, e por esta razão, o perfil
de susceptibilidade in vitro para voriconazol não foi realizado. O uso de triazóis para casos
de tricosporonose tem sido considerado por alguns autores como satisfatório (Asada et al.,
1996); contudo, o caso descrito mostrou-se insensível ao fluconazol (150 mg/dia por 14
dias). A anfotericina B não representou a opção terapêutica naquele momento devido à
condição geral de saúde do paciente. Ademais, o tratamento ideal para tricosporonose é
atualmente incerto e a taxa de mortalidade ainda é bastante elevada (80-90%) nos casos de
infecção dissemidada (Koyanagi et al., 2006).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
65
A maioria das cepas de T. inkin são suscetíveis in vitro a polienos e azólicos. No
entanto, os resultados dos testes de susceptibilidade não garantem a mesma resposta in vivo
a estes compostos, e os fatores predisponentes do hospedeiro podem ter maior impacto
sobre a infecção do que os resultados de susceptibilidade como citado por Ramos et al.
(2004) e verificado por este caso. O paciente não retornou ao hospital após falha do
tratamento para um maior acompanhamento.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
66
Fig 1. Aparência endoscópica de esofagite grau I de Wilcox (a) e numerosos artroconídios
(indicados) ao exame direto (b). Aspectos macroscópico (c) e microscópico (d) de
Trichosporon inkin em ágar fubá (X 400).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
67
6. IDENTIFICAÇÃO DO DNA DE ESPÉCIES DE CANDIDA DA MUCOSA
ORAL E ESOFÁGICA: FATORES DE RISCO E SUA RELAÇÃO
MOLECULAR COM A PATOGÊNESE DA ESOFAGITE4
4
Artigo submetido: Macêdo, D.P.C., Oliveira, N.T., Farias, A.M.A., Chang, S.C., Wilheim, A.B., Neves,
R.P. DNA fingerprinting of Candida species from oral and esophageal mucosa: risk factors and molecular
relation with esophagitis pathogenesis. Fungal Genetics and Biology, Maio de 2011.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
68
Resumo
Candida é um dos micro-organismos que mais frequentemente causam infecções em
pacientes imunossuprimidos. Os objetivos deste estudo foram avaliar a candidíase oral
(CO) e esofágica (CE), os fatores de risco associados a estas micoses e determinar a
correlação molecular entre leveduras colonizadoras e patogênicas. Um total de 1.482
pacientes com sintomas gastrointestinais foi examinado. Destes pacientes, 41 apresentaram
lesões sugestivas de CE durante a endoscopia. Amostras da mucosa oral e do esôfago
foram obtidas e cultivadas em Sabouraud dextrose ágar. A identificação foi realizada por
métodos clássicos, automatizado e molecular. As espécies mais isoladas da mucosa oral e
esofágica foram C. albicans e C. glabrata. O polimorfismo inter e intraespecífico dos
isolados de Candida foi avaliado por meio da amplificação do DNA genômico pelo
método de PCR que utilizou um primer derivado de regiões dos espaços intergênicos
(T3B), e primers microssatélites (GTG)5 e (GACA)4. O primer (GACA)4 revelou
variabilidade inter e intraespecífica e nenhuma similaridade foi observada entre os isolados
orais e esofágicos, demonstrando a independência da patogênese entre CO e CE.
Palavras-chave: colonização oral, candidíase oral, candidíase esofágica, caracterização
molecular, fatores de risco
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
69
1. Introdução
Os seres humanos estão constantemente expostos a vários gêneros de fungos
através de diversas vias, permitindo a colonização do trato gastrointestinal. Dependendo da
interação entre os mecanismos de defesa do hospedeiro na mucosa, fatores de virulência
dos fungos e outros fatores de risco, a colonização pode ser transitória ou persistente
podendo causar doença localizada (Vazquez, 2010).
Entre os numerosos fungos patogênicos, o gênero Candida é o dominante
responsável por micoses em seres humanos. A espécie de levedura com maior prevalência
entre os isolados humanos é C. albicans, sendo esta considerada o principal patógeno
oportunista (Vazquez e Sobel, 2003), embora outras espécies, incluindo C. tropicalis, C.
glabrata, C. dubliniensis, C. parapsilosis, C. krusei e C. guilliermondii também tenham
sido isoladas (Tintelnot et al., 2000, Calderone, 2002, Macêdo et al., 2010).
A alta prevalência de colonização oral por Candida pode ser citada como um fator
predisponente para o desenvolvimento posterior da candidíase, incluindo a forma esofágica
(Katiraee et al., 2010). Conforme relatado, a candidíase de mucosa surge em indivíduos
colonizados por Candida que estão predispostos por doenças de base, medicamentos ou
pela redução da resistência local a um crescimento excessivo da sua própria microbiota
(Vazquez; Sobel, 2003, Vazquez, 2010).
O isolamento de espécies de Candida da mucosa oral saudável não exclui a
possibilidade do paciente desenvolver lesões esofágicas por estes mesmos microorganismos. Por esta razão, os objetivos deste estudo foram avaliar a candidíase oral (CO)
e esofágica (CE), os fatores de risco associados e comparar geneticamente os isolados de
Candida utilizando primer derivado de espaços intergênicos (T3B), e primer de regiões
microssatélites (Inter Sequência Simples Repetida - ISSR).
2. Material e Métodos
2.1 Diagnóstico micológico e avaliação dos fatores de risco
Amostras de secreções orais foram coletadas com swab de algodão esterilizado a
partir das lesões ou da mucosa saudável de pacientes com sintomas sugestivos para
esofagite. Em seguida, a endoscopia foi realizada por médico gastroenterologista com
auxílio de endoscópio EXERA 1.600 (Olympus Corp, Lake Success, NY) após jejum do
paciente durante a noite anterior. Os fibroscópios foram desinfetados com uma solução de
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
70
glutaraldeído a 2,6%. Após a observação direta de placas esbranquiçadas e exsudato na
mucosa esofágica, foram coletados fragmentos das lesões com pinça Medglobe ® em
condições estéreis. Os fragmentos foram então imersos em água destilada esterilizada
contendo cloranfenicol (50mg/L) e processados no Laboratório de Micologia Médica
(Departamento de Micologia da Universidade Federal de Pernambuco) para diagnóstico
micológico.
O exame direto de amostras de secreção oral foi realizado a fresco. Os fragmentos
de tecidos obtidos por biópsia foram clarificados com solução de hidróxido de potássio
(KOH) a 20% e analisados microscopicamente. Para a cultura, o meio utilizado foi
Sabouraud Dextrose Agar (SDA) (Difco) com cloranfenicol (50mg/L) contido em placas
de Petri, incubadas a 30°C e 37°C por até 15 dias. A identificação foi realizada de acordo
com Barnett et al. (2000) e De Hoog et al. (2000) com base nas características
morfofisiológicas da cultura, tais como auxanograma, zimograma, produção de ácido e
urease (método clássico), VITEK 120-bioMérieux (método automatizado) e pela biologia
molecular (Thanos et al, 1996, Mannarelli; Kurtzman, 1998).
Fatores de risco associados com o desenvolvimento das lesões orais e esofágicas
foram avaliados através dos dados contidos nos registros hospitalares, relacionando a
clínica com o uso de medicamentos e doenças prévias.
2.2 Relação molecular entre os isolados de Candida orais e esofágicos
A análise molecular foi desenvolvida apenas com os isolados de mesma espécie
obtidos da mucosa oral e esofágica do mesmo paciente.
2.2.1 Extração de DNA
Após a identificação das espécies pelo método clássico e automatizado, o DNA foi
extraído segundo o método de Gardes e Bruns (1993) no qual poucas colônias de leveduras
foram retiradas de uma placa com meio SDA e ressuspensas em 300 mL de tampão de
extração (composto por 100 mM Tris-HCl (pH 8,0), 1,4 M NaCl, 20 mM de EDTA,
brometo de cetiltrimetilamônio a 2% e b-mercaptoetanol a 2%). As células foram
enfraquecidas por três rodadas de congelamento e descongelamento, e esmagadas com um
micropistilo. Um volume de clorofórmio foi adicionado, e a mistura foi centrifugada a
13.000 g por 15 min. A fase superior foi removida, e o DNA foi precipitado com 600mL
de isopropanol frio. Após centrifugação por 10 min, o sedimento foi lavado com etanol a
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
71
70% e seco a 37ºC. O DNA isolado foi dissolvido em tampão TE e armazenado a 4ºC. A
concentração de DNA foi estimada por corrida em gel de agarose.
2.2.2 PCR fingerprinting
O DNA genômico dos 34 isolados de Candida (17 da cavidade bucal e 17 do
esôfago, ambos da mesma espécie) foram analisados e comparados.
Foram utilizados oligonucleotídeos como primers como as seqüências de repetição
simples (GTG)5 (Ali et al., 1986), (GACA)4 (Barros Lopes et al., 1996) e T3B (5'-AGG
TCG CGA CGG GTT ATC C) (McClelland et al., 1992), este último derivado dos espaços
intergênicos do tRNA (Thanos et al., 1996).
As reações de amplificação foram realizadas em volumes de 50 mL contendo de 1 a
25 ng do DNA molde, tampão de reação (10 mM Tris-HCl [pH 8,0], 50 mM KCl, 1,5 mM
MgCl2, 3 mM de acetato de magnésio), 200 mM de cada dATP, dCTP, dGTP e dTTP
(Fermentas®) e 1,5 U de Taq DNA polimerase (Fermentas®). O primer T3B foi
adicionado a uma concentração final de 25 pmol/50 µL de mistura do teste. (GTG)5 e
(GACA)4 foram utilizados a 5 pmol/50 µL.
As amostras foram cobertas com óleo mineral esterilizado (Sigma) e amplificadas
em um termociclador como se segue: desnaturação inicial por 5 min a 95ºC; desnaturação
por 15 segundos a 95ºC, anelamento por 30 segundos a 50ºC para os primers (GTG)5 e
(GACA)4, 52ºC para o primer T3B e extensão de 1,20 min a 72ºC. Esta foi seguida por um
ciclo de extensão final de 6 min a 72ºC. Os tubos com as reações foram mantidos a 4ºC
antes da análise. 32 ciclos de amplificação foram utilizados para todos os primers. As
amostras foram submetidas à eletroforese em gel de agarose a 1,2% em tampão TBE (pH
8,0) a 100V por 150 minutos e seus pesos moleculares foram determinados através de
marcador de 100pb (Invitrogen) e corados com brometo de etídio para fotografia. As
sequências de DNA foram analisadas quanto ao tamanho e comparadas.
3. Resultados
Os 1.482 pacientes examinados apresentavam sintomas gastrointestinais como
disfagia, náuseas e/ou vômitos, azia, odinofagia e dor abdominal. Destes, 41 apresentaram
lesões sugestivas de CE durante a endoscopia, tendo como fatores de risco o uso de
antibioticoterapia por período prolongado (17), infecção pelo HIV (13), diabetes mellitus
(2), doença hepática crônica (2), e o uso de corticosteróide (2). Casos isolados de
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
72
neoplasias, anemia crônica, lupus eritematoso sistêmico, doença de Chagas e cardiopatia
também foram verificados (Tabela 1).
Os exames diretos das amostras dos casos de CO e CE exibiram numerosas células
hialinas, esféricas a elipsoidais, com brotação e/ou pseudomicélio e micélio verdadeiro.
Culturas de coloração creme a branco e a presença de pseudomicélio à microscopia foram
observadas em alguns isolados.
A assimilação e fermentação de fontes carbono, a assimilação de fonte de
nitrogênio, bem como a não produção de ácido e urease identificaram os isolados como
Candida spp. Estes resultados foram semelhantes aos obtidos através do método
automatizado (VITEK 120) (Tabela 1).
Quanto às espécies de Candida isoladas da cavidade oral, C. albicans (74%) foi a
mais freqüente, seguida por C. glabrata (13,1%), C. parapsilosis (4,3%), C. tropicalis
(4,3%) e C. kefyr (4,3%). Apenas um paciente apresentou CO com presença de lesões em
placas esbranquiçadas aderidas à mucosa oral, causada por C. glabrata. Das lesões
esofágicas observadas à endoscopia pela presença de placas pseudomembranosas
esbranquiçadas aderidas à mucosa do órgão em diferents graus de acometimento, C.
albicans representou 83% dos agentes etiológicos, seguido por C. glabrata (7,4%) e por
outras espécies emergentes como C. parapsilosis (2,4%), C. tropicalis (2,4%), C. krusei
(2,4%) e C. guilliermondii (2,4%).
Os isolados que ocorreram no mesmo paciente, identificados como da mesma
espécie de Candida totalizaram 17 pares, sendo comparados por técnica padrão de
fingerprinting de DNA. As reações utilizando os primers (GTG)5 e T3B exibiram produtos
de amplificação semelhantes e reprodutíveis. No entanto, variações intraespecíficas
puderam ser melhor visualizadas com o primer (GACA)4, entre os pares 11 e 20 de C.
glabrata (Fig. 1). De forma semelhante, para os pares de C. albicans este mesmo marcador
foi mais sensível em destacar as variações intraespecíficas (Fig. 1). (GTG)5 e T3B não
distinguiram claramente essas cepas (Fig. 2 e 3).
4. Discussão
Do total de pacientes com sintomas sugestivos, 41 casos de CE foram confirmados.
A associação entre CE e CO foi verificada um apenas um paciente, nos demais casos
provavelmente ocorreu colonização oral por leveduras uma vez que havia um número
insignificante de estruturas fúngicas ao exame direto. De acordo com Vázquez e Sobel
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
73
(2003) e Vazquez (2010), espécies de Candida são freqüentemente isoladas da cavidade
oral, havendo aumento nas taxas de colonização devido à gravidade da doença e à
permanência hospitalar, conduzindo à doença fúngica neste sítio corpóreo.
O principal agente etiológico da CE foi C. albicans, responsável por 83% dos
casos. Até o momento, C. albicans continua sendo citado como o agente mais freqüente da
esofagite fúngica. Vários fatores contribuem para o estabelecimento da candidíase como o
uso prolongado de antibióticos de largo espectro e a Síndrome da Imunodeficiência
Adquirida (AIDS), como constatado com os pacientes avaliados nesta pesquisa. Estes
dados são importantes uma vez que esta doença ocorre em mais de 10% dos pacientes com
AIDS, debilitando ainda mais o estado geral destes indivíduos através da diminuição na
ingestão de alimentos com perda de peso associada (Vazquez, 2010).
Em um estudo recente com indivíduos infectados pelo HIV com candidíase
orofaríngea Katiraee et al. (2010) verificaram que C. albicans correspondeu a 50,2% dos
agentes e C. glabrata a 22%, enquanto as outras espécies não-C. albicans foram raramente
isoladas. Segundo estes autores, não houve diferença significativa no grau de colonização
oral e o desenvolvimento da candidíase orofaríngea entre pacientes que receberam
HAART e aqueles que não fizeram uso destas medicações, corroborando com os dados
apresentados nesta casuística.
Os casos de recidiva na CE representam causa de preocupação constante, uma vez
que o estabelecimento desta micose está diretamente relacionado com o grau de
imunossupressão dos indivíduos e às espécies de Candida envolvidas (Traeder et al.,
2008). Assim, o surgimento de diferentes espécies de Candida como agentes de esofagite
ressalta a importância do diagnóstico laboratorial micológico e de estudos epidemiológicos
para o controle desta micose. Neste trabalho, C. glabrata foi a segunda espécie mais
freqüente, considerada por alguns autores como emergente (Macêdo et al., 2008).
Com base nos resultados dos testes moleculares, a baixa capacidade de
discriminação dos iniciadores (GTG)5 e T3B foi constatada. Thanos et al. (1996)
verificaram distinção entre as espécies de Candida ao utilizarem o primer T3B em sua
pesquisa, correspondendo aos dados aqui apresentados, os quais revelaram apenas
semelhanças interespecíficas entre todos os isolados de C. albicans e C. glabrata. No
entanto, apesar dos padrões homogêneos obtidos pelos marcadores, (GACA)4 foi capaz de
demonstrar as diferenças entre os isolados, melhor distinguindo intraespecificamente as
cepas de Candida.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
74
Neste estudo, os resultados obtidos com o uso do primer ISSR (GACA)4 indicam
que cepas de Candida isoladas da cavidade oral e das lesões da CE não são as mesmas,
embora ao isolamento mesmo paciente tenham sido identificadas como da mesma espécie.
Distâncias genéticas podem ser sugeridas através da técnica de DNA fingerprinting,
pois esta técnica seleciona seqüências aleatórias de polimorfismos distribuídos por todo o
genoma (Welsh; McClelland, 1990, Boerlin et al., 1996). A proximidade genética é
deduzida a partir do número de fragmentos amplificados que duas linhagens ou espécies
têm em comum, como ocorreu com os isolados de Candida testados. As diferenças
observadas nesta pesquisa entre os isolados de uma mesma espécie e de espécies distintas
pode justificar a variação do grau de dano tecidual e resistência antifúngica comprovada
durante os tratamentos.
Agradecimentos
Este trabalho foi financiado pela Coordenação de Aperfeiçoamento de Pessoal de Nível
Superior (CAPES). Os autores gostariam de agradecer ao Departamento de Micologia da
Universidade Federal de Pernambuco pelas instalações e toda assistência.
Conflito de interesse
Os autores não relatam nenhum conflito de interesse neste trabalho.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
75
Tabela 1. Espécies de Candida isoladas da mucosa oral e esofágica e fatores de risco
associados com a candidíase.
Número do
paciente
1
2
5*
15
16
17
18
19
20
21
22
23
24
25
26
27
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
Espécie de Candida
presente na cavidade
oral
NG
NG
C. glabrata
C. albicans
NG
NG
NG
NG
C. albicans
C. albicans
C. glabrata
C. albicans
C. albicans
C. albicans
NG
C. albicans
C. albicans
C. albicans
C. albicans
C. glabrata
C. albicans
NG
NG
C. albicans
NG
C. albicans
C. albicans
NG
NG
C. kefyr
C. albicans
C. tropicalis
C. parapsilosis
C. albicans
C. albicans
NG
NG
NG
NG
Espécie de Candida agente de
esofagite
Fatores de risco
uso de antibiótico
uso de antibiótico
diabetes mellitus
cardiopatia
uso de antibiótico
uso de antibiótico
AIDS
AIDS
uso de antibiótico
AIDS
Doença de Chagas
AIDS
uso de antibiótico
AIDS
uso de antibiótico
doença hepatica crônica
Anemia crônica
uso de antibiótico
AIDS
AIDS
AIDS
AIDS
AIDS
AIDS
Cancer no timo
uso de antibiótico
diabetes mellitus
uso de antibiótico
uso de antibiótico
AIDS
uso de antibiótico
uso de antibiótico
uso de antibiótico
AIDS
uso de antibiótico
uso de corticosteróides
doença hepatica crônica
uso de antibiótico
lupus eritematoso
sistêmico
52
NG
C. albicans
uso de corticosteróides
53
NG
C. albicans
uso de antibiótico
*Caso de candidíase oral; NG: sem crescimento; AIDS: Síndrome da Imunodeficiência Adquirida
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. parapsilosis
C. albicans
C. albicans
C. albicans
C. albicans
C. glabrata
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. tropicalis
C. albicans
C. glabrata
C. albicans
C. krusei
C. glabrata
C. albicans
C. albicans
C. albicans
C. guilliermondii
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
76
Figura 1. Perfil de amplificação dos isolados de Candida albicans e C. glabrata (22A-B,
32A-B) obtidos a partir da cavidade oral e esôfago com iniciador (GACA)4. Linha M:
marcador de 100pb. (A: isolados orais; B: isolados esofágicos)
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
77
Figura 2. Perfil de amplificação dos isolados de Candida albicans e C. glabrata (22A-B,
32A-B) obtidos a partir da cavidade oral e esôfago com iniciador (GTG)5. Linha M:
marcador de 100pb. (A: isolados orais; B: isolados esofágicos)
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
78
Figura 3. Perfil de amplificação dos isolados de Candida albicans e C. glabrata (22A-B,
32A-B) obtidos a partir da cavidade oral e esôfago com iniciador T3B. Linha M: marcador
de 100pb. (A: isolados orais; B: isolados esofágicos)
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
79
7. ATIVIDADE FUNGICIDA IN VITRO DA PRÓPOLIS VERMELHA
BRASILEIRA: UMA OPÇÃO TERAPÊUTICA CONTRA A CANDIDÍASE
ESOFÁGICA5
5
Artigo a ser submetido: Macêdo, D.P.C., Lima-Neto, R.G., Oliveira, P.C., Silva, V.K., Farias, A.M.A.,
Leal, A.F.G., Pacheco, E., Neves, R.P. In vitro antifungal activity of Brazilian red propolis: a therapeutic
option against esophageal candidiasis. Letters in Applied Microbiology.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
80
Resumo
Objetivos: A atividade in vitro das amostras de própolis vermelha (Pv) coletadas nas
margens de estuários da região Nordeste do Brasil foi avaliada contra isolados de Candida
spp. obtidos de pacientes com candidíase esofágica (CE).
Métodos e Resultados: A atividade antifúngica de Pv foi testada contra espécies de
Candida isoladas de pacientes com CE, utilizando o fluconazol (Flz) como controle. A
concentração inibitória mínima foi determinada seguindo o método de microdiluição
indicado pelo Clinical and Laboratory Standards Institute. A concentração fungicida
mínima foi determinada pela ausência de crescimento em ágar Sabouraud dextrose. Os
dados obtidos mostraram que a atividade antifúngica de Pv variou de 32 a 512 µg/mL.
Conclusões: Este trabalho enfatiza a importância do potencial antifúngico de Pv frente a
espécies de Candida, como um tratamento alternativo contra CE, apesar de experimentos
in vivo serem essenciais para seu uso terapêutico no futuro.
Significado e impacto do estudo: Este estudo foi pioneiro quanto à avaliação das
propriedades antifúngicas da Pv frente a isolados de Candida agentes de CE. A atividade
antifúngica destes compostos naturais sugere um potencial aplicável para CE isoladamente
ou em combinação com Flz.
Palavras-chave: atividade antifúngica, própolis vermelha, Candida spp, susceptibilidade
antifúngica
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
81
Introdução
Candidíase esofágica (CE) tem ocorrido predominantemente em indivíduos
imunossuprimidos, como resultado de fatores predisponentes devido a vários distúrbios
endócrinos, neoplasias, uso de corticosteróides, antibioticoterapia prolongada, síndrome da
imunodeficiência adquirida (AIDS) e outras condições. Candida albicans ainda é o
principal agente causador desta micose, seguida por outras espécies emergentes como C.
parapsilosis, C. tropicalis, C. glabrata, C. guilliermondii e C. krusei (Underwood et al.,
2003, Manfredi et al., 2007, Traeder et al., 2008, Cascio et al., 2010, Macêdo et al., 2010).
Atualmente, o fluconazol é considerado droga de escolha para o tratamento da CE
uma vez que pode ser absorvido em qualquer condição de pH gástrico, com efeitos
mínimos sobre a síntese de esteróides, além de ser considerado geralmente seguro e bem
tolerado (Darouiche, 1998, Rex et al., 2000, Vázquez, 2003, Wilheim et al., 2009). No
entanto, algumas cepas de Candida são resistentes a este azol (Redding et al., 1994,
Vazquez et al., 2010). Altas taxas de recorrência e persistência de fungos provocam uma
crescente preocupação entre os médicos sobre o aumento no número de casos de
candidíase refratários aos tratamentos padrões (Cowen; Steinbach, 2008).
Durante o desenvolvimento de estratégias terapêuticas alternativas para o
tratamento de CE, produtos naturais com propriedades antifúngicas têm sido bastante
explorados. Após estudos bioquímicos sobre a composição e atividade antimicrobiana da
própolis, vários novos tipos têm sido explorados e testados contra fungos patogênicos
(Kujumgiev et al., 1999, Gurgel et al., 2005, Santos et al., 2005).
Uma nova própolis vermelha do nordeste do Brasil produzida por abelhas Apis
mellifera a partir da coleta de exsudato resinoso de coloração vermelha de Dalbergia
ecastophyllum (L) Taub. tem sido citado pelas suas propriedades terapêuticas; contudo
informações científicas sobre a sua atividade antifúngica ainda é escassa (Trusheva et al.,
2006).
O objetivo deste estudo foi avaliar as propriedades antifúngicas in vitro do extrato
de própolis vermelha frente a 41 isolados de Candida obtidos de pacientes diagnosticados
com CE.
Materiais e métodos
Isolados fúngicos
Quarenta e uma amostras de Candida spp. obtidas de pacientes com CE, atendidos
no setor de endoscopia digestiva do Hospital Universitário Oswaldo Cruz, foram
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
82
analisadas neste estudo. Dos pacientes com lesões fortemente sugestivas para a micose
foram coletados fragmentos de tecidos, colhidos por biópsia. As amostras clínicas foram
processadas no Laboratório de Micologia Médica da Universidade Federal de Pernambuco
(UFPE) para diagnóstico micológico, usando o método padrão (exame direto e isolamento
em cultura), automatizado (VITEK 120) e métodos moleculares complementares.
O exame direto foi realizado com solução de 20% de hidróxido de potássio (KOH).
As culturas foram preparadas em meio Sabouraud dextrose ágar (SDA) (Difco) acrescido
de cloranfenicol (50 mg/L) e incubadas a 30 e 35ºC, em uma atmosfera aeróbica durante
10 dias. Culturas puras foram transferidas para a superfície do meio SDA enriquecido com
extrato de levedura para identificação taxonômica (Barnett et al., 2000, De Hoog et al.,
2000). C. albicans (34), C. glabrata (3), C. parapsilosis (1), C. guilliermondii (1), C.
tropicalis (1) e C. krusei (1) foram os agentes etiológicos isolados dos casos de CE. C.
parapsilosis (ATCC 22019) e C. krusei (ATCC 6528) foram as cepas padrão utilizadas.
Atividade antifúngica
A metodologia utilizada seguiu as condições estabelecidas pelo documento em
M27-A3 (CLSI, 2008). O meio de cultura utilizado durante os experimentos foi RPMI
1640 (Sigma-Aldrich, EUA) com L-glutamina e sem bicarbonato de sódio, pH 7,0 ± 0,1,
com ácido morfolino-propanossulfônico (MOPS; 0,165 mol-1, Sigma-Aldrich). O meio foi
esterilizado por filtração, em membranas de 0,22 µm, (Millipore, Darmstadt, Alemanha).
A droga comercial utilizada para comparação foi fluconazol (Flz, Pfizer, New
York, EUA), preparada em água destilada. Foram utilizadas dez concentrações diferentes,
variando de 0,125-64 µg ml-1 para Flz. Própolis vermelha (Pv) (Apiário Apimel, João
Pessoa - Paraíba, Brasil) foi diluída em DMSO com concentrações testadas variando de 21,024 µg ml-1.
Os isolados de Candida foram cultivados em meio SDA e incubados a 35ºC. As
suspensões destas leveduras foram preparadas e a densidade foi ajustada de acordo com a
escala padrão 0,5 de MacFarland, para a transmissão de 90% usando um
espectrofotômetro. O volume do inóculo foi ajustado para 5 ml de solução salina
esterilizada, sendo posteriormente diluído em RPMI 1640 para uma concentração de 25x103 células ml-1.
Para os testes de susceptibilidade, microplacas com 96 poços de fundo chato (TPP;
Trasadingen, Suíça) foram utilizadas e os procedimentos seguiram o Clinical and
Laboratory Standards Institute (CLSI, 2008). O inóculo foi adicionado aos poços com as
drogas testadas, e as placas foram incubadas a 25ºC por três dias antes da leitura dos
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
83
resultados para determinação da concentração inibitória mínima (CIM) do Flz e Pv. A
inibição do crescimento foi demonstrada pela observação visual.
O CIMs para Flz foram as concentrações capazes de inibir o crescimento das
leveduras ≥ 80% (CLSI, 2008). Para Pv, a CIM foi determinada pela inibição em 100%
quando comparada ao crescimento dos poços controles.
Para determinar a concentração fungicida mínima (CFM) de Flz e Pv, o conteúdo
dos poços que apresentaram de 80 a 100% de inibição do crescimento por Flz e 100% de
inibição pela Pv foi transferido para placas de Petri contendo SDA. As placas foram então
incubadas a 35ºC, por três dias, para determinar a viabilidade fúngica. A CFM foi
confirmada pela ausência de crescimento fúngico. Cada experimento foi realizado em
duplicata. As CIM e CFM para cada agente antifúngico foram determinadas.
Resultados
O método do CLSI utilizado nos testes de susceptibilidade a Flz e Pv apresentou
valores de CIM que variaram inter e intraespecificamente. Entre as 41 cepas, incluindo C.
albicans, C. glabrata, C. guilliermondii, C. krusei, C. parapsilosis e C. tropicalis, os
valores de CIM variaram entre 0,125-32 µg ml-1 para fluconazol e 32-512 µg ml-1 para Pv.
Todos os isolados testados frente a Pv apresentaram valores correspondentes tanto para
atividade fungistática quanto fungicida; contudo estes mesmos microrganismos
apresentaram apenas atividade fungistática frente ao Flz.
Os menores valores de CIM foram 0,125 µg ml-1 de Flz frente C. albicans e 32 µg
ml-1 de Pv frente C. albicans e espécies não- C. albicans. Sete cepas de Candida foram
dose-dependente ao Flz, porém sensíveis a Pv (Tabela 1).
Entre as amostras analisadas, uma amostra de C. glabrata apresentou o mesmo
valor da CIM (32 µg ml-1) para Flz e Pv.
Discussão
Alguns autores descreveram a atividade antifúngica de diferentes tipos de própolis
contra espécies de Candida variadas (Sawaya et al., 2002, Oliveira et al., 2006),
Cryptococcus neoformans (Fernandes et al., 2007), Trichophyton rubrum, T.
mentagrophytes (Koc et al., 2005, Siqueira et al., 2008) e Paracoccidioides brasiliensis
(Murad et al., 2002). No entanto, não há dados que relacionem a atividade antifúngica da
própolis vermelha contra espécies de Candida.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
84
Bastante atenção tem sido focada na própolis de Populus sp. (Salicaceae) e
Baccharis dracunculifolia (Asteraceae); contudo, informações científicas sobre os demais
tipos de própolis ainda é escassa. A própolis verde brasileira é realmente a mais estudada
quanto ao perfil de suscetibilidade contra espécies de Candida (Daugsch et al., 2008).
A própolis vermelha é um novo tipo de própolis produzida em regiões próximas aos
manguezais, a partir da coleta pelas abelhas Apis mellifera de resina de vegetação arbustiva
com um alto teor de flavonóides, substâncias que desempenham seu potencial
antimicrobiano (Trusheva et al., 2006, Daugsch et al., 2008), explicando a sua propriedade
fungicida mesmo contra cepas resistentes ou dose dependentes ao fluconazol, considerado
droga padrão para a CE. Espécies emergentes de Candida agentes de CE representam um
problema, uma vez que casos de resistência por espécies não-C. albicans estão se tornando
cada vez mais frequentes, especialmente em indivíduos tratados profilaticamente com Flz
ou mesmo com outros derivados azólicos (Cowen; Steinbach, 2008, Wilheim et al., 2009).
Outros pesquisadores demonstraram CIM e CFM em concentrações mais elevadas
utilizando a própolis verde tendo verificado efeito fungistático de 3,8 mg ml-1 frente C.
albicans e 2,1 mg ml-1 frente C. tropicalis. A CFM observada variou de concentrações de
1,6 mg ml-1 a 9 mg ml-1 (Ota et al., 2001, Fernandes et al., 2007). Em contraste,
concentrações mais baixas utilizando a Pv foram suficientes para inibir ou matar as cepas
de Candida spp. testadas neste trabalho.
Martins et al. (2002) avaliaram a suscetibilidade de 12 cepas de C. albicans,
provenientes de pacientes HIV-positivos com candidíase oral, testando um extrato de
própolis alcoólico a 20% (EPA) comercial. Além disto, os autores compararam à ação
inibitória dos antifúngicos comerciais como nistatina (Nis), clotrimazol (Cl), econazole
(Ec) e fluconazol (Flz). EPE inibiu todas as cepas de C. albicans testadas sendo observadas
diferenças significativas entre a ação da própolis e dos demais fármacos, sugerindo EPE
como forma alternativa de tratamento para candidíase oral em pacientes HIV-positivos.
Opções terapêuticas utilizando alguns tipos de própolis no tratamento de candidíase
oral e vulvovaginal já foram propostas (Santos et al., 2005, Santos et al., 2008, DalbenDota et al,. 2010). Entretanto, ainda não foram descritos ensaios in vitro ou in vivo
utilizando Pv como alternativa terapêutica na candidíase esofágica. Nunes et al. (2009)
afirmam que a comercialização da Pv como medicamento necessita da tipificação dos
compostos desta própolis, uma vez que diferentes origens botânicas, espécies de
abelhas/raças e as variações sazonais tornam essa resina bioquimicamente complexa.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
85
Pesquisas que busquem formas de tratamento antimicótico mais baratas e eficazes e
que evitem o desenvolvimento da resistência in vitro e clínica são urgentes, uma vez que
CE é considerada uma das mais frequentes e recidivantes micoses oportunistas do mundo
(Vazquez, 2010). Assim, a própolis vermelha brasileira sugere ser uma excelente opção
diante dos dados obtidos, exigindo a continuidade das análises para obtenção de
parâmetros de eficácia in vivo.
Agradecimentos
Este trabalho foi financiado pela Coordenação de Aperfeiçoamento de Pessoal de Nível
Superior (CAPES). Os autores gostariam de agradecer ao Departamento de Micologia da
Universidade Federal de Pernambuco pelas instalações e toda assistência.
Conflito de interesse
Nenhum.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
86
Tabela 1. Determinação da concentração inibitória mínima de fluconazol e própolis
vermelha frente a espécies de Candida associadas com candidíase esofágica.
Número do
isolado
1
2
5
15
16
17
18
19
20
21
22
23
24
25
26
27
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
ATCC 22019
ATCC 6528
Espécie do isolado
Candida albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. parapsilosis
C. albicans
C. albicans
C. albicans
C. albicans
C. glabrata
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. tropicalis
C. albicans
C. glabrata
C. albicans
C. krusei
C. glabrata
C. albicans
C. albicans
C. albicans
C. guilliermondii
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. albicans
C. parapsilosis
C. krusei
CIM: concentração inibitória mínima
Fluconazol
(MIC/ µg ml-1)
4
0.5
32
1
0.125
0.5
0.25
0.125
0.125
0.125
4
0.125
32
0.25
0.5
0.125
0.125
16
0.125
32
32
4
2
0.125
0.5
0.25
4
2
0.5
4
32
0.125
0.125
1
0.5
4
0.25
32
1
0.125
0.125
0.25
0.25
Própolis vermelha
(MIC/ µg ml-1)
128
256
256
256
32
32
128
128
64
128
256
256
256
256
128
256
256
256
64
32
256
32
32
256
64
256
64
256
64
256
256
128
256
256
256
256
128
512
128
256
256
64
64
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
87
8. ATIVIDADE IN VIVO DA PRÓPOLIS VERMELHA E FLUCONAZOL
CONTRA ESOFAGITE POR CANDIDA: EFEITOS TERAPÊUTICOS DA
ADMINISTRAÇÃO SIMPLES E COMBINADA6
6
Artigo a ser submetido: Macêdo, D.P.C., Lima-Filho, J.V.M., Leal, A.F.G., Andrade, S.L., Ventura, R.F.,
Silva, A.F.B., Ralph, M.T., Pacheco, E., Pontes-Filho, N.T., Neves, R.P. In vivo activity of red propolis and
fluconazole against Candida esophagitis: therapeutic effects of simple and combined administration. Clinical
Microbiology and Infection.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
88
RESUMO
A atividade antifúngica in vivo do extrato de própolis vermelha em um modelo
experimental de candidíase esofágica foi investigada. Os camundongos foram
imunossuprimidos com doses diárias de dexametasona (0,5 mg/animal) por via
intraperitoneal durante 14 dias, com intervalos de três dias. A infecção foi realizada após o
período de imunossupressão com 1x108 células viáveis de Candida albicans URM6285
por swab via intra-esofágica seguida pela administração intragástrica de 0,2 mL desta
suspensão. Cloridrato de tetraciclina a 0,08% foi adicionado à água oferecida ad libitum
uma semana antes da infecção. Sete dias após a infecção, os camundongos foram divididos
em 6 grupos (N = 5) e tratados diariamente por via oral com fluconazol (Flz) e extrato de
própolis vermelha (Rp) em diferentes doses (1 -Flz 15 mg/kg, 2 -Flz 10 mg/kg:Rp 25
mg/kg, 3 -Flz 5 mg/kg:Rp 50 mg/kg; 4 -Flz 1 mg/kg:Rp 100 mg/kg; 5 -Rp 150mg/kg; 6 DMSO 25% :Tween 10% em PBS) por sete dias. O tratamento com Rp 150 mg/kg/dia
eliminou a levedura das mucosas da língua e do esôfago, quando comparado ao grupo não
tratado. Este resultado foi semelhante aos obtidos com Flz:Rd em diferentes concentrações
sendo confirmado através de exame histopatológico, que mostrou uma redução do processo
infeccioso com aparência normal da mucosa oral e esofágica. Este estudo destaca a
possível utilização do Rp isoladamente ou em combinação com medicamentos antifúngicos
comerciais para o tratamento de candidíase esofágica.
Palavras-chave: Própolis vermelha, fluconazol, Candida, candidíase oral, candidíase
esofágica experimental.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
89
Introdução
Leveduras do gênero Candida são os principais fungos que causam uma variedade
de formas clínicas superficiais recorrentes, especialmente na mucosa oral e esofágica. O
crescimento maciço e contínuo de C. albicans no lúmen do esôfago provoca a colonização
do trato digestivo, mas também aumenta o risco de candidíase sistêmica, principalmente
em pacientes imunossuprimidos. Além disso, casos de candidíase de alta letalidade entre
pacientes graves exige a introdução de novas opções terapêuticas (Macêdo et al., 2010).
Atualmente fluconazol é considerado o tratamento de escolha para candidíase
esofágica e a administração oral de antifúngicos azólicos pode ser eficaz, mas casos de
resistência e efeitos adversos são comuns (Traeder et al., 2008).
Como alternativa ao tratamento convencional da candidíase esofágica, produtos
naturais e substâncias derivadas com propriedades antifúngicas têm sido propostas (Barros
et al., 2007). Assim, alguns tipos de própolis têm sido amplamente relatados, uma vez que
apresentam muitas propriedades farmacológicas, tais como antibacteriana, antiviral, antiinflamatória, anestésica, citostática e antifúngica (Marcucci, 1995, Kujumgiev et al., 1999,
Pereira et al., 2002, Cicala et al., 2003). A própolis verde tem sido amplamente
comercializada e utilizada para o tratamento de várias doenças (Santos et al., 2005, Amaral
et al., 2006, Galvão et al., 2007); no entanto, outras opções ainda estão em estudos
preliminares como a própolis vermelha, uma substância resinosa produzida por abelhas
(Apis mellifera) a partir de Dalbergia ecastophyllum (L) Taub. (Daugsch et al., 2008).
O objetivo desta pesquisa foi avaliar o efeito simples e combinado do extrato de
própolis vermelha e fluconazol em um modelo animal de candidíase esofágica.
MATERIAL E MÉTODOS
Candida albicans URM6285 e atividade antifúngica in vitro
Os testes in vitro foram realizados por método padrão (CLSI, 2008) com um total
de 41 cepas de Candida agentes de esofagite para posterior seleção de um isolado. Para
realizar a avaliação in vivo, C. albicans URM6285 foi selecionada e estocada na Coleção
de Culturas Micoteca URM (Universidade Federal de Pernambuco-UFPE, Recife, Brasil).
O isolado foi obtido de um paciente com AIDS que apresentou lesões esofágicas grau 3 de
Wilcox e a seleção foi baseada na sua virulência e perfil de suscetibilidade aos antifúngicos
através da determinação da concentração inibitória mínima (CIM) e concentração
90
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
fungicida mínima (CFM) contra o extrato de própolis vermelha (Rp) (2 a 1024 µg/mL) e
fluconazol (Flz) (4 a 64 µg/mL). A leitura da CIM foi estimada como a menor
concentração que causou a inibição visível do crescimento após um período de incubação
de 72 horas a 37ºC.
Animais
Camundongos suiços adultos fêmeas, com seis semanas de idade, pesando
aproximadamente 30g foram utilizados neste estudo. Um número mínimo de animais (n =
5 por grupo) foi utilizado em todos os experimentos, a fim de respeitar as regras atuais para
uso de animais em experimentação, totalizando 30. Estes foram mantidos em um local com
iluminação controlada (ciclos claro-escuro de 12 horas), bem como temperatura (25ºC) e
umidade (60-70%), com oferta de água e dieta comercial esterilizada (Purina, Paulínia, SP,
Brasil) ad libitum. Os animais foram tratados de acordo com os procedimentos
estabelecidos, seguindo o "Guia para o cuidado e uso de animais de laboratório" do
Conselho Nacional de Pesquisa, após aprovação do Comitê de Ética Animal (Centro de
Ciências Biológicas da UFPE) protocolo n º 23076.006668/2009-29.
Desenho experimental
Os procedimentos experimentais dos modelos de candidíase oral e esofágica foram
desenvolvidos com camundongos imunossuprimidos (IS=30 animais), induzidos pelo
tratamento subcutâneo com uma dose de 100 mg/kg de dexametasona por 14 dias antes da
infecção do esôfago com três dias de intervalo. Cloridrato de tetraciclina na dose de 0,08%
foi adicionado à água de beber oferecida aos animais, tendo início este tratamento uma
semana antes da infecção.
O isolado de C. albicans URM6285 foi cultivado em Sabouraud Dextrose Agar
(SDA/Difco) a 37ºC e seriadamente diluído em tampão fosfato (PBS) para atingir uma
suspensão contendo 108 UFC/mL.
Duas horas antes da infecção por Candida, os animais foram mantidos em jejum e
após este período foi realizada inoculação com swab uretral saturado com 1x108
células/mL de C. albicans em PBS (Clancy et al., 2009) e com uma agulha de cabeça
redonda (39 mm de comprimento, Fuchigami, Ltd, Kyoto) acoplada em seringa contendo
0,2 ml da suspensão, sendo posicionada logo abaixo da faringe do animal, após o primeiro
procedimento. O grupo controle foi inoculado com 0,2 ml de PBS, de acordo com os
mesmos
procedimentos
experimentais.
Os
camundongos
foram
acompanhados
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
91
diariamente, durante 30 dias, para observação dos sinais clínicos e estresse (Ishibashi et al.,
2007).
Avaliação dos sinais clínicos
Os animais que foram submetidos ao teste de longa duração (30 dias) foram
avaliados quanto aos sinais clínicos, tais como prostração e perda de peso a partir do
inóculo inicial com C. albicans.
Tratamento da esofagite por Candida com extrato de própolis vermelha e fluconazol
Sete dias após a infecção, os animais foram tratados por via oral (0,4 mL),
diariamente, com doses simples e combinadas
de extrato de própolis vermelha e
fluconazol em seis grupos experimentais: grupo 1- Flz 15 mg/Kg; grupo 2- Flz 10
mg/Kg:Rp 25mg/Kg; grupo 3- Flz 5 mg/Kg:Rp 50 mg/Kg; grupo 4- Flz 1 mg/Kg:Rp 100
mg/Kg; grupo 5- Rp 150 mg/Kg e grupo 6- DMSO 25%:Tween 10% in PBS.
Fluconazol foi utilizado em combinação com o extrato de própolis vermelha para
comparar os efeitos do tratamento com redução das dosagens do azol.
Contagem de células de C. albicans
Uma alíquota de sangue foi coletada por punção cardíaca, após a eutanásia com
halotano, para contagem total e diferencial de leucócitos. A língua e o esôfago foram
pesados e macerados em PBS (1:10 ou 1:100, p/v). Todas as amostras foram submetidas a
diluições seriadas e alíquotas de 0,1 mL foram semeadas em placas contendo SDA
acrescido de cloranfenicol (50 mg/mL) e incubadas a 37°C por 24-72 h. Os dados foram
apresentados como unidades formadoras de colônia (UFC)/g de órgão ou por mL de
sangue.
Exame direto e histopatológico
Amostras dos tecidos da língua e do esôfago dos camundongos sacrificados um dia
após o final do tratamento (8º dia) foram clarificadas com KOH 20% para exame direto e
fixadas em formol a 10%, processadas em rotina histológica e emblocadas para serem
embebidas em parafina para análise histopatológica. As secções histológicas (5 µm) foram
coradas com hematoxilina-eosina e examinadas por um único patologista, que desconhecia
as condições experimentais de todos os grupos.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
92
Análise estatística
A significância estatística quanto à contagem de leucócitos e das UFCs foi avaliada
pela análise de variância (ANOVA) seguido pelo teste-t Student. O nível de significância
foi determinado em p <0,05.
RESULTADOS
Suscetibilidade in vitro de C. albicans URM6285
O CIM obtido foi 128μg/mL para o extrato de própolis vermelha e 8μg/mL para
fluconazol contra C. albicans URM6285 através do método descrito pelo CLSI (2008).
Esofagite experimental por Candida
A imunossupressão por dexametasona aplicada aos camundongos suíços foi
confirmada pela contagem total (920-940/mm3) e diferencial de neutrófilos (23,5-29,2%).
C. albicans URM6285 produziu uma infecção local nos animais com o isolamento de 104105 UFC/g na língua e no esôfago, sete dias pós-infecção. Os animais apresentaram perda
de peso, fadiga e diminuição na ingestão de água e alimentos. O efeito da infecção por C.
albicans foi verificado através de exame direto que apresentou numerosas células de
leveduras agrupadas e isoladas também presentes no histopatológico, numerosas células
em brotamento, além de pseudomicélio e micélio verdadeiro (Figura 1).
Tratamento da candidíase oral e esofágica
Sete dias após o tratamento, o exame microscópico direto exibiu uma redução
qualitativa e quantitativa do número de células aderidas à mucosa infectada no grupo 3, 4 e
5 (Figura 2). Os resultados pós-tratamento com dose simples e combinada de extrato de
própolis vermelha e fluconazol mostraram uma diminuição na população de C. albicans na
língua e no esôfago baseada na contagem de UFC. Além disso, o fungo foi eliminado da
língua e do esôfago e a carga fúngica foi reduzida nos grupos 2, 3, 4 e 5 tratados, 14 dias
pós-infecção, apresentando diferença significativa do resultado no Grupo 6 (Figura 3). A
diferença estatística entre os grupos 1 e 6 não foi significativa, indicando que a eficácia
terapêutica de Flz 15 mg/kg foi equivalente ao grupo controle.
O exame histopatológico apresentou numerosas células de leveduras no grupo não
tratado e ausência de resposta inflamatória com redução da população de células viáveis de
Candida nos tecidos, especialmente nos grupos tratados com própolis vermelha (Figura 2).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
93
A contagem diferencial de leucócitos exibiu diferença significativa quanto ao
número de linfócitos e neutrófilos, quando comparada à contagem realizada nos mesmos
animais ao final da imunossupressão e antes da infecção. O número de monócitos
apresentou diferença quando comparado ao resultado da contagem realizada com os
animais ainda saudáveis e sem imunossupressão.
DISCUSSÃO
O tratamento simples e combinado com extrato de própolis vermelha resultou em
uma recuperação clínica considerável durante os experimentos. Após a análise dos
diferentes tratamentos entre os grupos foi verificada eficácia significativa nos Grupos 2, 3,
4 e 5 tratados com extrato de própolis vermelha. Além disso, o uso de fluconazol mostrou
melhores resultados quando combinado com o extrato de própolis vermelha demonstrando
a influência de produtos naturais no tratamento da candidíase. Este efeito protetor foi
confirmado através dos exames micológico e histopatológico (Figura 2 e 3).
A identificação dos componentes e modelos in vitro com a própolis vermelha
brasileira confirmou a atividade bactericida, anti-radical livre, anti-câncer, antiinflamatória e antifúngica (Basnet et al., 1997, Kanazawa et al., 2003, Trusheva et al.,
2006, Aslan et al., 2007, Franchi-Júnior et al., 2007). Os resultados obtidos nesta pesquisa
demonstraram mais uma vez que a própolis vermelha apresenta efeitos mais positivos do
que o esperado. As opções apresentadas para o tratamento experimental foram
desenvolvidas, principalmente, devido à falta de estudos que investiguem as propriedades
antifúngicas desta nova própolis contra a candidíase esofágica.
A maioria dos camundongos tratados com própolis vermelha + fluconazol exibiu
aspecto histológico com sinais de recuperação das mucosas enquanto que os animais
tratados com fluconazol apresentaram sinais de destruição da levedura, porém com uma
discreta infiltração de células inflamatórias, especialmente na mucosa do esôfago. Os
resultados obtidos sugerem que o extrato de própolis vermelha foi eficiente, tanto na forma
de administração simples quanto associada com o fluconazol, uma vez que não foi
observada diferença significativa entre os animais tratados com fluconazol e o grupo
controle. Ademais, o extrato de própolis vermelha teve efeito protetor direto contra as
células de C. albicans.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
94
AGRADECIMENTOS
Os autores agradecem à CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível
Superior) e ao CNPq (Conselho Nacional de Desenvolvimento Científico e Tecnológico)
pelo financiamento da pesquisa e ao Biotério do CPqAM (Centro de Pesquisas Aggeu
Magalhães) pelo fornecimento dos animais utilizados neste estudo.
TRANSPARÊNCIA DE DECLARAÇÕES
Nada a declarar.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
A
B
C
D
95
Figura 1. Modelo experimental de candidíase esofágica em camundongos
imunossuprimidos com dexametasona, apresentando ao exame direto do tecido da
mucosa do esôfago (A) e língua (C) numerosos blastoconídeos, pseudomicélio e
micélio verdadeiro típicos de Candida e numerosas células de leveduras viáveis ( )
infectando toda a mucosa do esôfago (B) e da língua (D) ao exame histopatológico
corado com hematoxilina-eosina (400X).
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
A
B
C
D
96
Figura 2. Modelo experimental de candidíase esofágica em camundongos tratados
oralmente com extrato de própolis vermelha, apresentando redução qualitativa e
quantitativa das estruturas de Candida albicans ao exame direto da mucosa do esôfago
(A) e língua (C) e células de leveduras fragmentadas ( ) com sinais de normalização
da camada serosa da mucosa do esôfago ( ) (B) e língua (D) ao exame histopatológico
corado com hematoxilina-eosina (400X).
97
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
*
*
*
*
*
Figura 3. Contagem de Unidades Formadoras de Colônias (UFC) de Candida albicans
viáveis na língua e esôfago de camundongos suíços fêmeas com candidíase esofágica. A
concentração do inóculo foi de 1 x 108 UFC/mL. Após diluições seriadas dos órgãos
infectados foi realizado plaqueamento em ágar Sabourand Dextrose, sendo a
quantificação realizada após 48 horas a 37ºC.
* Diferença estatística entre os grupos experimentais e o grupo controle com p < 0,05.
G1: Fluconazol 15mg/kg
G 2: Fluconazol 10 mg/kg + Própolis Vermelha 25 mg/kg
G3: Fluconazol 5 mg/kg + Própolis Vermelha 50 mg/kg
G4: Fluconazol 1 mg/kg + Própolis Vermelha 100 mg/kg
G 5: Própolis Vermelha 150 mg/kg
G 6: DMSO 25%:Tween 10% in PBS
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
98
9. CONSIDERAÇÕES GERAIS
Com base nos resultados obtidos pode-se concluir que:
¾ Colonização e levedurose oral por espécies de Candida associam-se a casos de
candidíase esofágica e ocorre em imunocompetentes e imunossuprimidos.
¾ Pacientes com candidíase esofágica apresentam como fatores de risco o uso
prolongado de antibióticos de largo espectro e corticóides, infecção por HIV, diabetes
mellitus, neoplasias, cardiopatia, anemia crônica, doença de Chagas, doença hepática
crônica e lúpus eritematoso sistêmico.
¾ Candida albicans predomina como agente etiológico de candidíase esofágica seguida
por C. glabrata, C. parapsilosis, C. tropicalis, C. krusei e C. guilliermondii.
¾ O primer (GACA)4 revela diferenças intraespecíficas entre isolados orais e esofágicos
de C. albicans e C. glabrata.
¾ Espécies de Candida que colonizam a mucosa oral não causam esofagite, sendo
geneticamente distintas.
¾ Isolados de Candida resistentes a fluconazol são sensíveis à ação fungicida do extrato
de própolis vermelha.
¾ Tratamentos de candidíase esofágica experimental por administração oral com doses
simples e combinadas de extrato de própolis vermelha são estatisticamente
significantes quanto à ação terapêutica quando comparados ao grupo controle e ao
grupo tratado exclusivamente com fluconazol.
¾ Não há diferença estatística entre os animais com candidíase esofágica tratados com
fluconazol e o diluente (PBS+Tween+DMSO).
¾ Modelo experimental é indispensável para avaliação da eficácia terapêutica de novos
compostos naturais com ação antifúngica para posterior uso humano.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
99
REFERÊNCIAS BIBLIOGRÁFICAS
Alexander, J.W., Boyce, S.T., Babcock, G.F. 1990. The process of microbial translocation.
Annals of Surgery 212, 496-510.
Almeida, E.C.E., Menezes, H. 2002. Anti-inflammatory activity of propolis extracts: a
review. Journal of Venomous Animals and Toxins 8, 191-212.
Alves, H.S., Oliveira, L.T.O., Santurio, J.M. 2000. A importância de Candida dubliniensis
no diagnóstico laboratorial das micoses oportunistas. Revista Brasileira de Análises
Clínicas 32, 65-68.
Amaral, R.C., Gomes, R.T., Rocha, W.M.S., Abreu, S.L.R., Santos, V.R. 2006.
Periodontitis treatment with Brazilian green propolis gel. Pharmacologyonline 3, 336341.
Andersen, L.I., Frederiksen, H.J., Appleyard, M. 1992. Prevalence of esophageal Candida
colonization in a Danish population: special reference to esophageal symptoms, benign
esophageal disorders, and pulmonary disease. Journal of Infectious Diseases 165, 389392.
Andrén, L., Theander, G. 1956. Roentgenographic appearances of esophageal moniliasis.
Acta Radiologica 46, 571-574.
Antunes, A.G.V., Pasqualotto. A,C, Diaz, M.C., d’Azevedo, P.A., Severo, L.C. 2004.
Candidemia in a Brazilian tertiary care hospital: species distribution and antifungal
susceptibility patterns. Rev Inst Med Trop S Paulo 46, 239-241.
Antunes, R.M.P., Catao, R.M.R., Cevallos, B.S.O. 1996. Antimicrobial activity of
propolis. Revista Brasileira de Farmácia 77, 15-18.
Arendrup, M., Horn, T., Frimodt-Moller, N. 2002. In vivo pathogenicity of eight medically
relevant Candida species in an animal model. Infection 30, 286-291.
Asada, N., Uryu, H., Koseki, M., Takeuchi, M., Komatsu, M., Matsue, K. 2006. Successful
treatment of breakthrough Trichosporon asahii fungemia with voriconazole in a patient
with acute myeloid leukemia. Clin Infect Dis. 43, e39-41.
Aslan, A., Temiz, M., Atik, E., Polat, G., Sahinler, N., Besirov, E., Aban, N., Parsak, C.K.
2007. Effectiveness of mesalamine and propolis in experimental colitis. Advances in
Therapy 24, 1085-1097.
Attwood, S.E.A., Lamb, C.A. 2008. Eosinophilic oesophagitis and other non-reflux
inflammatory conditions of the oesophagus: diagnostic imaging and management. Best
Practice & Research Clinical Gastroenterology 22, 639-660.
Awale, S., Shrestha, S.P., Tezuka, Y., Ueda, J.Y., Matsushige, K., Kadota, S. 2005.
Neoflavonoids and related constituents from nepalese propolis and their nitric oxide
production inhibitory activity. Journal of Natural Products 68, 858-864.
Badarinarayanan, G., Gowrisankar, R., Muthulakshmi, K. 2000. Esophageal candidiasis in
non-imune suppressed patients in a semi-urban town, southern India. Mycopathologia
149, 1-4.
Baddley, J.W., Patel, M., Bhavnani, S.M., Moser, S.A., Andes, D.R. 2008. Association of
fluconazole pharmacodynamics with mortality in patients with candidemia.
Antimicrobial Agents and Chemotherapy 52, 3022-3028.
Baehr, P.H., Mcdonald, G.B. 1994. Esophageal infections: risk factors, presentation,
diagnosis, and treatment. Gastroenterology 106, 509-532.
Baehr, P.H., Mcdonald, G.B. 1998. Esophageal disorders caused by infection, systemic
illness, medications, radiation, and trauma. In: Feldman M, Scharschmidt B F,
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
100
Sleisenger M H, eds. Sleisenger and Fordtran’s Gastrointestinal and Liver Disease:
Pathophysiology/Diagnosis/Management, v. 1, 6ª ed., W.B. Saunders Company,
Philadelphia, pp. 519-522.
Bailey, M., Chapin, W., Licht, H., Reynolds, J.C. 1998. The effects of vasculitis on the
gastrointestinal tract and liver. Gastroenterology clinics of North America 27, 747-782.
Bankova, V. 2005. Chemical diversity of propolis and the problem of standardization.
Journal of Ethnopharmacology 100, 114-117.a
Bankova, V. 2005. Recent trends and important developments in propolis research.
Evidence-Based Complementary and Alternative Medicine 2, 29-32.b
Bankova, V., Christov, R., Kujumgiev, A., Marcucci, M.C., Popov, S. 1995. Chemical
composition and antibacterial activity of Brazilian propolis. Zeitschrift für
Naturforschung 50, 167-172.
Bankova, V., Christov, R., Popov, S., Pureb, O., Bocari, G. 1994. Volatile constituents of
propolis. Zeitschrift für Naturforschung 49, 6-10.
Bankova, V.S., Castro, S.L., Marcuci, M.C. 2000. Propolis: recent advances in chemistry
and plant origin. Apidologie 31, 3-15.
Banskota, A.H., Ezuka, T.Y., Idorikawa, M.K., Matsushige, K., Kadota, S. 2000. Two
novel cytotoxic benzofuran derivatives from Brazilian propolis. Journal of Natural
Products 63, 1277-1279.
Barbaro, G., Barbarini, G., Calderon, W., Grisorio, B., Alcini, P., Di Lorenzo, G. 1996.
Fluconazole versus itraconazole for Candida esophagitis in acquired immunodeficiency
syndrome. Gastroenterology 111, 1169-1177.
Barchiesi, F., Caggiano, G., Maracci, M., Arzeni, D., Scalise, G., Montagna M.T. 2003.
Antifungal susceptibility patterns of yeast isolates causing bloodstream infections.
Journal of Antimicrobial Chemotherapy 51, 431-433.
Barnett, J.A., Paine, R.W., Yarrow, D. 2000. Yeasts: Characteristics and Identification.
3rd ed., Cambridge, Cambridge University Press, 1139p.
Barros Lopes, M., Soden, A., Henschke, P.A., Langridge, P. 1996. PCR differentiation of
commercial yeast strains using intron splice primers. Applied and Environmental
Microbiology 62, 4514-4520.
Barros, M.P., Sousa, J.P.B., Bastos, J.K., Andrade, S.F. 2007. Effect of Brazilian green
propolis on experimental gastric ulcers in rats. Journal of Ethnopharmacology 110,
567-571.
Bartie, K.L., Williams, D.W., Wilson, M.J., Potts, A.J., Lewis, M.A. 2004. Differential
invasion of Candida albicans isolates in an in vitro model of oral candidosis. Oral
microbiology and immunology 19, 293-296.
Basnet, P., Matsuno, T., Neidlein, R.Z. 1997. Potent free radical scavenging activity of
Propol isolated from Brazilian propolis. Z Naturforsch 52, 828-833.
Bayramoglu, G., Sonmez, M., Tosun, I., Aydin, K., Aydin, F. 2008. Breakthrough
Trichosporon asahii fungemia in neutropenic patient with acute leukemia while
receiving caspofungin. Infection 36, 68-70.
Becerra, V., Paredes, M. 2000. Uso de marcadores bioquímicos y moleculares en estudios
de diversidad genética. Agricultura Técnica 60, 270-281.
Beecher, G.R. 2003. Overview of dietary flavonoids: nomenclature, occurrence and intake.
Journal of Nutrition 133, 3248-3254.
Bendazzoli, W. S. 2000. Fitomedicamentos: perspectivas de resgate de uma terapia
histórica. O Mundo da saúde 24, 123-126.
Beyer, G., Melzig, M.F. 2005. Effects of propolis on hypoxanthine-xanthine
oxidaseinduced toxicity in cultivated human cells and on neutrophil elastase activity.
Biological & pharmaceutical bulletin 28, 1183-1186.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
101
Boerlin, P., Boerlin-Petzold, F., Goudet, J., Durussel. C., Pagani, J., Chave, J., Bille, J.
1996. Typing Candida albicans oral isolates from human immunodeficiency virusinfected patients by multilocus enzyme electrophoresis and DNA fingerprinting.
Journal of Clinical Microbiology 35, 1235-1248.
Böhme, A., Ruhnke, M., Buchheidt, D., Karthaus, M., Einsele, H., Guth, S., Heussel, G.,
Heussel, C.P., Junghanss, C., Kern, W.K., Kubin, T., Maschemeyer, G., Sezer, O.,
Silling, G., Südhoff, T., Szelényi Dagger H., Ullmann A.J. 2003. Treatment of fungal
infections in hematology and oncology-guidelines of the infectious disease working
party (AGIOF) of the German Society of Hematology and Oncology (DGOH). Annals
of hematology 82, 133-140.
Boktour, M.R., Kontoyiannis, D.P., Hanna, H.A., Hachem, R.Y., Girgawy, E., Bodey,
G.P., Raad, I.I. 2004. Multiple-species candidemia in patients with cancer. Cancer 101,
1860-1865.
Bonavina, L., Incarbone, R., Reitano, M., Tortorano, A., Viviani, M., Peracchia, A. 2003.
Candida colonization in patients with esophageal disease: a prospective clinical study.
Diseases of the Esophagus 16, 70-72.
Bossche, H.V. 1997. Mechanisms of antifungal resistance. Revista Iberoamericana de
Micologia 14, 44-49.
Boyanova, L., Gergova, G., Nikolov, R., Derejian, S., Lazarova, E., Katsarov , N., Mitov,
I., Krastev, Z. 2005. Activity of Bulgarian propolis against 94 Helicobacter pylori
strains in vitro by agar-well diffusion, agar dilution and disc diffusion methods. Journal
of Medical Microbiology 54, 481-483.
Brion, L.P., Uko, S.E., Goldman, D.L. 2007. Risk of resistance associated with fluconazole
prophylaxis: systematic review. The Journal of Infection 54, 521-529.
Brodey, G.P. 1993. Candidiasis: pathogenesis, diagnosis and treatment. New York, Raven
Press Ltd.
Burdock, G.A. 1998. Review of the biological properties and toxicity of bee propolis
(propolis). Food Chemical Toxicology 36, 347-363.
Calderone, R. 2002. Candida and Candidiasis. Washington D.C: AMS.
Calderone, R.A., Fonzi, W.A. 2001. Virulence factors of Candida albicans. Trends in
Microbiology 9, 327-335.
Carvalho, A.M.R. et al. 2008. Invasive Trichosporon cutaneum infection in an infant with
Wilms’ tumor. Braz J Microbiol 39, 59-60.
Cascio, A., Barone, M., Micali, V., Iaria, C., Delfino, D., David, A., Monaco, M., Monaco,
F. 2010. On a fatal case of Candida krusei pleural empyema in a pregnant woman with
spontaneous esophagus perforation. Mycopathologia 169, 451-455.
Castro, S.L., Higashi, K.O. 1995. Effects of different formulations of propolis on mice
infected with Trypanosoma cruzi. Journal of Ethnopharmacology 46, 55-58.
Chaisson, R.E., Gallant, J.E., Keruly, J.C., Moore, R.D. 1998. Impact of opportunistic
disease on survival in patients with HIV infection. AIDS 12, 29-33.
Chandler, F.W., Watts, J.C. 1987. Pathologic diagnosis of fungal infections. Chicago,
ASCP Press.
Chaumentin, G., Boibieux, A., Piens, M.A., Douchet, C., Buttard, P., Bertrand, J.L.,
Peyramond, D. 1996. Trichosporon inkin endocarditis: shortterm evolution and clinical
report. Clin Infect Dis 23, 396-397.
Chee, H.Y. 2002. In vitro evaluation of the antifungal activity of propolis extract on
Cryptococcus neoformans and Candida albicans. Mycobiology 30, 93-95.
Chen, L.I., Chang, J., Kuo, M., Hwang S., Chen H. 2007. Combined herpes viral and
candidal esophagitis in a CAPD patient: case report and review of literature. American
Journal of Medical Science 333, 191-193.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
102
Chocarro, M.A., Galindo, T.F., Ruiz-Irastorza, G., González López, A., Navia, A.F.,
Sangrador, C.O., Arribas, M.I.M. 2000. Risk factors for esophageal candidiasis.
European Journal of Clinical Microbiology & Infectious Diseases 19, 96-100.
Chorilli, M., Michelin, D.C., Salgado, H.R.N. 2007. Animais de laboratório: o
camundongo. Revista de Ciências Farmacêuticas Básica e Aplicada 28, 11-23.
Cicala, C., Morelle, S., Iorio, C., Capasso, R., Borelli, C., Mascolo, N. 2003. Vascular
effects of caffeic acid phenethyl ester (CAPE) on isolated rat thoracic aorta. Life Sci 73,
80-84.
Cirasino, L., Pisati, A., Fasani, F. 1987. Contact dermatitis from propolis. Contact
Dermatitis 16, 110-111.
Clancy, C.J., Cheng, S., Nguyen, M.H. 2009. Animal Models of Candidiasis. In: Cihlar,
R.L., Calderone, R.A. Candida albicans: Methods and Protocols, v. 499, Humana
Press.
Clinical and Laboratory Standards Institute (CLSI). 2008. Reference Method for Broth
Dilution Antifungal Susceptibility Testing of Yeasts: Approved standard, 3rd edn M27A3, Wayne, PA, USA.
Clinical and Laboratoty Standards Institute (CLSI). 2005. Reference method for broth
dilution testing of yeasts: Approved standards-second edition M27-A2, CLSI, Wayne,
PA.
Cole, G.T., Halawa, A.A., Anaisse, E.J. 1996. The role of the gastrointestinal tract in
hematogenous candidiasis: from the laboratory to the bedside. Clinical Infectious
Diseases 22, 73-88.
Coleman, D.C., Rinaldi, M.G., Haynes, K.A., Rex, J.H., Summerbell, R.C., Anaissie, E.J.,
Li, A., Sullivan, D.J. 1998. Importance of Candida species other than Candida albicans
as opportunistic pathogens. Medical Mycology 36, 156-165.
Colombo, A.L., Guimarães, T. 2003. Epidemiologia das infecções hematogênicas por
Candida spp. Revista da Sociedade Brasileira de Medicina Tropical 36, 599-607.
Colombo, A.L., Nucci, M., Salomão, R., Branchini, M.L., Richtmann, R., Derossi, A.,
Wey, S.B. 1999. High rate of non-albicans candidemia in Brazilian tertiary care
hospitals. Diagnostic Microbiology and Infectious Disease 34, 281-286.
Cortés, C.M., Oksenberg, D.R., Afani, A.S., Defilippi, C.C., Madrid, A.M.S. 2004.
Candidiasis esofágica en pacientes inmunocompetentes: Estudio clínico e
inmunológico. Revista médica de Chile 132, 1389-1394.
Cowen, L.E., Steinbach, W.J. 2008. Minireviews: stress, drugs, and evolution: the role of
cellular signaling in fungal drug resistance. Eukaryot Cell 7, 747-764.
Crema, E., Madureira, A.B., Lima, V.G.F., Castro, A.M.W., Silva, A.A., Junqueira, I.S.
2002. Microflora in chagasic megaesophagus. Revista da Sociedade Brasileira de
Medicina Tropical 35, 39-42.
Crowe, S.M., Carlin, J.B., Steward, K.I., Lucas, C.R., Hoy, J.F. 1991. Predictive value of
CD4 lymphocyte numbers for the development of opportunistic infections and
malignancies in HIV-infected persons. Journal of Acquired Immune Deficiency
Syndromes 4, 770-776.
Crowther, K.S., Webb, A.T., McWhinney, P.H. 2003. Trichosporon inkin peritonitis in a
patient on continuous ambulatory peritoneal dialysis returning from the Caribbean. Clin
Nephrol 59, 69-70.
Cuesta-Rubio, O., Fontana-Uriba, B.A., Ramirez-Apan, T., Cardenas, J. 2002.
Polyisoprenylated benzophenones in Cuban propolis: biological activity of
nemorosone. Zeitschrift für Naturforschung 57, 372-378.
Cushnie, T.P.T., Lamb, A.J. 2005. Antimicrobial activity of flavonoids. International
Journal of Antimicrobial Agents 26, 343-356.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
103
Dalben-Dota, K.F., Faria, M.G., Bruschi, M.L., Pelloso, S.M., Lopes-Consolaro, M.E.,
Svidzinski, T.I. 2010. Antifungal activity of propolis extract against yeasts isolated
from vaginal exudates. Journal of Alternative and Complementary Medicine 16(3),
285-290.
Dalzoto, P.R., Glienke-Blanco, C., Kava-Cordeiro, V., Araújo, W.L., Azevedo, J.L. 2003.
RAPD analysis of recombination processes in the entomopathogenic fungus Beauveria
bassiana. Mycological Research 1007, 1069-1074.
Darouiche, R.O. 1998. Oropharyngeal and esophageal candidiasis in immunocompromised
patients: treatment issues. Clinical Infectious Diseases 26, 259-274.
Daugsch, A., Moraes, C.S., Fort, P. and Park, Y.K. 2007. Brazilian red propolis – chemical
composition and botanical origin. Evidence-based Complementary and Alternative
Medicine 5, 435-441.
David, C., Martin, D.B., Deng, A., Cooper, J.Z. 2008. Disseminated Trichosporon inkin
and Histoplasma capsulatum in a patient with newly diagnosed AIDS. J Am Acad
Dermatol 59, S13-15.
De Campos, R.O., Paulino, N., Da Silva, C.H., Scremin, A. E Calixto, J.B. 1998. Antihyperalgesic effect of an ethanolic extract of propolis in mice and rats. The Journal of
pharmacy and pharmacology 50, 1187-1193.
De Hoog, G.S., Guarro, J., Gene, J., Figueras, M.J. 2000. Atlas of Clinical Fungi, 2 ed.,
Utrecht/Reus, Centraalbureau voor Schimmelcultures/UniversitatRovira i Virgili.
De Moura, K.C.G., Emery, F.S., Neves-Pinto, C., Pinto, M.C.F.R., Dantas, A.P., Salomão,
K., Castro, S.L., Pinto, A.V. 2001. Trypanocidal activity of naftoquinonas from
Tabebuia and some heterocyclic derivatives: a review from an interdiciplinary study.
Journal of Brazilian Chemistry Society 12, 325-338.
Demuria, D., Forrest, A., Rich, J., Scavone, J.M., Cohen, L.G., Kazanjian, P.H. 1993.
Pharmacokinetics and bioavailability of fluconazole in patients with AIDS.
Antimicrobial agents and chemotherapy 37, 2187-2192.
Dendis, M., Horváth, R., Michálek, J., Ruzicka, F., Grijalva, M., Bartos, M., Benedik, J.
2003. PCR-RFLP detection and species identification of fungal pathogens in patients
with febrile neutropenia. Clinical Microbiology & Infection 9, 1191-1202.
Diaz, M.R., Fell, J.W. 2004. High-throughput detection of pathogenic yeasts of the genus
Trichosporon. J Clin Microbiol 42, 3696-3706.
Dignani, M.C., Solomkin, J.S., Anaissie, E. 2003. Candida. In: Anaissie, E.; Mcginnis,
M.R.; Pfaller, M.A. (eds) Medical Mycology. 1ª ed., Churchill Livingstone, Filadélfia,
pp. 195-239.
Domingues-Ferreira, M., Grumach, A.S., Duart, A.J.S., Moraes-Vasconcelos, D. 2009.
Esophageal cancer associated with chronic mucocutaneous candidiasis. Could chronic
candidiasis lead to esophageal cancer? Med Mycol 47, 201-205.
Donnelly, D.M.X., Keenan, P.J., Prendergast, J.P. 1973. Isoflavonoids of Dalbergia
ecastophyllum. Phytochemistry 12, 1157-1161.
Dorko, E., Baranova, Z., Jenca, A. et al. 2005. Diabetes mellitus and candidiases. Folia
Microbiol (Praha) 50, 255-261.
Dorko, E., Jenca, A., Pilipcinec, E. et al. 2001. Candida-associated denture stomatitis.
Folia Microbiol (Praha) 46, 443-446.
Ebert, E.C. 2006. Esophageal disease in scleroderma. Journal of Clinical Gastroenterology
40, 769-775.
Eras, P., Goldstein, M.J., Sherlock, P. 1972. Candida infection of the gastrointestinal tract.
Medicine 51, 367-379.
Eroschenko, V.P. 2000. Atlas of histology with functional correlations. Di Fiore’s,
Baltimore.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
104
Felk, A., Kretschmar, M., Albrecht, A., Schaller, M., Beinhauer, S., Nichterlein, T.,
Sanglard, D., Korting, H.C., Schafer, W., Hube, B. 2002. Candida albicans hyphal
formation and the expression of the Efg1- regulated proteinases Sap4 to Sap6 are
required for the invasion of parenchymal organs. Infection and Immunity 70, 36893700.
Fernandes, F.F., Dias, A.L.T., Ramos, C.L., Ikegaki, M., Siqueira, A.M., Franco, M.C.
2007. The in vitro antifungal activity evaluation of propolis g12 ethanol extract on
Cryptococcus neoformans. Revista do Instituto de Medicina Tropical de São Paulo 49,
93-95.
Fernández-Torres, B., Carrillo-Muñoz, A., Inza, I., Guarro, J. 2006. Effect of Culture
Medium on the Disk Diffusion Method for Determining Antifungal Susceptibilities of
Dermatophytes. Antimicrobial Agents and Chemotherapy 50, 2222-2224.
Ferreira, M.E., Grattapaglia, D. 1998. Introdução ao uso de marcadores RAPD e RFLP e
análise genética. EMBRAPA/CENARGEN, Brasília, 220 p.
Fidel, P.L.J, Vazquez, J.A., Sobel, J.D. 1999. Candida glabrata: review of epidemiology,
pathogenesis, and clinical disease with comparison to C. albicans. Clin. Microbiol. Rev.
12, 80-96.
Fieser, L.F. 1926. Journal of American Chemistry Society 48, p. 3201.
Filler, S.G., Kullberg, B.J. 2002. Deep-seated Candida infections. In: Candida and
Candidiasis, Calderone RA, ASM Press, Washington, p. 341-348.
Franchi-Junior, G.C., Moraes, C.S., Daugsch, A., Nowill, A.E., Park, Y.K. 2007. Efeitos
comparativos de extratos etanólicos de própolis brasileira em células leucêmicas
humanas por teste de MTT. Revista mensagem doce, nº 105.
Franchimont, D., Galon, J., Gadina, M., Visconti, R., Zhou, Y., Aringer, M., et al. 2000.
Inhibition of Th1 immune response by glucocorticoids: dexamethasone selectively
inhibits IL-12-induced Stat4 phosphorylation in T lymphocytes. J Immunol 164, 17681774.
Franklin, C., Metry, M. 1992. Life-threatening Candida infections in the intensive care
unit. Journal of Intensive Care Medicine 7, 127-137.
Frokjaer, J.B., Andersen, S.D., Ejskjaer, N. et al. 2007. Impaired contractility and
remodeling of the upper gastrointestinal tract in diabetes mellitus type 1. World J
Gastroenterol 13, 4881–4890.
Gacs, M., Huszenicza, G., Keg, T., Vigh, Z., Stollar, Z., Olah, O., Jonsson. J., Oppel, K.
1993. Experiences on the effectiveness of an intramammary infusion without
containing antibiotics. Incidence and clinical-features of mastitis with different
bacteriological backgrounds on 7 largescale dairy farms. Magyar Allatorvosok 48, 473478.
Gaissert, H.A., Breuer, C.K., Weissburg, A., Mermel, L. 1999. Surgical management of
necrotizing Candida esophagitis. Annals of Thoracic Surgery 67, 231-233.
Galvão, J., Abreu, J.A., Cruz, T., Machado, G.A.S., Niraldo, P., Daugsch, A., Moraes,
C.S., Fort, P., Park, Y.K. 2007. Biological therapy using própolis as nutricional
supplement in câncer treatment. International Journal of cancer research 3, 43-53.
García, V.M.N., Gonzalez, A., Fuentes, M., Aviles, M., Rios, M.Y., Zepeda, G., Rojas,
M.G. 2003. Antifungal activities of nine traditional Mexican medicinal plants. Journal
of Ethnopharmacology 87, 85-88.
Gardes, M., Bruns, TD. 1993. ITS primers with enhanced specificity for basidiomycetesapplications to the identification of mycorrhizae and rusts. Journal of Molecular
Evolution 2, 113-118.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
105
Giordani, R., Trebaux, J., Masi, M., Regli, P. 2001. Enhanced antifungal activity of
ketoconazole by Euphorbia characias latex against Candida albicans. Journal of
Ethnopharmacology 78, 1-5.
Girmenia, C., Pagano, L., Martino, B., D’Antonio, D., Fanci, R., Specchia, G., Melillo, L.,
Buelli, M., Pizzarelli, G., Venditti, M., Martino, P. 2005. Invasive infections caused by
Trichosporon species and Geotrichum capitatum in patients with hematological
malignancies: a retrospective multicenter study from Italy and review of the literature.
Journal of Clinical Microbiology 43, 1818-1828.
Gogtay, N.J., Kulkarni, U.P., Panchabhai, T.S. 2008. Adverse reactions to antifungal
agents. Adverse Drug Reaction Bulletin 251, 963-966.
Goldman, M., Cloud, G.A., Wade, K.D., Reboli, A.C., Fichtembaum, C.J., Hafner, R.,
Sobel, J.D., Powderly, W.G., Patterson, T.F., Wheat, L.J., Stein, D.K., Dismukes, W.E.,
Filler, S.G. 2005. A randomized study of the use of fluconazol in contiuous versus
episodic therapy in patients with advanced HIV infection and a history of
oropharyngeal candidiasis: AIDS Clinical Trials Group Study 323/Mycoses Study
Group Study 40. Clinical Infectious Diseases 41, 1473-1480.
Gornig, M., Emmert-Buck, M., Walsh, T.J. 1997. Patterns of Candida esophagitis in
cancer and AIDS patients: histopathological study of 23 patients. Mycoses 40, 81-85.
Gorschlüter, M., Schmitz, V., Mey, U., Hahn-Ast, C., Schmidt-Wolf, I.G.H., Sauerbruch
T. 2008. Endoscopy in patients with acute leukaemia after intensive chemotherapy.
Leukemia Research 32, 1510-1517.
Goto, A., Kishimoto, M., Takahashi, Y., Kajio, H., Noda, M. 2007. Possible aggravation
and recovery of slowly progressive type 1 diabetes by onset and resolution of oral and
esophageal candidiasis. Intern Med 46, 1629.
Gow, N.A. 2002. Candida albicans switches mates. Molecular cell 10, 217-218.
Grauhan, O., Lohmann, R., Lemmens, P., Schattenfroh, N., Keck, H., Klein, E., Raakow,
R., Jonas, S., Langrehr, J.M., Bechstein, W., Blumhardt, G., Neubaus, P. 1994. Fungal
infections in liver transplant recipients. Langenbecks Archiv für Chirurgie 379, 372375.
Graybill, J.R. 1992. Future directions of antifungal chemotherapy. Clinical Infectious
Disease 14, 170-181.
Gueho, E., Improvisi, L., De Hoog, G.S., Dupont, B. 1994. Trichosporon on humans: a
practical account. Mycoses 37, 3-10.
Gupta, K.L., Ghosh, A.K., Kochhar, R., Jha, V., Chakrabarti, A., Sakhuja, V. 1994.
Esophageal candidiasis after renal transplantation: comparative study in patients on
different immunosuppressive protocols. American Journal of Gastroenterology 89,
1062-1065.
Gurgel, L.A., Sidrim, J.J.C., Martins, D.T., Cechinel Filho, V., Rao, V.S. 2005. In vitro
antifungal activity of dragon’s blood from Croton urucurana against dermatophytes.
Journal of Ethnopharmacology 97, 409-412.
Hamza, O.J.M., Matee, M.I.N., Moshi, M.J., Simon, E.N.M., Mugusi, F., Mikx, F.H.M.,
Helderman, W.H.P., Rijs, A.J.M.M., Ven, A.J.A.M., Verweij, P.E. 2008. Species
distribution and in vitro antifungal susceptibility of oral yeast isolates from Tanzanian
HIV-infected patients with primary and recurrent oropharyngeal candidiasis. BioMed
Central Microbiology 8, 135.
Harish, Z., Rubinstein, A., Golodner, M., Elmaliah, M., Mizrachi, Y. 1997. Suppression of
HIV-1 replication by propolis and its immunoregulatory effect. Drugs under
Experimental and Clinical Research 23, 86-89.
Hashimoto, T., Aga, H., Abuchi T.A. 1998. Anti-Helicobacter pylori compounds in
Brazilian propolis. Nature Medicine 52, 518-520.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
106
Hautala, T., Ikaheimo, I., Husu, H., Säily, M., Siitonen, T., Koistinen, P., Vuopio-Varkila,
J., Koskela, M., Kujala, P. 2007. A cluster of Candida krusei infections in a
haematological unit. BioMed Central Infectious Diseases 7, 97.
Havsteen, B.H. 2002. The biochemistry and medical significance of the flavonoids.
Pharmacology and Therapeutics 96, 67-202.
Hegazi, A.G., Abd, E.I., Hady, F.K., Allah, F.A. 2000. Chemical composition and
antimicrobial activity of European propolis. Zeitschrift für Naturforschung 55c, 70-75.
Heinze, W., Holz, J., Nattermann, H., Blankenstein, P. 1998. Effects of ethanol extracts of
propolis against common bacteria, fungi and viruses of veterinary importance.
Tierarztliche Umschau 53, 321-326.
Hitchcock, C.A., Pye, G.W., Troke, P.F., Johnson, E.M., Warnock, D.W. 1993.
Fluconazole resistance in Candida glabrata. Antimicrobial agents and chemotherapy.
37, 1962-1965.
Holt, J.M. 1968. Candida infection of the oesophagus. Gut 9, 227-231.
Hoshika, K., Iida, M., Mine, H. 1996. Esophageal Candida infection and adherence
mechanisms in the nonimmunocompromised rabbit. Journal of Gastroenterology 31,
307-313.
Hu, F., Hepburn, H.R., Li, Y., Chen, M., Radloff, S.E., Daya, S. 2005. Effects of ethanol
and water extracts of propolis (bee glue) on acute inflammatory animal models. Journal
of Ethnopharmacology 100, 276-283.
Hube, B. 2004. From commensal to pathogen: stage- and tissue-specific gene expression of
Candida albicans. Current Opinion in Microbiology 7, 336-341.
Hube, B., Naglik, J. 2001. Candida albicans proteinases: resolving the mystery of a gene
family. Microbiology 147, 1997-2005.
Iglesias, P.P., Gómez, A.I.M. 2006. Disfagia mecánica por candidiasis esofágica.
Semergen 32, 361-364.
Ishibashi, H., Hisajima, T., Hu, W., Yamaguchi, H., Nishiyama, Y., Abe, S. 2007. A
murine model of esophageal candidiasis with local characteristics symptoms.
Microbiology and Immunology 51, 501-506.a
Ishibashi, H., Uchida, K., Nishiyama, Y., Yamaguchi, H., Abe, S. 2007. Oral
administration of itraconazole solution has superior efficacy in experimental oral and
oesophageal candidiasis in mice than its intragastric administration. Journal of
Antimicrobial Chemotherapy 59, 317-320.b
Jaruratanasirikul, S., Kleepkaew, A. 1997. Influence of an acidic beverage (Coca-Cola) on
the absorption of itraconazole. European Journal of Clinical Pharmacology 52, 235237.
Jimenez-Alonso, J., Esteva, D., Vera, C., Sabio, J.M. 2003. Dysphagia in patients with
systemic lupus erythematosus. Lupus 12, 493.
Kanazawa, M., Satomi, Y., Mizutani, Y., Ukimura, O., Kawauchi, A., Sakai, T. et al. 2003.
Isoliquiritigenin inhibits the growth of prostate cancer. European Urology 43, 580-586.
Kanda, N., Yasuba, H., Takahashi, T., Mizuhara, Y., Yamazaki, S., Imada, Y., Izumi, Y.,
Kobayashi,Y., Yamashita, K., Kita, H., Tamada,T., Chiba, T. 2003. Prevalence of
esophageal candidiasis among patients treated with inhaled fluticasone propionate.
American Journal of Gastroenterology 98, 2146-2148.
Kapoor, S. 2009. Diabetes mellitus and its association with esophageal disorders besides
motility dysfunction. J Gastroenterol 44, 236-237.
Karmeli, Y., Stalnikowitz, R., Eliakim, R., Rahav, G. 1995. Conventional dose of
omeprazole alters gastric flora. Digestive Diseases and Sciences 40, 2070-2073.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
107
Kartal, M., Yildiz, S., Kaya, S., Kurucu, S., Topcu, G. 2003. Antimicrobial activity of
propolis samples from two different regions of Anatolia. Journal of
Ethnopharmacology 86, 69-73.
Katiraee, F., Khosravi, A.R., Khalaj, V., Hajiabdolbaghi, M., Khaksar, A., Rasoolinejad,
M., Yekaninejad, M.S. 2010. Oropharyngeal candidiasis and oral yeast colonization in
Iranian Human Immunodeficiency Virus positive patients. Journal de Mycologie
Médicale 20, 8-14.
Kauffman, C.A. 1996. Role of azoles in antifungal therapy. Clinical Infectious Diseases
22, 148-153.
Khalifaa, M., Kaabia, N., Bahri, F., Jazia, E.B., Bouajina, E., Letaief, A.O. 2007. Infection
in systemic lupus erythematosus. Médecine et maladies infectieuses 37, 792-795.
Khosravi, A.R., Yarahmadi, S., Baiat, M., Shokri, H., Pourkabireh, M. 2008. Factors
affecting the prevalence of yeasts in the oral cavity of patients with diabetes mellitus.
Journal de Micologie Médicale 18, 83-88.
Kliemann, D.A., Pasqualotto, A.C., Falavigna, M., Giaretta, T., Severo, L.C. 2008.
Candida esophagitis: species distribution and risk factors for infection. Revista do
Instituto de Medicina Tropical de São Paulo 50, 261-263.
Knoke, M., Schulz, K., Bernhardt, H. 1997. Dynamics of Candida isolations from humans
from 1992-1995 in Greifswald, Germany. Mycoses 40, 105-110.
Koc, A.N., Silici, S., Ayangil, D., Ferahbas, A., Cankaya, S. 2005. Comparison of in vitro
activities of antifungal drugs and ethanolic extract of propolis against Trichophyton
rubrum and T. mentagrophytes by using a microdillution assay. Mycoses 48, 205-210.
Koh, A.Y., Köhler, J.R., Coggshall, K.T., Rooijen, N.V., Pier, G.B. 2008. Mucosal damage
and neutropenia are required for Candida albicans dissemination. PLoS Pathogens 4,
e35.
Koks, C.H., Meenhorst, P.L., Bult, A., Beijnen, J.H. 2002. Itraconazole solution: summary
of pharmacokinetic features and review of activity in the treatment of fluconazoleresistant oral candidosis in HIV-infected persons. Pharmacological research 46, 195200.
Komiyama, E.Y., Ribeiro, P.M., Junqueira, J.C., Koga-Ito, C.Y., Jorge, A.O. 2004.
Prevalence of yeasts in the oral cavity of children treated with inhaled corticosteroids.
Pesq Odont Bras 18, 197-201.
Koyanagi, T., Nishida, N., Osabe, S., Imamura, Y., Yamamoto, S., Shichiji, A., Nakamura,
Y. 2006. Autopsy case of disseminated Trichosporon inkin infection identified with
molecular biological and biochemical methods. Pathol Int 56, 738-743.
Kreger-Van Rij, N.J.W. 1984. The yeasts. A taxonomic study, 3rd ed. Elsevier Science
Publishers, B.V., Amsterdam, The Netherlands.
Krol, W., Scheller, S., Shani, J., Pietsz, G., C Zuba, Z. 1993. Synergistic effect of ethanolic
extract of propolis and antibiotics on the growth of Staphylococcus aureus.
Arzneimittelforschung 43, 607-609.
Kujumgiev, A., Tsvetkova, I., Serkedjieva, Y., Bankova, V., Christov, R., Popov, S. 1999.
Antibacterial, antifungal and antiviral activity of propolis of different geographic
origin. Journal of Ethnopharmacology 64, 235-240.
Kumazawa, S., Hamasaka, T., Nakayama, T. 2004. Antioxidant activity of propolis of
various geographic origins. Food Chemistry 84, 329-339.
Kusne, S., Tobin, D., Pasculle, A.W., Van Thiel, D.H., Ho, M., Starzl, T.E. 1994. Candida
carriage in the alimentary tract of liver transplantes. Transplantation 57, 398-402.
Lacaz, C.S., Porto, E., Martins, J.E.C., Heins-Vaccari, E.M., Melo, N.T. 2002. Tratado de
Micologia Médica, 9ª ed., São Paulo, Sarvier.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
108
Lacroix, C., Chauvin, M.F. 2005. Trichosporonosis and geotrichosis. EMC-Maladies
Infectieuses 2, 97-104.
Laine, L., Boncini, M. 1994. Esophageal disease in Human Immunodeficiency Virus
infection. Arch. Intern. Med. 154, 1577-1582.
Lamps, L.W. 2008. Infectious disorders of the upper gastrointestinal tract (excluding
Helicobacter pylori ). Diagnostic Histopathology 14, 427-435.
Lamps, L.W., Molina, C.P., West, A.B., Haggitt, R.C., Scott, M.A. 2000. The pathologic
spectrum of gastrointestinal and hepatic histoplasmosis. American journal of clinical
pathology 113, 64-72.
Lange, D., Pavao, J.H., Wu, J., Klausner, M. 1997. Effect of a cola beverage on the
bioavailability of itraconazole in the presence of H2 blockers. Journal of clinical
pharmacology 37, 535-540.
Larner, A.J., Lendrum, R. 1992. Oesophageal candidiasis after omeprazole therapy. Gut
33, 860-861.
Laufer, I. 1982. Radiology of esophagitis. Radiologic Clinics of North America 20, 687699.
Ledón, N., Casacó, A., Gonzales, A., Bracho, J., Rosado, A. 2002. Assessment of potential
dermal and ocular toxicity and allergic properties of an extract of red propolis. Archives
of Dermatological Research 293, 594-596.
Lo Passo, C., Pernice, I., Celeste, A., Perdichizzi, G., Todaro-Luck, F. 2001. Transmission
of Trichosporon asahii esophagitis by a contaminated endoscope. Mycoses 44, 13-21.
Lopes, J.O., Alves, S.H., Klock, C., Oliveira, L.T., Dal Forno, N.R. 1997. Trichosporon
inkin peritonitis during continuous ambulatory peritoneal dialysis with bibliography
review. Mycopathologia 139, 15-18.
López-Dupla, M., Mora, P., Pintado, V., Valencia, E., Lavilla, P., Khamashta, M.A., Gil,
A. 1992. Clinical, endoscopic, immunologic, and therapeutic aspects of oropharyngeal
and esophageal candidiasis in HIV-infected patients: a survey of 114 cases. American
Journal of Gastroenterology 87, 1771-1776.
Lott, T.J., Fundyga, R.E., Randall, J., Kuykendall, J.A. 2005. The human commensal yeast,
Candida albicans, has an ancient origin. Fungal Genetics and Biology 42, 444-451.
Lu, Y., Wu, C., Yuan, Z. 2004. Determination of hesperetin, cinnamic acid and nicotinic
acid in propolis with micellar electrokinetic capillary chromatography. Fitoterapia 75,
267-276.
Luo, K., Law, M., Kaldor, J.M., Mcdonald, A.M., Cooper, D.A. 1995. The role of initial
AIDS-defining illness in survival following AIDS. AIDS 9, 57-63.
Lustosa, S.R., Galindo, A. B., Nunes, L.C. C., Randau, K.P., Pedro, J. R.N. 2008. Própolis:
atualizações sobre a química e a farmacologia. Revista Brasileira de Farmacognosia
18, 447-454.
Macêdo, D.P., Oliveira, N.T., Farias, A.M., Silva, V.K., Wilheim, A.B., Couto, F.M.,
Neves, R.P. 2010. Esophagitis caused by Candida guilliermondii in diabetes mellitus:
first reported case. Medical Mycology 48, 862-865.
Macêdo, D.P.C, Silva, V.K.A., Farias, A.M.A., Melo, L.R.B., Wilheim, A.B., Neves, R.P.
2008. Candida glabrata esophagitis: new case reports and management. Brazilian
Journal of Microbiology 39, 279-281.
Madariaga, M.G., Tenorio, A., Proia, L. 2003. Trichosporon inkin peritonitis treated with
caspofungin. J Clin Microbiol 41, 5827-5829.
Manach, C., Scalbert, A., Orand, C., Remesy, C., Jimenez, L. 2004. Polyphenols: food
sources and bioavailability. American Journal of Clinical Nutrition 79, 727- 747.
Manfredi, R., Calza, L., Chiodo, F. 2001. Lack of change in the distribution of AIDSdefining opportunistic diseases and the related degree of immunodeficiency during the
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
109
periods before and after the introduction of highly active antiretroviral therapy.
European Journal of Clinical Microbiology & Infectious Diseases 20, 410-413.
Manfredi, R., Sabbatani, S., Calza, L. 2007. Recurring Candida albicans esophagitis in a
HIV-infected patient undergoing long-term antiretroviral therapy, and with absentnegligible immunodeficiency. The Brazilian Journal of Infectious Diseases 11, 605609.
Mannarelli, B.M., Kurtzman, C.P. 1998. Rapid identification of Candida albicans and
other human pathogenic yeasts by using short oligonucleotides in a PCR. Journal of
Clinical Microbiology 36, 1634-1641.
Marcucci, M.C. 1995. Propolis: chemical composition, biological properties and
therapeutic activity. Apidologie 26, 83-99.
Marcucci, M.C., Custódio, A.R., Pereira, R.M.S. 2007. Própolis tipificada: um novo
caminho para a elaboração de medicamentos de origem natural, contendo este produto
apícola. Mensagem Doce, nº 90.
Marcucci, M.C., Ferreres, F., Garcia-Viguera, C. 2001. Phenolic compounds from
Brazilian propolis with pharmacological activities. Journal of Ethnopharmacology 74,
105-112.
Marr, A.K., Seidel, K., White, T., Bowden, R. 2000. Candidemia in allogeneic blood and
marrow transplant recipients: evolution of risk factors after the adoption of prophylactic
fluconazole. Journal of Infectious Diseases 181, 309-316.
Martínez, A.C., Tobal, F.G., Ruiz-Irastorza, G., López, A.G., Navia, F.A.; Sangrador,
C.O., Arribas, M. 2000. Risk factors for esophageal candidiasis. European Journal of
Clinical Microbiology & Infectious Diseases 19, 96-100.
Martinez, M., López-Ribot, J.L., Kirkpatrick, W.R., Coco, B.J., Bachmann, S.P., Patterson,
T.F. 2002. Replacement of Candida albicans with C. dubliniensis in Human
Immunodeficiency Virus infected patients with oropharyngeal candidiasis treated with
fluconazole. J. Clin. Microbiol. 40, 3135-3139.
Martins, R.S., Péreira, E.S., Lima, S.M., Senna, M.I., Mesquita, R.A., Santos, V.R. 2002.
Effect of commercial ethanol propolis extract on the in vitro growth of Candida
albicans collected from HIV-seropositive and HIV-seronegative Brazilian patients with
oral candidiasis. Journal of Oral Science 44, 41-48.
Mastroianni, A., Cancellieri, C., Coronado, O., Jones, L. 1999. Bacterial esophagitis in
patients with HIV disease. Le infezioni in medicina 7, 192-194.
Matsue, K., Uryu, H., Koseki, M., Asada, N., Takeuchi, M. 2006. Breakthrough
trichosporonosis in patients with hematologic malignancies receiving micafungin.
Clinical and Infectious Diseases 42, 753-757.
Mazzuco, H., De Me Silva, R.D., Berchieri, A., Dematsushige, K., Kusumoto, I.T.,
Yamamoto, Y., Kadota, S., Namba, T. 1996. Quality evaluation of propolis:
comparative study on radical scavenging effects of propolis and vespae nidus. Journal
of Traditional Medicines, v.12, p.0liveira, E. Use of propolis and ethyl alcohol in the
control of Salmonella in poultry rations. Scientia Agricola 53, 1-5.
McClelland, M., Petersen, C., Welsh, J. 1992. Length polymorphisms in tRNA intergenic
spacer detected by using the polymerase chain reaction can distinguish streptococcal
strains and species. Journal of Clinical Microbiology 30, 1499-1504.
McManners, J., Samaranayake, L.P. 1990. Suppurative oral candidosis. Review of the
literature and report of a case. Int J Oral Maxillofac Surg 19, 257-259.
Medeiros, C.S., Pontes-Filho, N.T., Camara, C.A., Lima-Filho, J.V., Oliveira, P.C., Lemos,
S.A., Leal, A.F.G., Brandão, J.O.C., Neves, R.P. 2010. Antifungal activity of the
naphthoquinone beta-lapachone against disseminated infection with Cryptococcus
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
110
neoformans var. neoformans in dexamethasone-immunosuppressed Swiss mice. Braz J
Med Biol Res 43, 345-349.
Melo, N.R., Taguchi, H., Jorge, J. et al. 2004. Oral Candida flora from Brazilian human
immunodeficiency virus-infected patients in the highly active antiretroviral therapy era.
Mem Inst Oswaldo Cruz 99, 425-431.
Mocroft, A., Oancea, C., Lunzen, J., Vanhems, P., Banhegyi, D., Chiesi, A., Vinogradova,
E., Maayan, S., Phillips, A.N., Lundgren, J. 2005. Decline in esophageal candidiasis
and use of antimycotics in european patients with HIV. American Journal of
Gastroenterology 100, 1446-1454.
Mocroft, A., Youle, M., Morcinek, J. et al. 1997. Survival after diagnosis of AIDS: A
propspective observational study of 2625 patients. BMJ 314, 409-413.
Mocroft, A.J., Lundgren, J.D., Monforte, A.A., Ledergerber, B., Barton, S.E., Vella, S.,
Katlama, C., Gerstoft, J., Pedersen, C., Phillips, A.N. 1997. Survival of AIDS patients
according to type of AIDS-defining event. International Journal of Epidemiology 26,
400-407.
Monti, M., Berti, E., C Arminati, G., Cusini, M. 1983. Occupational and cosmetic
dermatitis from propolis. Contact Dermatitis 9, 163p.
Moretti-Branchini, M.L., Fukushima, K., Schreiber, A.Z., Nishimura, K., Papaiordanou,
P.M., Trabasso, P., Tanaka, R., Miyaji, M. 2001. Trichosporon species infection in
bone marrow transplanted patients. Diagn Microbiol Infect Dis 39, 161-164.
Morschhäuser, J. 2002. The genetic basis of fluconazole resistance developement in
Candida albicans. Biochimica et Biophysica Acta 1587, 240-248.
Mosimann, F. 1993. Esophageal candidiasis, omeprazole therapy, and organ
transplantation – a word of caution. Transplantation 56, 492-493.
Murad, M., Calvi, S.A., Soares, A.M.V.C., Bankova, V., Sforcin, J.M. 2002. Effects of
propolis from Brazil and Bulgaria on fungicidal activity of macrophages against
Paracoccidioides brasiliensis. Journal of Ethnopharmacology 79, 331-334.
Naito, Y., Yoshikawa, T., Oyamada, H., Tainaka, K., Morita, Y., Kogawa, T., Sugino, S.,
Kondo, M. 1988. Esophageal candidiasis. Gastroenterologia Japonica 23, 363-370.
Neves, R.P., Cavalcanti, M.A.Q., Chaves, G.M., Magalhães, O.M.C. 2002. Yeasts isolated
from clinical samples of AIDS patients. Braz. J. Microbiol. 33, 363-364.
Nucci, M., Anaisse, E. 2001. Revisiting the source of candidemia: skin or gut? Clinical
Infectious Diseases 33, 1959-1967.
Nucci, M., Colombo, A.L. 2002. Emergence of resistant Candida in neutropenic patients.
Brazilian Journal of Infectious Diseases 6, 124-128.
Nunes, L.C.C., Galindo, A.B., Deus, A.S.O., Rufino, D.A., Randau, K.P., Xavier, H.S.,
Citó, A.M.G.L., Neto, P.J.R. 2009. Variabilidade sazonal dos constituintes da própolis
vermelha e bioatividade em Artermia salina. Brazilian Journal of Pharmacognosie
19(2B), 524-529.
Odds, F.C., Davidson, A.D., Jacobsen, M.D., Tavanti, A., Whyte, J.A., Kibbler, C.C., Ellis,
D.H., Maiden, M.C., Shaw, D.J., Gow, N.A. 2006. Candida albicans strain
maintenance, replacement, and microvariation demonstrated by multilocus sequence
typing. Journal of Clinical Microbiology 44, 3647-3658.
Ohsugi, M., Basnet, P., Kadota, S. 1997. Antibacterial activity of traditional medicines and
an active constituent lupulone from Humulus lupulus against Helicobacter pylori.
Journal of Traditional Medicines 14, 186-191.
Oliveira, A.C.P., Shinobu, C.S., Onghini, R.L., Franco, S.L., Svidzinski, T.I.E. 2006.
Antifungal activity of propolis extract against yeasts isolated from onychomycosis
lesions. Memórias do Instituto Oswaldo Cruz 101, 493-497.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
111
Olmos, M.A., Araya, V., Concetti, H., Ramallo, J., Piskorz, E., Perez, H., Cahn, P.,
Kaufman, S., Guelfand, L. 2005. Oesophageal candidiasis: clinical and mycological
analysis. Acta Gastroenterol Latinoam 35, 211-218.
Ortuño, J.A., Tovar, A., Ruiz, J., Garcia, A. 1997. Candidiasis esofágica en pacientes HIV
negativos. Revista Española de Enfermedades Digestivas 89, 503-510.
Ota, C., Unterkircher, C., Fantinato, V., Shimizu, M.T. 2001. Antifungal activity of
propolis on different species of Candida. Mycoses 44, 375-378.
Paillaud, E., Merlier, I., Dupeyron, C., Scherman, E., Poupon, J., Bories, P.N. 2004. Oral
candidiasis and nutritional deficiencies in elderly hospitalized patients. The British
journal of nutrition 92, 861–867.
Pappas, P.G., Rex, J.H., Sobel, J.D., Filler, S.G., Dismukes, W.E., Walsh, T.J., Edwards,
J.E. 2004. Guidelines for treatment of candidiasis. Clinical Infectious Diseases 38, 161189.
Park, E.H., Kim, S.H., Park, S.S. 1996. Anti-inflammatory activity of propolis. Archives of
pharmacal research 19, 337-341.
Park, Y.K., Alencar, S.M., Aguiar, C.L. 2002. Botanical origin and chemical composition
of Brazilian propolis. Journal of agricultural and food chemistry 50, 2502-2506.
Park, Y.K., Alencar, S.M., Scamparini, A.R.P., Aguiar, C.L. 2002. Própolis produzida no
sul do Brasil, Argentina e Uruguai: Evidências fitoquímicas de sua origem vegetal.
Ciência Rural 32, 997-1003.
Park, Y.K., Ikegaki, M., Alencar, S.M. 2000. Classificação das própolis brasileiras a partir
de suas características físico-químicas e propriedades biológicas. Mensagem Doce, n.
58, 2-7.
Park, Y.K., Koo, M.H., Abreu, J.A.S., Ikegaki, M.,Cury, J.A., Rosalen, P.L. 1998.
Antimicrobial activity of propolis on oral microorganisms. Current Microbiology 36,
24-28.
Pasqualotto, A.C., Antunes, A.G.V., Severo, L.C. 2006. Candida guilliermondii as the
aetiology of candidosis. Revista do Instituto de Medicina Tropical de São Paulo
48,123-127.
Pasqualotto, A.C., Nedel, W.L., Machado, T.S., Severo, L.C. 2005. A comparative study of
risk factors and outcome among outpatient-acquired and nosocomial candidaemia. The
Journal of hospital infection 60, 129-134.
Pasqualotto, A.C., Nedel, W.L., Machado, T.S., Severo, L.C. 2006. Risk factors and
outcome for nosocomial breakthrough candidaemia. Journal of Infection 52, 216-222.
Pereira, A.S., Seixas, F.R.M.S., Neto, F.R.A. 2002. Propolis: 100 anos de pesquisa e suas
perspectivas futuras. Quim Nova 25, 321-326.
Péter, Z., Zala, J., Szabó, O., Telegdy, L., Horváth, Z., Makara, M., Schuller, J. 2000.
Fungal colonization of the esophagus in alcoholic liver disease. Zeitschrift für
Gastroenterologie 38, 821-825.
Phaosawasdi, K., Rice, P., Lee, B. 1986. Primary and secondary Candida esophagitis. IMJ
Illinois medical journal 169, 361-365.
Piccinelli, A.L., Fernandes, M.C., Cuesto-Rubio, O., Hernandez, I.M., De Simone, F.,
Rastrelli, L. 2005. Isoflavonoids Isolated from Cuban Propolis. J Agric Food Chem 53,
9010-9016.
Pietta PG, Gardana C, Pietta AM. 2002. Analytical methods for quality control of propolis.
Fitoterapia 73 (Suppl. 1): S7-20.
Piwoz, J.A., Stadtmauer, G.J., Bottone, E.J., Weitzman, I., Shlasko, E., CumminghamRundles, C. 2000. Trichosporon inkin lung abscesses presenting as a penetrating chest
wall mass. Pediatr Infect Dis J 19, 1025-1027.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
112
Popova, M., Bankova, V., Naydensky, CH., Tsvetkova, I., Kujumgiev, A. 2004.
Comparative study of the biological activity of propolis from different geographic
origem: a statistical approach. Macedonian Pharmaceutical Bulletin 50, 9-14.
Praveen, K., Suyash, M., Ashish, V., Sanjay, B.S. 2007. Candida esophagitis in achalasia
cardia: Case report and review of literature. Saudi J. Gastroenterol. 13, 88-90.
Prescott, R.J., Harris, M., Banerjee, S.S. 1992. Fungal infections of the small and large
intestine. Journal of Clinical Pathology 45, 806-811.
Queiroz, J.P.A.F., Sousa, F.D.N., Lage, R.A., Izael, M.A., Santos, A.G. 2008.
Criptococose - uma revisão bibliográfica. Acta Veterinária Brasileira 2, 32-38.
Ramos, J.M., Cuenca-Estrella, M., Gutierrez, F., Elia, M., Rodriguez-Tudela, J.L. 2004.
Clinical case of endocarditis due to Trichosporon inkin and antifungal susceptibility
profile of the organism. Journal of Clinical Microbiology 42, 2341-2344.
Rasool, S., Siar, C.H., Ng, K.P. 2005. Oral candidal species among smokers and
nonsmokers. J Coll Phycns Surg Pak 15, 679-682.
Raufman, J.P. 2005. Declining gastrointestinal opportunistic infections in HIV-infected
persons: a triumph of science and a challenge for our HAARTs and minds. American
Journal of Gastroenterology 100, 1455-1458.
Reagan, D.R., Pfaller, M.A., Hollis, R.J., Wenzel, R.P. 1990. Characterization of the
sequence of colonization and nosocomial candidemia using DNA fingerprinting and a
DNA probe. Journal of Clinical Microbiology 28, 2733-2738.
Redding, S., Smith, J., Farinacci, G., Rinaldi, M., Fothergill, A., Rhine-Chalberg, J., Pfaller
M. 1994. Resistance of Candida albicans to fluconazole during treatment of
oropharyngeal candidiasis in a patient with AIDS: documentation by in vitro
susceptibility testing and DNA subtype analysis. Clinical Infectious Diseases 18, 240242.
Reis, E. 1998. Molecular diagnosis and epidemiology of fungal infections. Medical
Mycology 36, 249-257.
Repentigny, L., Lewandowski, D., Jolicoeur, P. 2004. Immunopathogenesis of
oropharyngeal candidiasis in human immunodeficiency virus infection. Clinical
Microbiology Reviews 17, 729-759.
Resende, J.C.P., Franco, G.R., Rosa, C.A., Hahn, R.C., Hamdan, J.S. 2004. Phenotypic and
genotypic identification of Candida spp. isolated from hospitalized patients. Revista
Iberoamericana de Micologia 21, 24-28.
Rex, J.H., Walsh, T.J., Sobel, J.D., Filler, S.G., Pappas, P.G., Dismuskes, W.E., Edwards,
J.E. 2000. Practice guidelines for the treatment of candidiasis. Clinical Infectious
Diseases 30, 662-678.
Reynaud, J., Guilet, D., Terreux, R., Lussignol, M., Walchshofer, N. 2005. Isoflavonoids
in non-leguminous families: an update. Natural Product Reports 22, 504-515.
Richardson, M., Flörl, C.L. 2008. Changing epidemiology of systemic fungal infections.
Clinical Microbiology and Infection 14, 5-24.
Rocha, B.A., Del Negro, G.M.B., Yamamoto, L. et al. 2008. Identification and
differentiation of Candida species from pediatric patients by random amplified
polymorphic DNA. Rev Soc Bras Med Trop 41, 1-5.
Ross, H., Romrell, L.J., Kaye, G.I. 1995. Histology: a text and atlas. The Williams &
Wilkins Co., Baltimore.
Sahinler, N., Kaftanoglu, O. 2005. Natural product propolis: chemical composition.
Natural Product Research 19, 183-188.
Salatino, A., Teixeira, E.W., Negri, G., Message, D. 2005. Origin and chemical variation
of brazilian propolis. Evidence-Based Complementary and Alternative Medicine 2, 3338.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
113
Samaranayake, L.P. 1997. Candida krusei infections and fluconazole therapy. Hong Kong
Medical Journal 3, 312-314.
Samaranayake, Y.H., Samaranayake, L.P. 2001. Experimental oral candidiasis in animal
models. Clinical Microbiology Review 14, 398-429.
Sanglard, D., Hube, B., Monod, M., Odds, F.C., Gow, N.A. 1997. A triple deletion of the
secreted aspartyl proteinase genes SAP4, SAP5, and SAP6 of Candida albicans causes
attenuated virulence. Infection and Immunity 65, 3539-3546.
Sant’ana, P.L., Milan, E.P., Martinez, R. et al. 2002. Multicenter Brazilian study of oral
Candida species isolated from AIDS patients. Mem Inst Oswaldo Cruz 97, 253-257.
Santos, H.S.D., Cruz, W.M.S. 2001. A terapia nutritional com vitaminas, antioxidantes e o
tratamento quimioterápico e oncológico. Revista Brasileira de Cancerologia 47, 303308.
Santos, V.R., Gomes, R.T., de Mesquita, R.A., de Moura, M.D., França, E.C., de Aguiar,
E.G., Naves, M.D., Abreu, J.A., Abreu, S.R. 2008. Efficacy of Brazilian propolis gel
for the management of denture stomatitis: a pilot study. Phytotherapy Research 22
(11), 1544-1547.
Santos, V.R., Pimenta, F.J., Aguiar, M.C., Do Carmo, M.A., Naves, M.D., Mesquita, R.A.
2005. Oral candidiasis treatment with Brazilian ethanol propolis extract. Phytotherapy
Research 19(7), 652-654.
Sawaya, A.C.H.F., Palma, A.M., Caetano, F.M., Marcucci, M.C., Cunha, I.B.S., Araujo,
C.E.P., Shimizu, M.T. 2002. Comparative study of in vitro methods used to analyse the
activity of propolis extracts with different compositions against species of Candida.
Letters in Applied Microbiology 35, 203-207.
Scaringi, L., Cornacchione, P., Fettucciari, K., Rosati, E., Rossi, R., Marconi, P.,
Capodicasa, E. 1996. Activity inhibition of cytolytic lymphocytes by omeprazole.
Scandinavian Journal of Immunology 44, 204-214.
Schroeder, H.E. 1991. Oral structural biology. Thieme Medical Publishers, New York,
N.Y.
Serra, J., Escola, R. 1995. A study on the bacteriostatic activity of propolis. Deutsche
Lebensmittel-Rundschau 91, 242-246.
Sforcin, J.M., Fernandes Junior, A., Lopes, C.A., Bankova, V., Funari, S.R. 2000. Seasonal
effect on Brazilian propolis antibacterial activity. Journal of Ethnopharmacology 73,
243-249.
Sforcin, J.M., Fernandes, A., Jr., Lopes, C.A.M., Funari, S.R.C., Bankova, V. 2001.
Seasonal effect of Brazilian propolis on Candida albicans and Candida tropicalis.
Journal of Venomous Animals and Toxins 7, 139-144.
Sheehan, N.J. 2008. Dysphagia and other manifestations of oesophageal involvement in
the musculoskeletal diseases. Rheumatology 47, 746-752.
Silici, S., Koç, N.A., Ayangil, D., Çankaya, S. 2005a. Antifungal activities of propolis
collected by different races of honeybees against yeasts isolated from patients with
superficial mycoses. Journal of Pharmacological Sciences 99, 39-44.
Silici, S., Kutluca, S. 2005b. Chemical composition and antibacterial activity of propolis
collected by three different races of honeybees in the same region. Journal of
Ethnopharmacology 99, 69-73.
Silva, B.B., Rosalen, P.L., Cury, J.A., Gaki, M., Souza, V.C., Esteves, A., Alencar, S.M.
2007. Chemical composition and botanical origin of red propolis, a new type of
Brazilian propolis. Evidence-based Complementary and Alternative Medicine 4, 1-4.
Silva, V.V., Díaz, M.C., Febré, N. 2002. Vigilancia de la resistencia de leveduras a
antifúngicos. Revista Chilena de Infectología 19, 56-65.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
114
Simon, M.R., Houser, W.L., Smith, K.A., Long, P.M. 1997. Esophageal candidiasis as a
complication of inhaled corticosteroids. Annals of Allergy, Asthma & Immunology 79,
333-338.
Siqueira A.B.S., Gomes B.S., Cambuim I., Maia R., Abreu S., Souza-Motta C.M., De
Queiroz L.A., A.L.F. Porto. 2009. Trichophyton species susceptibility to green and red
propolis from Brazil. Letters in Applied Microbiology 48, 90-96.
Slatino, A., Weinstein, Teixeira, E., Negri, G., Message, D. 2005. Origin and chemical
variation of Brazilian propolis. Evidence-Based Complementary and Alternative
Medicine 2, 33-38.
Smith, D., Midgley, J., Gazzard, B. 1999. A randomised, double-blind study of
itraconazole versus placebo in the treatment and prevention of oral or oesophageal
candidosis in patients with HIV infection. International Journal of Clinical Practice
53, 349-352.
Song, H.J., Chung, S.L., Lee, K.S. 2007. Trichosporon inkin subcutaneous infection in a
rheumatoid arthritis patient. International Journal of Dermatology 46, 282-283.
Sood, A., Sharma, M., Jain, N.P., Chawla, L.S., Kumar, R. 1995. Esophageal candidiasis
following omeprazole therapy: a report of two cases. Indian Journal of
Gastroenterology 14, 71-72.
Sosa, S., B Aricevic, D., C Inco, M., Padovan, D., Tubaro, A., Della, L.R. 1997.
Preliminary investigation on the anti-inflammatory and anti-microbial activities of
propolis. Pharmaceutical and Pharmacological Letters 7, 168-171.
Squier, C.A., Kremer, M.J. 2001. Biology of oral mucosa and esophagus. Journal of the
National Cancer Institute. 29, 7-15.
Sullivan, D.J., Moran, G., Donelly, S., Gee, S., Pinjon, E., Mccartan, B., Shanley, D.B.,
Coleman, D.C. 1999. Candida dubliniensis: an update. Revista Iberoamericana de
Micologia 16, 72-76.
Sutclife, R., Hughes, S.F., Winslet, M.C. 1999. Fungal ball of the oesophagus. Diseases of
the Esophagus 12, 326-328.
Tacconelli, E., Bertagnolio, S., Posteraro, B. et al. 2002. Azole susceptibility patterns and
genetic relationship among oral Candida strains isolated in the era of highly active
antiretroviral therapy. J Acquir Immunedefic Syndr 31, 38-44.
Takasawa, H., Takahashi, Y., Abe, M. et al. 2007. An elderly case of type 2 diabetes which
developed in association with oral and esophageal candidiasis. Intern Med 46, 387390.
Tavanti, A., Davidson, A.D., Fordyce, M.J., Gow, N.A., Maiden, M.C., Odds, F.C. 2005.
Population structure and properties of Candida albicans, as determined by multilocus
sequence typing. Journal of Clinical Microbiology 43, 5601-5613.
Teare, J.P., Spedding, C., Whitehead, M.W., Greenfield, S.M., Challacombe, S.J.,
Thompson, R.P. 1993. Omeprazole and dry mouth. Scandinavian Journal of
Gastroenterology 30, 216-218.
Teixeira, E.W., Negri, G., Meira, R.M., Message, D., Salatino, A. 2005. Plant origin of
green propolis: bee behavior, plant anatomy and chemistry. Evidence-based
Complementary and Alternative Medicine 2, 85-92.
Tekeli, A., Dolapci, I., Cesur, S., Tekeli, E., Icli, F. 2002. Candida dubliniensis studies and
isolation of Candida types in oropharyngeal specimens from oncologic patients.
Mikrobiyol Bul 36, 57-63.
Thakur, J.K., Arthanari, H., Yang, F., Pan, S.J., Fan, X., Breger, J., Frueh, D.P., Gulshan,
K., Li, D.K., Mylonakis, E., Struhl, K., Moye-Rowley, W.S., Cormack, B.P., Wagner,
G., Näär, A.M. 2008. A nuclear receptor-like pathway regulating multidrug resistance
in fungi. Nature 452, 604-609.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
115
Thanos, M., Schönian, G., Meyer, W., Schweynoch, C., Gräser, Y., Mitchell, T.G.,
Presber, W., Tietz, H.J. 1996. Rapid Identification of Candida Species by DNA
Fingerprinting with PCR. Journal of Clinical Microbiology 34, 615-621.
Thapa, B.R.; Kumar, L. 1989. Candida esophagitis after antibiotic use. The Indian Journal
of Pediatrics 56, 296-299.
Thewes, S., Moran, G.P., Magee, B.B., Schaller, M., Sullivan, D.J., Hube, B. 2008.
Phenotypic screening, transcriptional profiling, and comparative genomic analysis of an
invasive and non- invasive strain of Candida albicans. BMC Microbiology 8, 187p.
Thompson, G.R., Cadena, J, Patterson, T.F. 2009. Overview of antifungal agents. Clinics
in Chest Medicine 30, 203-215.
Tintelnot, K., Haase, G., Seibold, M., et al. 2000. Evaluation of phenotypic markers for
selection and identification of Candida dubliniensis. Journal of Clinical Microbiology
38, 1599-1608.
Traeder, C., Kowoll, S., Arastéh, K. 2008. Candida infection in HIV positive patients
1985-2007. Mycoses 51(2), 58-61.
Tran, H.A.M., Vincent, J.M., Slavin, M.A., Grigg, A. 2003. Esophageal perforation
secondary to angio-invasive Candida glabrata following hemopoietic stem cell
transplantation. Clinical Microbiology and Infection 9, 1215-1218.
Trusheva, B., Popova, M., Bankova, V., Simova, S., Marcucci, M.C., Miorin, P.L., Pasin,
F.R., Tsvetkova, I. 2006. Bioactive constituents of Brazilian red propolis. Advance
Access Publication 3, 249-254.
Trusheva, B., Popova, M., Naydenski, H., Tsvetkova, I., Rodriguez, J.G., Bankova, V.
2004. New polyisoprenylated benzophenones from Venezuelan propolis. Fitoterapia
75, 683-689.
Underwood, J.A., Williams, J.W., Keate, R.F. 2003. Clinical findings and risk factors for
Candida esophagitis in outpatients. Diseases of the Esophagus 16, 66-69.
Uzel, A., Sorkun, K., Öncag, Ö., Cogulu, D., Gencay, Ö. E Salih, B. 2005. Chemical
compositions and antimicrobial activities of four different Anatolian propolis samples.
Microbiological Research 160, 189-195.
Vaughan-Martini, A., Kurtzman, C.P., Meyer, S.A., O’Neill, E.B. 2005. Two new species
in the Pichia guilliermondii clade: Pichia caribbica sp. nov., the ascosporic state of
Candida fermentati, and Candida carpophila comb. nov. FEMS Yeast Res 5, 463-469.
Vazquez, J.A. 2010. Optimal management of oropharyngeal and esophageal candidiasis in
patients living with HIV infection. HIV/AIDS – Research and Palliative Care 2, 89101.
Vazquez, J.A., Sobel, J.D. 2003. Candidiasis. In: Dismukes WE, Pappas PG, Sobel JD,
editors. Clinical Mycology. Oxford: Oxford University Press, 143-187.
Vazquez, JA. 2003. Invasive oesophageal candidiasis: Current and developing treatment
options (Review). Drugs 63, 971-989.
Vermeersch, B., Rysselaere, M., Dekeyser, K., Rasquin, K., De Vos, M., Elewaut, A.,
Barbier, F. 1989. Fungal colonization of esophagus. American Journal of
Gastroenterology 84, 1079-1083.
Vidal, A.P.A., Pannain, V.L.N., Bottino, A.M.C.F. 2007. Esofagites em pacientes com
síndrome de imunodeficiência adquirida. Estudo histológico e imunoistoquímico.
Arquivos de Gastroenterologia 44, 309-314.
Voss, A., Hollis, R.J., Pfaller, M.A., Wenzel, R.P., Doebbeling, B.N. 1994. Investigation
of the sequence of colonization and candidemia in nonneutropenic patients. Journal of
Clinical Microbiology 32, 975-980.
Walsh, T.J., Gonzalez, C.E., Piscitelli, S., Bacher, J.D., Peter J., Torres, R., Shetti, D.,
Katsov, V., Kligys, K., Lyman, C. 2000. Correlation between in vitro and in vivo
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
116
antifungal activities in experimental fluconazole-resistant oropharyngeal and
esophageal candidiasis. Journal of Clinical Microbiology 38, 2369-2373.
Walsh, T.J., Hamilton, S.R., Belitos, N. 1988. Esophageal candidiasis. Managing an
increasingly prevalent infection. Postgraduate medicine 84, 193-196.
Washington, K., Gottfried, M.R., Wilson, M.L. 1991. Gastrointestinal cryptococcosis.
Modern Pathology 4, 707-711.
Weerasuriya, N., Snape, J. 2006. A study of Candida esophagitis in elderly patients
attending a district general hospital in the UK. Diseases of the Esophagus 19, 189-192.
Welsh, J., McClelland, M. 1990. Fingerprinting genomes using PCR with arbitrary
primers. Nucleic Acids Research 18, 7213-7218.
Westwater, C., Schofield, D.A., Nicholas, P.J., Paulling, E., Balish, E. 2007. Candida
glabrata and Candida albicans; dissimilar tissue tropism and infectivity in a
gnotobiotic model of mucosal candidiasis. FEMS Immunol. Med. Microbiol. 51, 134139.
Wey, S.B., Mori, M., Pfaller, M.A., Woolson, R.F., Wenzel, R.P. 1989. Risk factors for
hospital-acquired candidemia. Archives of internal medicine 149, 2349-2353.
Wilcox, C.M., Alexander, L.N., Clark, W.S., Thompson, S.E. 1996. Fluconazole compared
with endoscopy for Human Immunodeficiency Virus - infected patients with
esophageal symptoms. Gastroenterology 110, 1803-1809.
Wilcox, C.M., Karowe, M.W. 1994. Esophageal infections: etiology, diagnosis and
management. Gastroenterologist 2, 188-206.
Wilcox, C.M., Schwartz, D.A. 1996. Endoscopic-pathologic correlates of Candida
esophagitis in Acquired Immunodeficiency Syndrome. Digestive diseases and sciences
41, 1337-1345.
Wilcox, C.M., Straub, R.F., Alexander, L.N., Clark, W.S. 1996. Etiology of esophageal
disease in Human Immunodeficiency Virus infected patients who fail antifungal
therapy. Inc. Am J Med. 101, 599-604.
Wilheim, A.B., Miranda-Filho, D.B., Nogueira, R.A., Rêgo, R.S.M., Lima, K.M., Pereira,
L.M.M.B. 2009. The resistance to fluconazole in patients with esophageal candidiasis.
Arquives of Gastroenterology 46, 32-37.
Williams, R.J., Spencer, J.P., Rice-Evans, C. 2004. Flavonoids: antioxidants or signalling
molecules? Free Radical Biology and Medicine 36, 838-849.
Wingard, J.R. 1995. Importance of Candida species other than C. albicans as pathogens in
oncology patients. Clinical Infectious Diseases 20, 115-125.
Wingard, J.R., Merz, W.G., Rinaldi, M.G, Johnson, T.R, Karp, J.E, Saral, R. 1991.
Increase in Candida krusei infection among patients with bone marrow transplantation
and neutropenia treated prophylactically with fluconazol. The New England Journal of
Medicine 325, 1274-1277.
Wingard, J.R., Merz, W.G., Rinaldi, M.G., Miller, C.B., Karp, J.E., Saral, R. 1993.
Association of Torulopsis glabrata infections with fluconazole prophylaxis in
neutropenic bone marrow transplant patients. Antimicrobial agents and chemotherapy
37, 1847-1849.
Woittiez, K.J, Hove, W.R, Van Der Heyden, J.T.M. 2008. Dysphagia and an oesophageal
stricture; not always cancer. Gut 57, 1032.
Wynne, S., Dwon-Chung, K.J., Shea, Y., Filie, A.C., Varma, A., Lupo, P., et al. 2004.
Invasive infection with Trichosporon inkin in two siblings with chronic granulomatous
disease. Journal of Allergy and Clinical Immunology 114, 1418-1424.
Yakoob, J., Jafri, W., Abid, S., Jafri, N., Islam, M.; Hamid, S.; Shah, H.A.; Hussainy, A.S.
2003. Candida esophagitis: risk factors in non-HIV population in Pakistan. World
Journal of Gastroenterology 9, 2328-2331.
Macêdo, Danielle. Etiologia da candidíase esofágica e avaliação do efeito antifúngico...
117
Yee, J., Wall, S.D. 1994. Infectious esophagitis. Radiologic clinics of North America 32,
1135-1145.
Young, C., Chang, M.H., Chen, J.M. 1993. Fungal esophagitis in children. Acta
Paediatrica Sinica 34, 436-442.
Zakikhany, K., Naglik, J.R., Schmidt-Westhausen, A., Holland, G., Schaller, M., Hube, B.
2007. In vivo transcript profiling of Candida albicans identifies a gene essential for
interepithelial dissemination. Cell Microbiology 9, 2938-2954.
Zardo, V., Mezzari, A. 2004. Os antifúngicos nas infecções por Candida sp. NewsLab. 63º
ed., p. 136-146.