1
Metabolismo de Carboidratos: Gliconeogênese
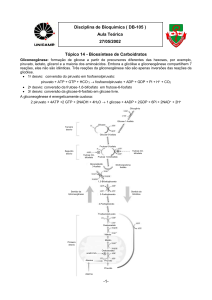
A gliconeogênese é a “síntese de novo de glicose” a partir de
precursores que não são carboidratos. O principal órgão responsável pela
gliconeogênese é o fígado, apesar de algumas células renais também serem
capazes de realizar essa via metabólica. Trata-se de uma reação que consome
ATP e GTP, ou seja, consome energia.
Compostos como lactato, piruvato, aminoácidos gliconeogênicos e
glicerol entram na via da gliconeogênese, que vai originar glicose-6-fosfato e,
posteriormente, glicose. O fígado regula a homeostase da glicose no sangue,
controlando o nível glicêmico. Se o fígado percebe, através de hormônios
hiperglicemiantes como o glucagon, que os níveis de glicemia no sangue
baixaram muito, ele começa a fazer gliconeogênese e envia a glicose
sintetizada para a corrente sangüínea para que tais níveis glicêmicos voltem ao
normal.
Enzimas e Processos Gliconeogênicos
O lactato e os aminoácidos gliconeogênicos podem ser convertidos em
piruvato, sendo assim capazes de entrar na gliconeogênese. O próprio piruvato
é, então, capaz de entrar na gliconeogênese e, também, há a possibilidade de
entrada na gliconeogênese de aminoácidos que, quando degradados, formam
oxalacetato. O piruvato e o oxalacetato são, portanto, pontos de entrada da
gliconeogênese.
Muitas das reações da gliconeogênese são as reações opostas às
catalisadas durante a glicólise. Somente as reações irreversíveis não entram
na gliconeogênese, por motivos óbvios. Nesse caso, sete são as reações que
acontecem na glicólise e que acontecerão na gliconeogênese, porém no
sentido inverso. As três reações da via glicolíticas que são irreversíveis são
substituídas por novas reações.
A piruvato-quinase converte o fosfoenolpiruvato a piruvato. Trata-se da
última reação da glicólise, sendo ela irreversível. Nesse caso, a piruvatoquinase será substituída, na gliconeogênese, por outras duas enzimas: a
piruvato-carboxilase e a fosfoenolpiruvato-carboxiquinase. Essas duas enzimas
vão iniciar o caminho oposto da glicólise, convertendo o piruvato a oxalacetato
e, depois, o oxalacetato a fosfoenolpiruvato. Então, durante a conversão do
piruvato a fosfoenolpiruvato, forma-se um intermediário: o oxalacetato. A
formação do oxalacetato é um ponto importantíssimo na gliconeogênese, pois
é a partir dele que aminoácidos gliconeogênicos e o próprio oxalacetato do
Ciclo de Krebs vão entrar no processo de gliconeogênese. Assim:
PIRUVATO → OXALACETATO → FOSFOENOLPIRUVATO
Piruvato-carboxilase
Fosfoenolpiruvato-carboxiquinase
A gliconeogênese acontece, de maneira geral, no citossol. Porém, essa
fase inicial da gliconeogênese (conversão do piruvato a fosfoenolpiruvato)
acontece, em parte, dentro da mitocôndria, visto que há a necessidade de uso
de algumas enzimas mitocondriais. O processo acontece da seguinte forma: o
2
piruvato entra na mitocôndria e é convertido a oxalacetato pela piruvatocarboxilase. O oxalacetato precisa sair da mitocôndria, e o único meio para que
isso aconteça é através da lançadeira malato-aspartato. Dessa forma o
oxalacetato é reduzido a malato, oxidando um NADH + H+ mitocondrial a NAD+.
O malato sai da mitocôndria e é oxidado, já no citossol, a oxalacetato pela
malato-desidrogenase, formando um NADH + H+ citossólico. Enfim, o
oxalacetato sofre a ação da fosfoenolpiruvato-carboxiquinase citossólica
transformando-se em fosfoenolpiruvato.
Quando o precursor gliconeogênico é o lactato, este será oxidado a
piruvato pela lactato-desidrogenase, havendo assim redução de um NAD+ a
NADH + H+. O piruvato entra na mitocôndria e é convertido a oxalacetato pela
piruvato-carboxilase e, ainda dentro da mitocôndria, o oxalacetato é convertido
a fosfoenolpiruvato pela fosfoenolpiruvato-carboxiquinase mitocondrial. O
fosfoenolpiruvato sai, assim, da mitocôndria e pode ir para as demais reações
da gliconeogênese. A diferença de direcionamento do lactato e do piruvato na
mitocôndria e no citossol se dá por causa da redução do NAD+ a NADH + H+.
Quando se tem o piruvato como precursor, este entra diretamente na
mitocôndria sem a formação essencial do NADH + H+ citossólico. O piruvato
será convertido em oxalacetato, que será reduzido a malato, que transportará
elétrons capazes de formar o NADH + H+ citossólico e oxalacetato novamente.
Este processo não é necessário quando o lactato é o precursor, visto que sua
transformação a piruvato pela lactato-desidrogenase no citossol já gerou o
NADH + H+ citossólico necessário para o posterior funcionamento da
gliconeogênese.
A formação de NADH + H+ é importante para a gliconeogênese porque a
enzima gliceraldeído-3-fosfato-desidrogenase precisa oxidar uma molécula de
NADH + H+ para catalisar sua reação na gliconeogênese, ao contrário do que
fazia no processo da via glicolítica. Assim, a formação do NADH + H + durante a
conversão do piruvato a fosfoenolpiruvato faz-se essencial.
O fosfoenolpiruvato será convertido a 2-fosfoglicerato pela enzima
enolase, a mesma da glicólise, porém funcionando em sentido oposto. O 2fosfoglicerato será convertido a 3-fosfoglicerato pela enzima fosfogliceratomutase, também presente na glicólise e funcionando em seu sentido reverso.
Depois, o 3-fosfoglicerato será convertido, pela enzima fosfoglicerato-quinase
também funcionando em sentido oposto, a 1,3-bifosfoglicerato, consumindo um
ATP por molécula de piruvato (dois ATPs por molécula de glicose formada). O
1,3-bifosfoglicerato será reduzido a gliceraldeído-3-fosfato pela enzima
gliceraldeído-3-fosfato-desidrogenase que, para tal, oxidará uma molécula de
NADH + H+ (proveniente da transformação do piruvato em fosfoenolpiruvato).
Enfim, o gliceraldeído-3-fosfato será convertido em di-hidróxi-cetona-fosfato
pela enzima triose-fosfato-isomerase e, então, o gliceraldeído-3-fosfato e a dihidróxi-cetona-fosfato serão condensados em uma molécula de frutose-1,6bifosfato pela enzima aldolase. O ponto de entrada do glicerol na
gliconeogênese é a partir da di-hidróxi-cetona fosfato. O glicerol pode vir, por
exemplo, da degradação de triglicerídeos. Todos esses processos, incluindo as
enzimas e co-enzimas, são os mesmos da glicólise, porém sempre
funcionando em sentido oposto.
No ponto onde há a frutose-1,6-bifosfato como substrato da
gliconeogênese, houve uma reação irreversível na glicólise: a conversão da
3
frutose-6-fosfato a frutose-1,6-bifosfato pela fosfofruto-quinase-1. Dessa forma,
a presença da enzima frutose-1,6-bifosfatase é essencial, pois ela vai clivar o
fosfato da posição 1, degradando a frutose-1,6-bifosfato e gerando a frutose-6fosfato.
A frutose-6-fosfato será transformada em glicose-6-fosfato pela enzima
fosfoglicose-isomerase. Essa enzima está presente na glicólise e funciona, na
gliconeogênese, em sentido reverso. A glicose-6-fosfato precisa ser fosfatada
para que seja capaz de sair da célula, visto que os transportadores GLUT não
são capazes de transportar a glicose fosforilada.
A conversão de glicose a glicose-6-fosfato feita pela hexoquinase
durante a glicólise é irreversível. Desta forma, para a formação de glicose a
partir de glicose-6-fosfato durante a gliconeogênese, faz-se necessária a
presença de uma enzima especial: a glicose-6-fosfatase. Esta enzima vai
retirar o fosfato da glicose-6-fosfato gerando a glicose, produto final da
gliconeogênese. A glicose-6-fosfatase é encontrada na membrana do retículo
endoplasmático. Para que a reação aconteça, a glicose-6-fosfato presente no
citossol tem que passar para dentro do retículo endoplasmático através do
transportador T1. Após a conversão da glicose-6-fosfato à glicose e fosfato
inorgânico pela enzima de membrana glicose-6-fosfatase, transportadores de
membrana T2 e T3 levam os produtos da reação novamente para fora do
retículo, no citossol. Existe uma proteína chamada SP que se encontra ligada à
glicose-6-fosfatase. Essa proteína possui a função de regular a glicose-6fosfatase.
A glicose-6-fosfatase é um fator determinante na razão pela qual a
gliconeogênese só acontece no fígado e em algumas células renais, visto que
ela só é presente em hepatócitos e em algumas células renais. Porém, ao
contrário da glicose-6-fosfatase, as enzimas da glicólise estão presentes em
todas as células. Já foi identificada a presença da glicose-6-fosfatase em
algumas células nervosas. Entretanto, o papel dessa enzima nos tecidos
cerebrais não foi ainda bem definido, visto que tais tecidos não são
gliconeogênicos. Alguns pesquisadores acreditam que a glicose-6-fosfatase
dos tecidos nervosos possui a função de equalizar a disponibilidade de glicose
para todas as células, ou seja, as células que estão com “combustíveis” a mais,
devem clivar suas glicose-6-fosfato através da glicose-6-fosfatase para
fornecer glicose para as células que estão com “combustíveis” a menos.
Uma equação geral da gliconeogênese, excluindo-se os subprodutos
formados, seria:
2 PIRUVATO + 4 ATP + 2 GTP + 2 (NADH + H+) + 6 H2O → GLICOSE
Os ATPs e GTPs consumidos na gliconeogênese são consumidos
durante as reações catalisadas pelas enzimas piruvato-carboxilase,
fosfoenolpiruvato-carboxiquinase e fosfoglicerato-quinase. Trata-se, assim, de
uma reação muito dispendiosa para o fígado. Mesmo sendo uma reação que
consome muita energia, a glicose produzida não será consumida pelo fígado
para fornecer energia para ele, mas sim enviada para tecidos onde sua energia
faça-se necessária.
4
Regulação da Gliconeogênese
Assim como a glicólise, a gliconeogênese precisa de regulação. Em
momentos de jejum em que o organismo precisa de glicose, a gliconeogênese
deve acontecer mais acentuadamente. A gliconeogênese acontece em
conjunto com a glicogenólise (quebra do glicogênio para formação de glicose)
para que haja quantidade suficiente de glicose para as necessidades
metabólicas do organismo. Dessa forma, os genes que codificam para as
enzimas
específicas
da
gliconeogênese
(piruvato-carboxilase,
fosfoenolpiruvato-carboxiquinase, frutose-1,6-bifosfatase e glicose-6-fosfatase)
devem ter uma maior expressão durante esses momentos de jejum. Outra
regulação da gliconeogênese é sua estimulação na presença do glucagon e
sua inibição na presença de insulina. As regulações também são feitas, assim
como o processo geral, de maneira reversa à glicólise. Dessa forma, a frutose1,6-bifosfatase será inibida por moléculas que estimulariam a fosfofrutoquinase-1 (sua enzima oposta na glicólise), como a frutose-2,6-bifosfato e o
AMP.
O glucagon vai causar, através de sua cascata de reações específicas, a
fosforilação de um ativador de transcrição, que é a CRED. A CRED fosforilada
torna-se ativa. A CRED liga-se ao DNA e favorece a expressão do gene da
fosfoenolpiruvato-carboxiquinase. É dessa forma que o glucagon é capaz de
regular a expressão gênica das enzimas da gliconeogênese e estimular a via
gliconeogênica.
Glicerol e Ácidos Graxos na Gliconeogênese
O glicerol, como dito anteriormente, pode entrar na gliconeogênese a
partir da di-hidróxi-cetona-fosfato. Esse glicerol pode vir da degradação de
triglicerídeos. Esse glicerol será convertido a glicerol-fosfato por uma enzima
chamada glicerol-quinase. O glicerol-fosfato sofre a ação de uma enzima
chamada glicerol-fosfato-isomerase, gerando di-hidróxi-cetona-fosfato, que vai
entrar na via gliconeogênica através de sua condensação a uma molécula de
gliceraldeído-3-fosfato, formando a frutose-1,6-bifosfato.
A conversão do glicerol a di-hidróxi-cetona-fosfato forma um subproduto
importante: a enzima reduzida NADH + H+. Para a formação da frutose-1,6bifosfato, não basta a presença da di-hidróxi-cetona-fosfato. Faz-se necessária,
também, a presença de uma molécula de gliceraldeído-3-fosfato. Essa
molécula pode ser sintetizada a partir da di-hidróxi-cetona-fosfato pela enzima
gliceraldeído-3-fosfato-desidrogenase, que vai reduzir a di-hidróxi-cetonafosfato a gliceraldeído-3-fosfato e oxidar uma molécula de NADH + H+ a NAD+.
Quando o organismo encontra-se em jejum, é o glucagon o hormônio
que está predominando com suas ações catabólicas. É por ação do glucagon,
que acontece a chamada “mobilização dos triglicerídeos no tecido adiposo”.
Essa mobilização ocorre para que haja combustível a ser degradado na
obtenção de energia. O triglicerídeo será quebrado em ácidos graxos e glicerol,
e o glicerol será enviado ao fígado, onde participará dos processos de
gliconeogênese. Os ácidos graxos, por sua vez, podem ser utilizados pelo
próprio tecido adiposo ou podem ser enviados para outros tecidos que utilizam
os ácidos graxos como combustível. O fígado, por exemplo, é um tecido que
não vai utilizar a glicose para obtenção da energia necessária para seu
metabolismo. Precisará, então, utilizar os ácidos graxos para tal fim.
5
Os ácidos graxos vão formar metabólitos diferentes dependendo do
número de carbonos pares ou ímpares de sua cadeia graxa. Por exemplo, os
ácidos graxos com um número par de carbonos, quando totalmente
degradados, formarão várias moléculas de acetil-CoA (2C). Os ácidos graxos
com um número ímpar de carbonos, por sua vez, formarão várias moléculas de
acetil-CoA (2C) e uma única molécula de propionil-CoA (3C).
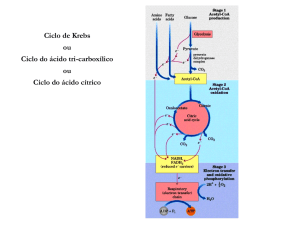
O acetil-CoA pode gerar energia através de sua participação no Ciclo de
Krebs, mas ele não é um composto gliconeogênico, visto que não há nenhuma
via que converta o acetil-CoA em qualquer intermediário da gliconeogênese.
Entretanto, o propionil-CoA poderá, sim, ser utilizado na gliconeogênese. Após
sofrer a ação da enzima propionil-CoA-carboxilase, ele é transformado em Dmetil-malonil-CoA. O D-metil-malonil-CoA será convertido a L-metil-malonilCoA por uma enzima racemase, cuja função é inverter a estereoquímica de um
composto opticamente ativo. O L-metil-malonil-CoA será convertido à succinilCoA pela enzima L-metil-malonil-mutase. O succinil-CoA, enfim, é capaz de ser
convertido em oxalacetato, este sendo um composto gliconeogênico.
Uma mobilização excessiva de ácidos graxos será sinalizada como uma
alta concentração de acetil-CoA. Essa alta mobilização de ácidos graxos e
conseqüente alta concentração de acetil-CoA indica que há necessidade de
glicogenólise e gliconeogênese, para que os níveis de glicose no sangue
fiquem normais. Assim, o acetil-CoA ativa (efetor alostérico positivo) a piruvatocarboxilase, estimulando as vias gliconeogênicas.
Dessa forma, pode-se perceber que há uma inter-relação entre o
metabolismo de ácidos graxos e a gliconeogênese, já que o produto gerado
pela degradação de ácidos graxos consegue atuar sobre enzimas da
gliconeogênese. Geralmente, todas as vias metabólicas são capazes, através
de efetores alostéricos e produtos das vias, de se relacionar, indicando uma
maior ou menor necessidade de cada uma delas em determinadas situações.
Ciclo de Cori e Ciclo da Glicose-Alanina
São ciclos iniciados quando entra-se em estado de jejum e que vão
fornecer precursores gliconeogênicos constantemente para o fígado.
a) CICLO DE CORI
Acontece entre o eritrócito e o fígado. O eritrócito, através da glicólise
anaeróbia, converte a glicose a lactato. Esse lactato é enviado para o fígado,
onde será convertido em piruvato, que vai entrar na gliconeogênese, formando
glicose. Essa glicose será enviada para o sangue, onde o eritrócito, mais uma
vez, converterá essa glicose a lactato, e assim o ciclo continuará. O eritrócito
utiliza-se desse processo porque não é capaz de fazer gliconeogênese. Assim,
ele utiliza a glicose, gera energia e manda o subproduto (lactato) para o fígado.
Esse lactato, no fígado, será convertido pela gliconeogênese em glicose, que
será enviada novamente para o eritrócito como fonte de energia.
b) CICLO DA GLICOSE-ALANINA
Envolve a troca de alanina que vem do músculo para o fígado. A alanina
é um aminoácido gliconeogênico que, quando perde seu grupamento amino,
gera piruvato. No músculo, a alanina pode vir da degradação de proteínas
musculares ou o piruvato formado através do metabolismo do músculo pode
6
ser convertido em alanina e essa alanina, então, será transportada para o
fígado, onde acontecerá a gliconeogênese. A alanina, no fígado, é convertida
em piruvato e entrará na gliconeogênese, formando glicose que será enviada
para outros tecidos através da corrente sangüínea.
Gliconeogênese e o Álcool
Ingestões exageradas de álcool causam uma queda brusca de glicose
no sangue. Essa hipoglicemia severa pode ser uma das causas do chamado
“coma alcoólico”. A queda dos níveis de glicose acontece porque o etanol,
quando ingerido, deve ser metabolizado a acetaldeído no fígado. Durante essa
metabolização, o etanol é oxidado, gerando uma coenzima reduzida NADH +
H+. O NADH + H+ vai sinalizar para as enzimas lactato-desidrogenase e
malato-desidrogenase, que vão “achar” que não está ocorrendo nenhuma
reação que utilize NADH + H+ e que há abundância de glicose, visto que as
coenzimas reduzidas encontram-se sobrando em abundância. Assim, a lactatodesidrogenase e a malato-desidrogenase catalisam reações glicolíticas
utilizando esse NADH + H+ ao invés de reações gliconeogênicas, causando
uma diminuição de precursores da gliconeogênese e conseqüente diminuição
desta, causando queda brusca nos níveis de glicose.
Via das Pentose-Fosfato
A via das pentose-fosfato é importante porque ela pode produzir ácidos
nucléicos e uma coenzima reduzida NADPH + H+, além de outros produtos
importantes. O NADPH + H+ produzido durante a fase oxidativa da via das
pentoses-fosfato é muito importante, pois ele é utilizado na síntese de várias
outras moléculas, como, por exemplo, hormônios esteróides. A via das
pentose-fosfato inicia-se com a glicose-6-fosfato. Na fase oxidativa produzemse a ribose-5-fosfato, utilizada na síntese de ácidos nucléicos, e o NADPH +
H+. Na fase não-oxidativa ocorre a formação de várias moléculas de
monossacarídeos com diferentes números de carbono, sendo estas moléculas
intermediários importantes na formação de outras moléculas.
O NADPH + H+ é importante não só para as vias de síntese, mas
também para as vias de detoxificação do organismo. A citocromo P450, por
exemplo, é uma enzima que metaboliza xenobióticos (compostos exógenos
estranhos a um organismo) ou, também, metabólitos endógenos tóxicos. Ela,
dessa forma, utiliza o NADPH + H+ para catalisar suas reações detoxificantes.
A citocromo P450 é a enzima que metaboliza a maioria dos medicamentos e
drogas ingeridos pelo organismo.
O NADPH + H+ é utilizado na síntese de ácidos graxos, colesterol e
hormônios esteróides, neurotransmissores e nucleotídeos. Órgãos que fazem
algumas dessas vias de biossíntese (glândulas adrenais, fígado, testículos,
ovários, glândulas mamárias, tecido adiposo e eritrócitos) são os órgãos onde a
via das pentose-fosfato encontra-se mais ativa.