MEDICINA – UFPE – 119
ALUNO: JOSÉ RAMOS DA COSTA JÚNIOR
PROFª: ELIZABETH CHAVES
OBJETIVOS – GLICONEOGÊNESE
1.
EXPLICAR O SIGNIFICADO DO TERMO GLICONEOGÊNESE OU NEOGLICOGÊNESE.
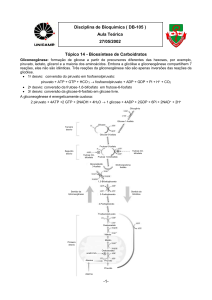
A formação de glicose a partir de precursores diferentes das hexoses é chamada de gliconeogênese (“formação de açúcar
novo”). Os precursores importantes da glicólise nos animais são: o lactato, o piruvato, o glicerol e a maioria dos
aminoácidos. Nos animais superiores a gliconeogênese ocorre principalmente no fígado e em uma extensão bem menor
no córtex cerebral.
2.
RECONHECER AS TRÊS ETAPAS IRREVERSÍVEIS DA GLICÓLISE QUE SÃO SUBSTITUÍDAS POR
REAÇÕES PRÓPRIAS DA GLICONEOGÊNESE.
Sete das dez reações enzimáticas da gliconeogênese são, na realidade, inversões de reações da glicólise. Entretanto, três
passos na glicólise são essencialmente irreversíveis e não podem ser empregadas na gliconeogênese:
A conversão de glicose em glicose-6-fosfato (hexoquinase);
A conversão de frutose-6-fosfato em frutose-1,6-difosfato (fosfofrutoquinase-1);
A conversão de fosfoenolpiruvato em piruvato (piruvato quinase);
Esses três passos são contornados por um conjunto separado de enzimas, catalisando reações diferentes e que são
irreversíveis no sentido da síntese de glicose.
3.
MOSTRAR QUE A FORMAÇÃO DE FOSFOENOLPIRUVATO A PARTIR DO PIRUVATO REQUER A
PARTICIPAÇÃO DA PIRUVATO CARBOXILASE (PK) E DA FOSFOENOLPIRUVATO
CARBOXINASE (PEPCK).
A primeira das reações a serem contornadas na gliconeogênese é a conversão do piruvato em fosfoenolpiruvato. Esta
conversão não pode ocorrer por simples inversão da reação da piruvato quinase. A fosforilação do piruvato é conseguida
por uma seqüência de reações que, nos mamíferos e em alguns outros organismos, requer a participação de enzimas
existentes tanto no citosol quanto no interior das mitocôndrias. Ela é a via predominante quando o piruvato ou a alanina é
o precursor gliconeogenico. Há ainda uma segunda possibilidade com o lactato sendo o precursor.
I. O piruvato é transportado do citosol para a mitocôndria, ou gerado dentro da mitocôndria por desaminação da
alanina. Então, a piruvato carboxilase, uma enzima mitocondrial que requer a coenzima biotina, converte o
piruvato em oxalacetato, usando ATP e CO2: piruvato + HCO3- + ATP oxalacetato + ADP + Pi + H+
*A piruvato carboxilase é a primeira enzima reguladora na via gliconeogenica; o acetil-CoA é necessário como efetor
alostérico positivo para que a enzima funcione.
II. O oxalacetato formado na mitocôndria é reversivelmente reduzido a malato pela malato desidrogenase
mitocondrial e com o consumo de NADH:
Oxalacetato + NADH + H+ malato + NAD+
III. A seguir o malato abandona a mitocôndria através do transportador malato-alfa-cetoglutarato presente na
membrana mitocondrial interna.
IV. No citosol o malato é reoxidado a oxalacetato com produção de NADH citosólico: malato + NAD+
Oxalacetato + NADH + H+;
V. O oxalacetato é então convertido em fosfoenolpiruvato pela fosfoenolpiruvato carboxiquinase através de uma
reação dependente de Mg2+ na qual o GTP funciona como fosfato doador: oxalacetato + GTP
fosfoenolpiruvato + CO2 + GTP;
Assim, para fosforilar uma molécula de piruvato em fosfoenolpiruvato precisam ser consumidos dois grupos fosfato de
alta energia (um do ATP e outro do GTP). A biossíntese de glicose depende do NADH, logo, a passagem do malato para
o citosol, convertendo-se em oxalacetato, tem o efeito abastecer o citosol com NADH.
Um segundo desvio piruvatofosfoenolpiruvato, e também mais curto, ocorre quando o lactato (proveniente da glicólise
nos músculos e nos eritrócitos) é o precursor gliconeogenico. A conversão do lactato em piruvato no citosol libera
NADH e não é mais necessária a exportação do malato da mitocôndria para o citosol. Depois que o piruvato produzido
pela reação da lactato desidrogenase é transportado para o interior da mitocôndria, ele é convertido em oxalacetato pela
piruvato descarboxilase como anteriormente. Este oxalacetato é, contudo, convertido diretamente em fosfoenolpiruvato
por uma forma mitocondrial da fosfopiruvato carboxiquinase. O fosfoenolpiruvato é então colocado para fora da
mitocôndria e continua a via glicogênica.
4.
SABER QUE A CARBOXILAÇÃO DO PIRUVATO REQUER CO2, ATP COMO DOADOR DE
ENERGIA, SENDO ATIVADA POR ELEVADAS CONCENTRAÇÕES DE ACETIL-CoA.
Esta reação está descrita no item anterior. O acetil-CoA ativa, pois se está em elevadas quantidades, é porque o ciclo de
Krebs não está acompanhando a sua velocidade de formação, logo, ele sai da mitocôndria e inibe a glicólise para que não
seja mais formado.
5.
EXPLICAR AS REAÇÕES DE TRANSFORMAÇÃO DA FRUTOSE-1,6-BIFOSFATO EM F6P E DA G6P
EM GLICOSE, INDICANDO ENZIMAS, PRODUTOS, INIBIDORES E ATIVADORES.
Frutose-1,6-bifosfato em frutose-6-fosfato: essa reação é catalisada pela enzima frutose-1,6-difosfataseMg2+,
que promove a hidrólise do fosfato no C1:
Frutose-1,6-bifosfato + H2O frutose-6-fosfato + Pi
a)
b) Glicose-6-fosfato em glicose livre: a desfosforilação da glicose-6-fosfato é catalisada pela enzima glicose-6fosfatase: G6P + H2O glicose+ Pi.
A biossíntese de glicose a partir de piruvato é promovida apenas quando se estabelece um excesso mitocondrial de acetilCoA em relação às necessidades imediatas da célula para alimentar o ciclo de Krebs. Outro ativador é quando temos
muito ATP (análogo à glicólise).
Regulação hormonal: é mediada pela frutose-2,6-bifosfato, efetor alostérico para as enzimas PFK-1 e frutose-1,6bifosfatase. Quando a frutose-2,6-bifosfato une-se ao sítio alostérico da PFK-1, ela aumenta a afinidade desta enzima
pelo seu substrato frutose-6-fosfato e reduz sua afinidade pelos seus inibidores alostéricos, o ATP e o Citrato. Portanto, a
frutose-2,6-bifosfato ativa a PFK-1 e inibe a FBPase-1 e desta forma desacelera a gliconeogênese. O nível de frutose-2,6bifosfato reflete o nível de glucagon no sangue, que por sua vez reflete no nível de glicose sanguínea. A frutose-2,6bifosfato é formada pela fosforilação da frutose-6-fosfato catalisada pela fosfofrutoquinase-2 e sua hidrólise pela frutose2,6-bifosfatase. Ambas são parte de uma única enzima bifuncional. O equilíbrio de ambas e, portanto o nível celular de
frutose-2,6-bifosfato é controlado pelo glucagon.
O glucagon estimula a adenilato ciclase, uma enzima que sintetiza cAMP, a partir do ATP. O cAMP estimula a proteína
quinase dependente de cAMP, que transfere um grupo fosfato do ATP para a proteína bifuncional PFK-2/FBPase-2. A
fosforilação desta proteína aumenta a atividade da FBPase-2 e inibe PFK-2. O glucagon, portanto, diminui o nível celular
de frutose-2,6-bifosfato, inibindo a glicólise e estimulando a gliconeogênese.
6.
SABER PORQUE SOMENTE O FÍGADO PODE AJUDAR A MANTER A TAXA DE GLICOSE
SANGUÍNEA.
A enzima glicose-6-fosfatase depende de Mg2+ é encontrada no retículo endoplasmático de hepatócitos. Não está
presente nos músculos ou no cérebro, logo, a gliconeogênese não ocorre nesses tecidos.
Na gliconeogênese o piruvato é carboxilado até oxalacetato pela enzima piruvato carboxilase que é encontrada nas
mitocôndrias das células do fígado.
Na ausência prolongada de ingestão de carboidratos, o fígado realiza glicogenólise liberando glicose para o sangue.
Quando o suprimento de glicose é adequado, o excesso é convertido em glicogênio pelo fígado.
A glicocinase reage exclusivamente no fígado e depende da concentração sanguínea de glicose. Se a concentração de
glicose for muito alta, teremos a participação dessa enzima ajudando o fígado a captar mais glicose e formar glicogênio,
estocando essa glicose. Se a glicose voltar aos níveis normais basais ela deixa de atuar. Então ela é dependente dessa
concentração no sangue, não sofrendo outro processo regulatório. A glucocinase tem um alto Km, que contribui para a
capacidade do fígado de “tamponar” os níveis de glicose sanguínea. Qualquer aumento na concentração de glicose, leva
a um aumento proporcional na velocidade de fosforilação de glicose pela glicocinase. Da mesma forma, qualquer
diminuição na concentração de glicose leva a uma diminuição proporcional na velocidade de forforilação da glicose.
Portanto, o fígado utiliza a glicose a uma velocidade significativa apenas quanto os níveis de glicose sanguínea estão
elevados.