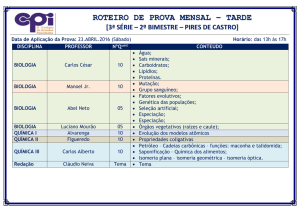
COLÉGIO NOSSA SENHORA DA PIEDADE
Programa de Recuperação Paralela
1ª Etapa – 2014
Disciplina: QUÍMICA
Ano: 3º
Professora: Maria Luiza
ENSINO MÉDIO
Caro aluno, você está recebendo o conteúdo de recuperação.
Faça a lista de exercícios com atenção, ela norteará os seus estudos.
Utilize o livro didático adotado pela escola como fonte de estudo.
Se necessário, procure outras fontes como apoio (livros didáticos, exercícios além dos propostos, etc.).
Considere a recuperação como uma nova oportunidade de aprendizado.
Leve o seu trabalho a sério e com disciplina. Dessa forma, com certeza obterá sucesso.
Qualquer dúvida procure o professor responsável pela disciplina.
Conteúdo
ISOMERIA PLANA E ESPACIAL
COMPOSTOS ORGÂNICOS
CINÉTICA QUÍMICA, EQUILÍBRIO E
CONSTANTE DE EQUILÍBRIO
Recursos para Estudo / Atividades
LIVRO, CADERNO E FOLHAS
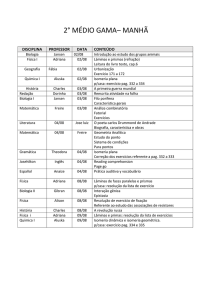
COLÉGIO NOSSA SENHORA DA PIEDADE
ENSINO MÉDIO
Área de Conhecimento:
Ciências da Natureza
Tipo de Atividade:BLOCO DE RECUPERAÇÃO
Disciplina:
QUÍMICA
Professora: MARIA LUIZA
Nome:
3º Ano
Data: 22/05/2014
Turma:
Querido (a) aluno (a):
Para que se organize melhor siga as orientações abaixo:
LEIA com atenção cada questão;
PROCURE compreender o que está sendo pedido, para você resolver;
ELABORE respostas completas;
FAÇA uma letra legível;
RELEIA todas as suas respostas antes de entregar ao professor (a).
SUCESSO!
QUESTÃO 01:
As estruturas desses dois isômeros estão representadas abaixo:
INDIQUE o nome oficial desses dois compostos, respectivamente:
a) ácido trans-butenodioico e ácido cis-butenodioico
b) ácido cis-butenodioico e ácido trans-butenodioico
c) ácido Z-butenodioico e ácido E-butenodioico
d) ácido E-butenodioico e ácido Z-butenodioico
e) ácido cis-etenodioico e ácido trans-etenodioico
1ª Etapa
Nº
QUESTÃO 02:
Mas QUAL É o tipo de isomeria que se estabelece entre a propanona e o prop-1-en-2-ol?
a) Isomeria de Função
b)Isomeria de Cadeia
c) Isomeria de Posição
d) Isomeria Dinâmica ou Tautomeria
e) Isomeria de Compensação ou Metameria
QUESTÃO 03:
O ciclopropano, composto usado como anestésico, e o propeno, que é usado como matéria-prima para a
produção de polímeros, são isômeros entre si. ESCREVA a fórmula estrutural de cada um, as suas fórmulas
moleculares e o tipo de isomeria de ambos.
QUESTÃO 04:
(PUC-SP) Os dois compostos H3C – O – CH3 e H3C – CH2 – OH DEMONSTRAM que caso de Isomeria?
a) cadeia
b) posição
c) composição
d) função
e) tautomeria
QUESTÃO 05:
DETERMINE possíveis isômeros do composto com fórmula molecular C4H10.
QUESTÃO 06:
(UnB-DF) INDIQUE quais das seguintes substâncias apresentam isomerismo geométrico:
1. 2-metilbut-2-eno
2. hex-2-eno
3. 1,3-dimetilciclobutano
4. but-2-eno
5. 1,2-dimetilbenzeno
6. 1,2-diclorociclopentano
QUESTÃO 07:
QUAL dos compostos abaixo apresenta isomeria geométrica?
a.) Propano
b.) 1 buteno
c.) 1 penteno
d.) 1 hexeno
e. )2 hepteno
QUESTÃO 08:
Considere os seguintes pares de substâncias:
I. metilbutano e butano
II. 1-propanol e 2-propanol
III. butanal e 2-butanol
IV. ácido propanóico e etanoato de metila
V. etanol e ácido etanóico
SÃO ISÔMEROS entre si somente os pares de substâncias indicados nos itens:
(A) I, II e V.
(B) II e IV.
(C) III e V.
(D) II, III e IV.
(E) I e V
QUESTÃO 09:
ASSINALE a alternativa que indica um isômero funcional da propanona:
(A) Propanal.
(B) Metóxi-etano.
(C) Ácido propanóico.
(D) 1-propanamina.
(E) Propano.
QUESTÃO 10:
CONSIDERE os compostos orgânicos:
(I) 1-butanol,
(II) metóxi-propano,
(III) ácido butanóico,
(IV) butanal
(V) but-2-ona.
O etanoato de etila é isômero do composto:
(A) I.
(B) II.
(C) III.
(D) IV.
(E) V.
QUESTÃO 11:
APLIQUE a equação de Gulberg Waage (lei da ação das massas) às reações apresentadas:
a) 2 N2(g) + 3 O2(g)
b) 2 NO2(g)
2 N2O3(g)
N2O4(g)
QUESTÃO 12:
(OSEC) Em uma reação, O COMPLEXO ATIVADO:
a) possui mais energia que os reagentes ou os produtos.
b) age como catalisador.
c) sempre forma produtos.
d) é composto estável.
e) possui menos energia que os reagentes ou os produtos.
QUESTÃO 13:
(MAUÁ) POR QUE o catalisador altera velocidade de uma reação?
QUESTÃO 14:
O QUE É energia de ativação?
QUESTÃO 15:
Para a reação A+B → C foram realizados três experimentos, conforme a tabela abaixo:
Experimento
I
II
III
[A]
mol/L
0,10
0,20
0,10
[B]
mol/L
0,10
0,20
0,20
Velocidade
de
reação mol/(L.min)
2,0. 10-3
8,0. 10-3
4,0.10-3
DETERMINE:
a ) A lei da velocidade da reação acima;
b ) A constante de velocidade;
c ) A velocidade de formação de C quando as concentrações de A e B forem ambas 0,50M.
QUESTÃO 16:
-Seja a reação: X → Y + Z. A variação na concentração de X em função do tempo é:
X(mol/L)
1,0
0,7
0,4
0,3
tempo(s)
0
120
300
540
A VELOCIDADE MÉDIA da reação no intervalo de 2 a 5 minutos é:
a) 0,3 mol/L.min.
b) 0,1 mol/L.min.
c) 0,5 mol/L.min.
d) 1,0 mol/L.min.
e) 1,5 mol/L.min
QUESTÃO 17:
ASSINALE abaixo qual alternativa é incorreta acerca de um equilíbrio químico:
a) A velocidade da reação direta é igual à velocidade da reação inversa.
b) Ambas as reações (direta e inversa) ocorrem simultaneamente (trata-se de um equilíbrio dinâmico).
c) As características macroscópicas do sistema (desde que fechado) não mais se alteram.
d) Os sistemas se deslocam espontaneamente para o estado de equilíbrio.
e) Obrigatoriamente, as concentrações de todas as substâncias participantes do equilíbrio devem ser iguais.
QUESTÃO 18:
(UFRS) Suponha uma reação química genérica do tipo A + B
AB que é iniciada com 2 mols de A e
com 2 mols de B. Se, após atingido o equilíbrio químico, a quantidade de A existente no sistema for de 0,5 mol,
A CONSTANTE DE EQUILÍBRIO SERÁ:
a) 0,5
b) 1,5
c) 3,0
d) 4,0
e) 6,0
QUESTÃO 19:
3 mols de PCl5(g)
são
colocados
em
um
recipiente,
atingindo
o
seguinte
equilíbrio:
No momento do equilíbrio, 60% do reagente sofre dissociação. Sabendo que a pressão total do sistema é
4,8atm, CALCULE o valor de KP:
QUESTÃO 20 .
ESCREVA a expressão da constante de equilíbrio em função da concentração (Kc) das seguintes reações:
a) H2 (g) + I2 (g)
b) 3 C2H2 (g)
c) N2 (g) + 3 H2 (g)
2 HI (g
C6H6 (g
2 NH3 (g)
“NSP, 100 anos de MISSÃO na EDUCAÇÃO!”