QUESTÕES PAVE 1
PROF. JULIANA BRAUN
2013 - 38) A maioria dos elementos químicos são
O número de oxidação dos halogênios presentes no
metais. Qual dos seguintes metais tem ponto de fusão,
KIO4 (periodato de potássio) e no Ca(ClO)2 (hipoclorito
abaixo da temperatura ambiente, em pressão
de cálcio) são, respectivamente,
ambiente?
(a) +7 e +3.
(a) Li.
(b) +5 e +1.
(b) Mg.
(c) -2 e -2.
(c) Pb.
(d) +7 e +2.
(d) W.
(e) +7 e +1.
(e) Hg.
(f) I.R.
(f) I.R.
2013 – 43) Em nosso organismo, alguns íons
2013 – 39) A vitamina B12 apresenta em sua estrutura o
apresentam funções muito importantes; entre eles,
elemento químico cobalto. Essa vitamina é muito
podemos destacar: nitrito, bicarbonato, fosfato e
importante na formação dos glóbulos vermelhos do
amônio. As fórmulas corretas desses íons são,
sangue e na síntese de lipídios.
respectivamente,
+2
A distribuição eletrônica correta do cátion Co é
(a) NO3-, CO3-2, PO4-2 e NH4+.
(a) 1s2 2s2 2p6 3s2 3p6 3d7.
(b) NO3-, HCO3-, PO4-3 e NH3+.
(b) 1s2 2s2 2p6 3s2 3p6 4s2 3d9.
(c) NO2-, CO3-2, PO4-3 e NH3+.
(c) 1s2 2s2 2p6 3s2 3p6 4s1 3d10.
(d) NO3-, HCO3-, PO4-2 e NH2+.
(d) 1s2 2s2 2p6 3s2 3p6 4s2 3d5.
(e) NO2-, HCO3-, PO4-3 e NH4+.
(e) 1s2 2s2 2p6 3s2 3p6 4s1 3d6.
(f) I.R.
(f) I.R.
2013 – 40) Ao combinarmos átomos do elemento mais
eletronegativo da classificação periódica dos elementos
com átomos do metal alcalino de menor raio atômico,
forma-se
(a) H2O.
(b) HF.
(c) Li2O.
(d) FrF.
(e) LiF.
(f) I.R.
2013 – 41) O ácido clorídrico reage facilmente com
alguns metais e sais.
Considere as seguintes reações:
I) ácido clorídrico + zinco metálico
X + sal.
II) ácido clorídrico + carbonato de zinco
Y+
sal + água.
O sal formado e os compostos X e Y são,
respectivamente,
(a) ZnCl2, Cl2 e CO.
(b) ZnCl , H2 e CO.
(c) ZnCl2 , H2 e CO2 .
(d) Zn(ClO)2 , H2 e CO2.
(e) ZnClO , Cl2 e CO2.
(f) I.R.
2013 – 42) Os halogênios são elementos que participam
na estrutura de muitos compostos químicos, entre os
quais se destacam os sais.
2010 – 38) Um átomo A possui 15 nêutrons e a seguinte
distribuição eletrônica: K = 2, L = 8, M = 4. Outro
átomo, B, possui 14 nêutrons e é isóbaro de A.
Qual será o número de massa de A, e qual
a distribuição eletrônica do átomo B?
(a) 29 e 1s2 2s2 2p6 3s2 3p3
(b) 15 e 1s2 2s2 2p6 3s2 3p3
(c) 29 e 1s2 2s2 2p6 3s2 3p2
(d) 14 e 1s2 2s2 2p6 3s2 3p6 4s2 3d9
(e) 15 e 1s2 2s2 2p6 3s2 3p6 4s2 3d9
(f) I.R.
2010 – 39) Em relação ao íon do átomo de 12Mg24 é
correto afirmar que seu número de prótons é _____,
seu número de elétrons é _____ e que a fórmula do
composto formado com átomos de elemento 8O16 é
_____ .
A alternativa que completa correta e
respectivamente as lacunas na frase acima é:
(a) 12, 12 e MgO
(b) 12, 10 e MgO
(c) 12, 10 e Mg2O2
(d) 24, 12 e MgO
(e) 24, 12 e Mg2O2
(f) I.R.
2010 – 40) Os elementos hipotéticos X, Y e Z
apresentam as seguintes configurações eletrônicas,
agrupadas em camadas, nos seu átomos:
X = 1s2 2s2 2p6 3s2 3p6 3d5 4s2
Y = 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2
Z = 1s2 2s2 2p6 3s2 3p6
De acordo com tais estruturas, os três elementos são
classificados, respectivamente, como elemento:
(a) representativo, de transição, gás nobre.
(b) representativo, de transição, representativo.
(c) de transição, representativo, gás nobre.
(d) de transição, de transição gás nobre.
(e) representativo, representativo, representativo.
(f) I.R.
2010 – 41) Conforme as configurações abaixo dos
elementos hipotéticos A, B e C;
A17 = 1s2 2s2 2p6 3s2 3p5
B12 = 1s2 2s2 2p6 3s2
C16 = 1s2 2s2 2p6 3s2 3p4
Pode-se prever que, reagirem entre si,
I) A e B formarão um composto iônico.
II) A e C formarão um composto covalente.
III) átomos do elemento B se unirão através de ligação
covalente.
Está(ão) correta(s)
(a) somente I e III.
(b) somente I e II.
(c) somente II.
(d) somente III.
(e) I, II e III.
(f) I.R.
2010 – 42) Nas colunas a seguir, a de número 1
apresenta as fórmulas dos compostos, e a 2, os nomes
desses compostos. Relacione as colunas 1 e 2, de
acordo com a fórmula que representa cada composto.
Coluna 1
Coluna 2
A) Fe2(SO4)3
( ) Hidróxido de Amônio
B) FeS
( ) Óxido Cúprico
C) CuO
( ) Sulfeto ferroso
D) NH4OH
( ) Amônia
E) NH3
( ) Sulfato férrico
De cima para baixo, a sequência que completa
corretamente a coluna 2 é:
(a) D, C, B, E e A.
(b) E, C, B, D e A.
(c) D, C, A, E e B.
(d) C, D, B, E e B.
(e) D, B, C, A e E.
(f) I.R.
2009 – 38) A alternativa que apresenta a configuração
eletrônica correta (ordenada por camadas) de um metal
alcalino que se encontra no 5º período da tabela
periódica e os valores dos números quânticos que
identificam, respectivamente, o nível, o subnível e o
orbital do(s) elétron(s) de sua camada mais externa é
(a) 1s2 2s2 2p6 3s2 3p6 3d104s2 4p6 4d10 5s1 – n = 5,
ℓ=0em=0
(b) 1s2 2s2 2p6 3s2 3p6 4s1 – n = 4, ℓ = 0 e m = 0.
(c) 1s2 2s2 2p6 3s2 3p6 3d104s2 4p6 5s2 – n = 5, ℓ = 0 e
m = + ou -1/2
(d) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s1 – n = 5, ℓ = 0
em=0
(e) 1s2 2s2 2p6 3s2 3p6 3d104s1 – n = 4, ℓ = 1 e m = 0
(f) I.R.
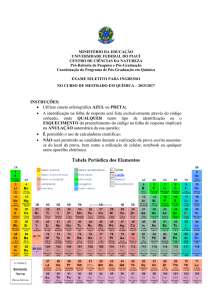
2009 – 39) A Tabela Periódica encerra várias
classificações dos elementos químicos como, por
exemplo, as que os classificam em metal, não metal ou
gás nobre e em representativo de transição (externa) ou
de transição interna. Observe a figura abaixo com uma
resumida Tabela Periódica.
Nessa tabela, é possível a observação de quatro regiões
distintas.
1ª) Uma primeira região central (onde se encontra o Tc)
em que constam elementos dos grupos 3B até 8B,1B e
2B (também designados como grupos 3 até o grupo 12).
2ª) Uma segunda região, onde constam os elementos
dos grupos designados pela letra A (de 1 a 7) ou pelos
números 1, 2, 13,...,17.
3ª) Uma terceira região colocada abaixo (onde tem o U)
e composta por duas linhas de elementos para as quais
duas setas indicam ocuparem, respectivamente, o sexto
e o sétimo períodos da Tabela Periódica, grupo 3B.
4ª) Por fim uma quarta região correspondente ao grupo
0 (zero) ou 18.
Feitas essas considerações sobre a Tabela Periódica e as
classificações nela contidas, analise as seguintes
afirmativas:
I) Na terceira região citada (onde se encontra o U) os
elementos são metálicos e de transição interna.
II) Os gases nobres, com exceção do He, apresentam a
camada mais externa com 8 elétrons e são encontrados
no grupo 0 (zero) ou 18.
III) Apenas entre os elementos representativos é que
podem ser encontrados não metais e gases nobres.
IV) Os átomos dos elementos de transição externa
(região central, onde se encontra o Tc) têm seu(s)
elétron(s) mais externo(s) distribuído(s) em subnível d
ou f.
Dessas afirmativas, estão corretas, apenas,
(a) I e IV.
(b) I, II e III.
(c) I, II e IV.
(d) II e III.
(e) III e IV.
(f) I.R.
2009 – 40) Na fórmula estrutural plana H – Cℓ, o traço
representa uma ligação
(a) covalente apolar.
(b) iônica.
(c) metálica.
(d) por pontes de hidrogênio.
(e) covalente polar.
(f) I.R.
2009 – 41) Os ácidos apresentam, em seus nomes,
determinados sufixos que orientam o sufixo que a
estrutura negativa dos sais apresentarão nos seus
nomes. Assim, é correto afirmar que
(a) oxiácidos carregam, em seus nomes, o sufixo ídrico,
e os ânions deles oriundos, o sufixo eto.
(b) oxiácidos podem carregar, em seus nomes, os
sufixos oso ou ico, e os correspondentes ânions deles
oriundos, respectivamente, os sufixos ito ou ato.
(c) oxiácidos carregam, em seus nomes, os sufixos oso e
ico, e os ânions deles oriundos, respectivamente, os
sufixos eto e uto.
(d) hidrácidos carregam, em seus nomes, o sufixo ídrico,
e os ânions deles oriundos, os sufixos Ito e ato.
(e) hidrácidos carregam, em seus nomes, o sufixo ídrico,
e os cátions deles oriundos, o sufixo eto.
(f) I.R.
2009 – 42) As fórmulas HCN, CaCO3 e NH4OH
representam, respectivamente, um
(a) oxiácido, um sal e uma tetrabase.
(b) monoácido, um óxido e uma base quartenária.
(c) hidrácido, um sal e uma base fraca.
(d) ácido ternário, um óxido e uma base forte.
(e) hidrácido, óxido e um sal ternário.
(f) I.R.
2009 – 43) Seja a reação representada por :
H3PO4 + Ca(OH)2
Ca3(PO4)2 + H2O
Para balanceamento da equação acima é necessário
adicionar, antes dos reagentes e produtos, os seguintes
coeficientes estequiométricos
(a) 3, 2, 6 e 4
(b) 2, 1, 3 e 3
(c) 6, 3, 1 e 3
(d) 3, 1, 3 e 2
(e) 2, 3, 1 e 6
(f) I.R.