Aula de Carboidratos I – 20/11/2006
Parte 1
Transcrita por Carlos Eduardo de Macedo Marins
OBS: algumas partes estão inaudíveis (...), e outras também o estão, entretanto dá para
compreender o geral, por isso, coloquei o que eu entendi.
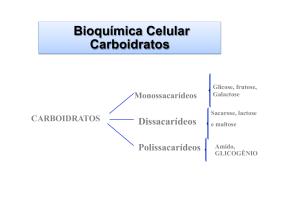
Vamos a carboidratos. Nós vamos ter (...). Vocês vão apresentando e fazendo a análise
bioquímica pra obter o metabolismo.
Bem, os carboidratos são definidos como poliidroxialdeídos ou poliidroxicetonas. (...)
devem ter o grupo aldeídico ou cetônico e terem mais de uma hidroxila, no mínimo duas, é o
número mínimo que a gente deve ter e os derivados deles também.
O grupo aldeído q você está vendo aqui comigo, ele é reduzido a um álcool primário,
então isso aí continua sendo um derivado de um monossacarídeo, portanto é considerado
ainda um carboidrato. Existem derivados aminados, fosforilados, etc. Então qualquer derivado
que provém de um monossacarídeo é incluído como carboidrato.
[Passa-se um tempinho com o computador da professora travado, mas logo após ele
volta a funcionar]
Bem, então, como nós falamos, eles são poliidroxilados, vocês tem marcados em rosa ali
a função aldeídica ou cetônica. Do lado esquerdo o aldeído, do lado direito a cetona. E os dois
mais simples monossacarídeos, que é o Gliceraldeído – que tem a função aldeído e 2
hidroxilas – e a Dihidroxiacetona – que tem a função cetona e 2 hidroxilas. Desses
compostos, vocês podem observar que o gliceraldeído e a dihidroxiacetona têm 3 carbonos.
Isso quer dizer que os menores monossacarídeos conhecidos são as chamadas trioses, porque
os carboidratos também são chamados de oses. Então essas trioses que tem 3 carbonos são as
mais comuns de serem encontradas - o gliceraldeído e a dihidroxiacetona – em nosso
metabolismo. Então a gente vai ver muito isso a partir da próxima aula, quando a gente entrar
na parte de metabolismo, vocês vão ter a oportunidade de ver.
O que tem de curioso aí, vocês podem observar que no caso do glicealdeído existe um
carbono assimétrico, e no caso da dihidroxiacetona isso não acontece. Então a
dihidroxiacetona não apresenta isomeria óptica, enquanto o gliceraldeido e os demais
monossacarídeos, todos, com exceção da dihidróxiacetona, eles apresentam carbono
assimétrico.
Abaixo vocês têm 2 outros compostos extremamente presentes no metabolismo, a
Glicose e a Frutose. A glicose é uma aldose, ou seja tem um grupamento aldeído, e ao mesmo
tempo ela tem 6 átomos de carbono, então nós chamamos de uma aldohexose. Então a
Glicose é uma aldohexose, enquanto que a Frutose é uma cetohexose, porque ela tem 6
carbonos e um grupamento cetona. Essas 2 oses, esses 2 monossacarídeos, no metabolismo se
interconvertem, tanto a Glicose pode dar frutose como a frutose pode dar glicose, na forma
fosforilada, a gente vai ver bem. Então esses carboidratos, se vocês observarem também, eles
têm, uma característica em comum, que é essa hidroxila no penúltimo átomo de carbono (...)
do lado direito. Então isso quer dizer que esses monossacarídeos pertencem a uma série,
denominada SÉRIE D, que é a série encontrada na natureza. Em laboratório, você pode
formar carboidratos com a penúltima hidroxila do lado esquerdo, ou seja, normalmente
quando ele sai, feito no laboratório, há uma mistura (...) de isômeros D e L. Nesse caso, na
natureza, não! Porque quando elas sintetizam, elas só fazem isômeros D, com a hidroxila do
lado direito. Então é isso o que vocês vão ver quando a gente for trabalhar. Então elas são
hexoses porque têm 6 carbonos, e são aldoses ou cetoses, dependendo da grupo funcional que
apresentam.
Bem, o que vamos agora mostrar pra vocês? Aquela mesma coisa que foi feita em
aminoácidos. Você tem formas distintas de mostrar os grupos funcionais, os que ficam mais
projetados pra frente, os que ficam mais pra trás, mas a forma mais comum que a gente usa é
a de Fischer, que é uma projeção (...) que mostra a posição das hidroxilas. Aí você tem o
gliceraldeído com a hidroxila do lado direito, e o segundo do lado esquerdo. Então tem a
forma D e L. Novamente não se esqueçam de lembrar que D e L estão se referindo à posição
da penúltima hidroxila, melhor dizendo dela no penúltimo carbono, se à direita ou à esquerda.
Nunca a isomeria óptica. Um composto D pode girar pra direita ou esquerda.Bem e abaixo,
vocês têm essas formas em perspectivas, sempre que houver ligações tracejadas, pra trás do
plano; e as cheias pra frente do plano.
Vamos ver agora (...) a série D. É bom que vocês olhem isso com a curiosidade de
quando a gente vai aumentando, colocando novos átomos de carbono, vão se formando
cadeias cada vez mais complicadinhas, que nós não precisamos decorar todas as estruturas pra
ter a base do metabolismo. À medida que a gente vai aumentando o número de carbonos, nós
vamos aumentando a quantidade de isômeros.
Nós vamos primeiro ver a série D das aldoses, que tem grupamento aldeído. Bem, o
mais simples que vocês estão vendo é o D-Gliceraldeído. Quando nós vamos aumentar o
número de carbonos dessa cadeia, o novo carbono que entra continua sendo um centro de
assimetria. Então essa hidroxila primeira continua do lado direito, mas a segunda que é
introduzida, sempre a introdução é feita entre o carbono funcional – aldeídico ou cetônico - e
o carbono seguinte. Então quando a gente coloca um novo átomo de carbono aqui, cria-se um
novo centro de assimetria, e essa nova hidroxila pode ficar do lado direito ou do lado
esquerdo, então isso forma 2 novos isômeros independentes da série D, porque o que informa
como série D é a (OH) do penúltimo carbono, então eles independem da série D. São 2
isômeros distintos, a Eritrose e a Treose, que funcionalmente, apenas para vocês entenderem,
mas em metabolismo não vamos falar de eritrose nem treose.
Bem, daí nós vamos introduzir mais um carbono, e vocês vão ver que cada um deles vai
dar origem a 2, novamente, por que? Vejam, a eritrose tem as 2 (OH) do lado direito, então
esse novo pode entrar a direita ou a esquerda. Logo, temos a Ribose e a Arabinose. E o que
tinha 1 a direita e um a esquerda, que era a Treose, quando nós colocamos um novo carbono,
criamos 2 centros de assimetria, a Xilose e a Lixose. Desses todos o que vocês vão realmente
precisar é a Ribose. Arabinose, Xilose e Lixose vocês não vão ouvir falar delas. O
Gliceraldeído é importante e a ribose. A partir daí, de 4 nós vamos formar 8. Por que? Porque
cada um novamente vai dar origem a 2. (...)Então, o que é importante saber? Glicose, Manose
e Galactose são os mais importantes, que eu gostaria que vocês memorizassem. Então quais
vamos precisar que vocês guardem a estrutura? O Gliceraldeído, a Ribose, e essas 3 hexoses,
a Glicose, a Manose e a Galactose. Essas 3 são realmente bem importantes (...).
[Ela repete os importantes]
A série das cetoses agora. Nós temos a menor cetose, a dihidroxiacetona, como eu disse
pra vocês, como ela não tem carbono assimétrico, também não tem o penúltimo carbono com
hidroxila, ela não apresenta as séries D ou L. Nós só vamos ter série D e L em cetoses a partir
de 4 carbonos. O composto que forma a partir dele é o D e o L, como nós só estamos
estudando a série D, nós vamos apenas considerar a D-Eritrulose, que tem a (OH) pro lado
direito. Então essa eritrulose; que aparece algumas vezes no metabolismo, no ciclo das
pentoses, não é bom vocês guardarem ela, as 2 aliás, dihidróxiacetona e eritrulose; ela vai dar
origem a ribulose e xilulose.
[Alguém faz uma pergunta e tanto a pergunta como a resposta estão inaudíveis]
Sim, nas pentoses, você tem ribulose e xilulose, não muito importantes, principalmente
quando nós formos falar de glicoproteínas, e polissacarídeos estruturais. Então ribulose e
xilulose são os 2 isômeros que se formam a partir da eritrulose. Também não vamos perder
tempo com essas da série D.
(...)
Bem, entenderam o que é série D e série L, vamos agora falar um pouquinho de
epímeros. Monossacarídeos que só diferem de uma posição de 1 (OH). Por exemplo, a
Glicose e a Manose [ela dá toda a configuração da glicose, e diz que é epímero no carbono 2
da manose]. Então, no caso a D-glicose pode formar a D-manose, basta ter no organismo a
enzima EPIMERASE, essa enzima modifica a posição de 1 (OH) de apenas 1 carbono. Nesse
caso, com relação ao carbono 2, a estrutura da glicose, com exceção da hidroxila do carbono
2, é igual à manose. E, com relação à galactose, é no carbono 4. Na galactose, a hidroxila do
carbono 4 está voltada pra esquerda, já na glicose, ela se volta pra direita. Então essas são as
diferenças com relação à glicose, manose e galactose se dão em apenas um átomo de carbono,
que tem (OH) voltado pra direita ou esquerda. Então eu posso dizer que a manose é epímero
da glicose no carbono 2, e a galactose é um epímero da glicose no carbono 4. Sempre se
nomeia o átomo de carbono em que há os epímeros.
Parte 2
Transcrita por Mariana Guerra
Então isso é certo. Vocês estão vendo, no caso, novamente a glicose, seis carbonos, um com o
grupo funcional aldeído lá em cima e a hidroxila do carbono 5. Quando isso forma a estrutura
cíclica, há uma tendência de que a hidroxila do carbono 5 se aproxime do grupamento
aldeído. No que há essa aproximação, forma-se esse anel o acetal que é produzido, na
realidade, pela formação desse anel e liberação de água. Então essa formação, desse anel,
pode surgir de duas maneiras: o carbono aldeído vai passar a ter uma nova hidroxila. Vejam
que ele tinha um grupamento =O do aldeído e passa agora a ter uma hidroxila. Na hora que
surge um novo centro de assimetria desse carbono que antes não era assimétrico, essa
hidroxila pode ficar abaixo ou acima do plano. Se ficar abaixo, nós chamamos esse
monômero de alfa D- glicose, se ficar acima, nós chamamos de beta D-glicose. Então, alfa e
beta são isômeros, mas é uma isomeria feita, exclusivamente, em estruturas cíclicas de
monossacarídeos. Só monossacarídeos apresentam esse tipo de isomeria, que nós chamamos
de Anômeros. Anômeros são esse dois tipos de estruturas que são isoméricas, mas que essa
isomeria corresponde ao carbono aldeído do anel. Então, é importante dizer pra vocês é que
essa ligação aqui é feita quando o composto está em solução aquosa, porque...... e também em
solução aquosa, essa ponte de oxigênio é bastante instável, então, constantemente, ela abre e
fecha. Isso quer dizer que você tem...., passa sempre, quando você coloca em solução aquosa,
mesmo que você tenha uma alfa D-glicose, ela abre, de vez em quando abre e fecha, quando
ela fecha pode formar o beta ou a alfa, de novo. Então, isso de abrir e fechar é o que
chamamos de mutarrotação, porque muda a rotação em torno do carbono, a hidroxila vai pra
cima e pra baixo. È uma propriedade que os monossacarídeos tem em solução aquosa, que
pode forma a beta a partir da alfa e alfa a partir da beta. Vamos terminar aqui.... Quando há a
rotação, a hidroxila do carbono alfa anomérico está abaixo, o beta, a hidroxila está acima do
plano, e, vocês terão a capacidade de, em solução aquosa, mudar de uma estrutura para
outra...... até chegar ao ponto de equilíbrio. Essas estruturas de seis lados que vocês tem aí é
chamada piranocíclica Porque ela se assemelha ao pirano que é uma estrutura da química
orgânica que tem seis lados. Essas estruturas que têm seis lados, nos monossacarídeos são
chamadas de piranocíclicas. Então você pode chamar isso, por isso que tem aqui, alfa porque
a hidroxila tá abaixo, D porqe produz.... D, gli porque é da glicose, piranose porque a
estrutura tem seis lados. Quando eles chamam piranose é pra chamar dupla-anel. Alguém
pergunta alguma coisa que não deu pra entender nada e ela responde( também não deu pra
entender). Então a única diferença é que muda.......Como isso daqui, essa ligação, é instável,
tanto faz essa como essa, a ............quando ela abre, ela....... Aí quando você tem a forma
aberta, você pode ter um isômero ou outro, todas duas ficam constantemente abrindo,
fechando. Bem, aqui eu tenho o pirano A estrutura cíclica de seis lados e tem o furano que são
as estruturas circulares. Então quando nós temos centoses do tipo frutose, a frutose em vez de
ter o grupamento aldeído no carbono 1, o grupamento funcional vai estar no carbono 2. então
como ela tá no carbono 2 com o carbono cinco ele tem um carbono a menos então vai ter
cinco lados. Da mesma forma, quando o grupo cetônico desaparece e dá origem à esse
carbono anomérico, a hidroxila pode ficar abaixo ou acima do plano. Mais uma coisa, nas
estruturas piranocíclicas é muito fácil você reconhecer o carbono anomérico, basta você olhar
o oxigênio sempre é escrito........ do lado direito, então naquele vértice ali contém o carbono
anomérico. Estruturas furanocíclicas, como frutose, você tem o grupo carboxila naquele
último carbono de número 6 que fica do lado de fora, então vocês tem que prestar atenção
onde está a hidroxila. O carbono anomérico é o que contém hidroxila.
Neste caso, o carbono anomérico é o carbono 2 porque é uma cetose e como ela provém da
estrutura do furano, o anel é semelhante, então a gente chama isso de alfa porque ta abaixo,
porque provém da D-frutose.......Outra coisa que encontramos, quando vocês tiverem a forma
aberta, o que tiver do lado direito a hidroxila fica pra baixo e o que tiver do lado esquerdo a
hidroxila fica pra cima, no carbono 3. No carbono 2 e no quatro a hidroxila fica pra baixo.
Não tem nada a ver com alfa e beta. Agora no carbono anomérico, abaixo é alfa e pra cima é
beta. Esses derivados, tá muito miudinho, mas nós vamos ver bastante eles. Eles são
derivados da frutose, glicose, galactose, nós vamos conviver muito com eles na parte do
metabolismo. Uma enzima aqui, tem uma família de derivados de beta D-glicose, a beta Dglicose fosforilada, o que isso é:Toda vez que um monossacarídeo entrar na célula, a forma
que nós temos de prender esse monossacarídeo é fosforilar ele. Então essas formas que tem na
posição seis fosfato. Existe uma enzima que fosforila todas as cetoses que entram na célula.
Os derivados fosforilados são muito importantes para a célula. Aqui eu tenho derivados
aminases, aminas. Essas aminas, normalmente na posição 2. A grande maioria dos
grupamentos amina, uma vez colocados nos monossacarídeos, ligam os radicais acetil, e é
isso que vocês tem aqui N-acetil-glicosamina, aqui é a glicosamina e aqui é ela acetilada. É
um derivado importante. A glicose, frutose e galactose acetiladas são encontradas em diversos
polissacarídeos que serão estudados como o ácido hialurônico, a heparina.....
Parte 3
Transcrita por Camila Lira
... Manose, por exemplo, ela faz parte de praticamente, eu acho que todas, todas as
glicoproteínas que são que são N-oligossacarídeos, ou seja, tem oligossacarídeos ligados a
função N da asparagina - ao radical da asparagina. Então quando você tem (???)de manose,
tem muita manose, tanto que se define “high manose” em complexoz etc, mas sempre a parte
fundamental do polissacarídeo é sempre uma estrutura cheia de manose, e daí podem ser
colocados outros monossacarídeos.
Bem aqui vocês têm o quê? A galactosamina, a manosamina, que forma-?- as
aminases, que eu já expliquei aqui, aqui a fucose e ramnose. Notem o que apareceu aqui. No
fuscose vocês tem, aqui o carbono, carbono 1, 2, 3, 4 e 5; não tem o carbono 6. E tem um
derivado aqui, um grupo metil; então esses deoxiaçúcares tira a hidroxila de um dos carbonos
(????????????????) e tem outros tipos, que é o que tem ali.
Aqui já muda um pouquinho também, os polissacarídeos estruturais tem muitas
estruturas. O glucoronato, quando vocês tem grupamentos aldeídos primários de carbonos 6
sendo oxidado a ácido. Grupamentos (?) que é também um aldeído sendo oxidado a ácido.
Aqui você já tem uma outra forma (???????????????????)
E aqui, lembram que eu a pouco eu tinha falado pra vocês, quando eu falei de
glicoproteínas eu disse: olha, a glicoproteína no sangue ficam protegidas porque as
terminações carboidráticas ligam ao ácido siálico. É esse daqui: ácido N acetilneuramínico.
Esse composto daqui é quem protege da degradação as nossas proteínas quando estão na
circulação. Quando elas começam a envelhecer, a serem oxidadas etc, as enzimas retiram essa
proteção final dos resíduos de carboidratos das cadeias e no que retiram, as glicoproteínas da
circulação são capturadas pelos tecidos, pelas (?) dos tecidos, e são internalizadas e
eliminadas. Então é uma maneira de a gente repor sempre as moléculas velhas, por novas
moléculas sem sobrecarregar o (?) sempre mantendo um certo equilíbrio.
Então os principais é o ácido siálico, que eu queria que vocês olhassem, mais
derivados. A gente vai voltar a isso apenas lembrem que os principais derivados são aqueles
derivados que eu falei, os fosforilados, aminados, n acetilados, os (??)... o ácido siálico ser
ácido terminal.
Ela fala alguma coisa sobre o esquema e sobre depois a gente olhar no livro
(?????????????????????????????????????????????????)
Aqui é a redução dos monossacarídeos. Essa redução de monossacarídeos, vocês
podem ver aqui. No caso da glicose passando pra gluconato, que é a oxidação do aldeído. Isso
daqui cria uma redução-oxidação. Uma redução pra cá, e uma oxidação, porque você ta
oxidando o aldeído a um ácido carboxilílico. Então o inverso também é verdadeiro porque a
gente pode pegar um ácido e reduzir a um aldeído. Lá em cima você tem a glicose. Então a
forma quando é oxidada, você tem que ter a forma aberta. Então essa glicose pode esta em
equilíbrio, mas na hora que você forma o derivado aqui, o grupamento carboxílico você não
tem aquela forma de hemiacetal, tem uma estrutura mais ou menos aberta. No aldeído,
quando isso ocorre a nível do carbono 6, no carbono 6 a oxidação permanece com a estrutura
cíclica, não tem problema nenhum. O que perturba é se tirar o aldeído daí, porque aí aquela
ponte de hemiacetal é desfeita.
Uma outra reação importante aqui. Formação de ligação glicosídica. O que é que nós
temos na ligação glicosídica? Ligação glicosídica é uma ligação que forma os oligo e os
polissacarídeos. Então quando nós vamos formar oligo ou polissacarídeos, essa ligação entre
um monossacarídeo e outro é feita através da chamada ligação glicosídica, que ocorre com
uma eliminação de água. Então se você tem duas hidroxilas próximas, não é obrigatória que
seja carbono 1 com outro carbono. Às vezes é o carbono 4 com o carbono 3, com carbono 2 ...
vai depender muito. Mas uma grande maioria, principalmente, nos dissacarídeos, quem ta
envolvido na ligação é sempre o carbono anomérico de uma das unidades pelo menos ta
envolvido na ligação. Então nesse caso, eu tenho duas moléculas exatamente iguais de β- Dglicose e essas duas moléculas, aqueles 2 hidroxilas no C1 dessa unidade da esquerda, com o
C4 da unidade da direita, elas vão eliminar água, fazendo uma ligação através de uma ponte
de oxigênio, que nós chamamos de ligação glicosídica. Então essa ligação glicosídica é feita
entre C1 e C4. E ai a gente diz ligação glicosídica β 1- 4, ou α 1-4 Aí...É α ? É α! Ai nesse
caso é α ta vendo, porque o C1 está com a hidroxila pra baixo, então a ligação glicosídica é α,
pra saber a posição da hidroxila, 1-4. Se fosse acima essa ponte deveria sair daqui. Como o
C4 é fixo na glicose, é sempre abaixo, porque ta à direita. Então geralmente a gente sempre
mostra dessa maneira: ligando a ponta superior, com a posição 4. Certo, então, α e β ta
referindo somente a posição da hidroxila do C1 que forma a ligação glicosídica. Nesse caso
aqui é α 1-4, ligação glicosídica. E esse composto resultante aqui é que você escreve
“maltose”, um dissacarídeo. Essa maltose é encontrada no malte, e vocês poderiam ler isso
aqui como sendo α-D-glicopiranosil-[radical](1-4)[ligação]-D-glicopiranose. Seria o nome
correto do dissacarídeo.
Se a gente hidrolisar essa ligação... então se nós colocarmos água aí, então essa água
irá romper essa ligação. Quase sempre a gente faz isso quanto ao estômago ligeiramente
ácido, facilita. Então soluções ácidas elas quebram ligações glicosídicas. E é uma forma que a
gente tem de hidrolisar e estudar os monossacarídeos constituintes de qualquer polissacarídeo
que a gente escolhe. Então a gente faz a hidrólise ácida obtendo os monossacarídeos e estuda
quem são eles. Porque nem sempre vai ser glicose e galactose, às vezes vai ser uma ponte
vegetal de monossacarídeos completamente diferentes. Então a gente tem que investigar, faz
isso por HPLC – uma cromatografia de alta resolução.
Bem, aí é a abreviação dos monossacarídeos: Frutose-Fru, Fucose- Fuc, GalactoseGal, Glicose- Glc, Manose- Man, e assim por diante. Então olhem somente os principais. Nacetilgalactosamina –GalNAc e N acetilglucosamina são importantes. Galactosamina, acido
glucurônico, ácido N acetilneuramínico. São nomes que a gente pode vir a usar. (Ela fala um
monte de coisas ,mas, por causo do barulho, as palavras ficaram se nexo. Então eu só
consegui tirar o essencial)
Bem, nós vamos agora identificar aquilo que eu a pouco tinha dito. A lactose, que é
aquele dissacarídeo lá de cima, que tipo de ligação glicosídica ela tem? O C1, da galactose...
por que eu to dizendo que aquilo é galactose? Vejam que aqui no C4 a glicose tem a hidroxila
pra baixo. Quando a hidroxila tiver pra cima é galactose, é o primeiro composto lá de cima da
direita pra esquerda. Quando o C4 tiver com a OH pra cima é galactose. Então ali é a
galactose. O C1 da galactose ta na posição β. E ai ta mostrando, saindo a ligação de cima
mostrando que é β, e ligando com a glicose cuja OH do C4 ta pra baixo. Então por isso que
você tem essa ligação: β 1-4 então β-D- galactopiranosil-(1-4)- β-D-glicopiranose.
A sacarose... Bem a sacarose é importante porque tem uma característica única. Todo
açúcar que tem uma função aldeído ou uma cetona livre ele é dito um redutor. Qualquer um.
Então todos os monossacarídeos eles são redutores, ou seja, eles têm capacidade de reduzir
determinados tipos de compostos (?????????). No laboratório você vê algumas reações
colorimétricas ocorrem graças a presença carboidratos redutores. Então um carboidrato
redutor todo monossacarídeo tem. (?????) No caso dos dissacarídeos a grande maioria deles
tem uma função livre. No caso da lactose tem (?????). Mas no caso da sacarose não. Por quê?
Porque a sacarose é formada de glicose e frutose. Só que a glicose é uma aldoexose, a
frutose(ela fala “sacarose é uma cetoexose” mas eu acho que ele se enganou aí e na verdade
é frutose) é uma cetoexose. Então o C1, da aldoexose, que é o carbono do aldeído, e o C2 da
frutose, eles estão participando da ligação. Então, nesse caso, você não tem como mostrar que
não teve (?????????). A glicose está na posição normalmente conhecida da gente com o C1 do
lado direito. Mas o C2 da cetose, que anteriormente eu havia mostrado a vocês também do
lado direito, veja que o C2 aqui foi rebatido, pra esse lado de cá. Então essa ligação é β -Dglicopiranosil- α-D-glicopiranose.
Então dá a impressão que esse daqui é α, mas não, é beta. Por que a estrutura aqui ta
rebatida. Mas eu acho, não sei se vocês concordam, que ele devia ter rebatido ao contrário.
(??????) Quando eu mostrei essa estrutura da frutose, eu mostrei pra vocês a OH do C2 e do
carbono anomérico do lado direito. Então eu acho que se você simplesmente rebate, na minha
opinão, fica, α aqui e β lá. Mas nos livros eles botam, eu acho que se você torcesse aqui, ou ao
contrário, sei lá, eu acho que a β passaria a ser α e ai invertia. E não como ele mostra aqui.
Mas enfim, pode ser erro de visão espacial meu. Eles mostram sempre dessa maneira aqui.
Então é α por parte da glicose, β por parte da frutose. Ligação α-β 1-2. 1 carbono da aldose e
2 carbono da cetose. Então esse dissacarídeo não é redutor, porque não tem nem grupo cetona
nem aldeído livre. E ai ele não tem poder de redução.
No caso da trealose, esse açúcar é encontrado na Escherichia coli. Esse açúcar é dito
não redutor também porque são duas unidade glicoses unidades através de carbonos α.