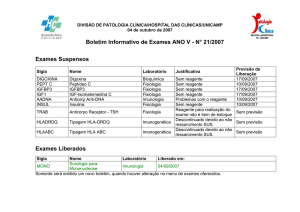
Reagentes limitantes e
rendimento da reação
Química Fundamental II
Prof. Edson Nossol
Uberlândia, 10/09/2015
Reagente limitante: sua quantia determina, ou limita, a quantia de
produto formado
é consumido em primeiro lugar em uma reação
Reagente em excesso: presente em quantidade superior àquela
necessária para reagir com dada quantidade do reagente limitante
16 pneus
em excesso
8 chassis
48 pneus
8 carros
Exemplo: Oxidação da amômia catalizada pela platina: produção de HNO3
NH3(g) + O2(g) → NO(g) + H2O(g)
Suponha que exatamente 750 g de NH3 sejam misturados com 750 g de
O2. Quanto NO pode ser formado se a reação se completar? E quanto
do reagente em excesso irá sobrar?
Exercício: O metanol, CH3OH, usado como combustível, pode ser
produzido pela reação de monóxido de carbono com hidrogênio.
CO(g) + H2(g) → CH3OH(l)
Suponha que 356 g de CO sejam misturadas com 65 g de H2. (a) Qual é
o reagente limitante? (b) Qual é a massa de metanol que pode ser
produzida? (c) Qual é a massa de reagente em excesso que sobra
quando todo o reagente limitante é consumido?
Exercício: A reação térmica que produz ferro metálico e óxido de
alumínio a partir de uma mistura de alumínio em pó e óxido de ferro(III)
é a seguinte:
Fe2O3(s) + Al(s) → Fe(s) + Al2O3(s)
Usa-se uma mistura de 50 g de cada um dos reagentes. (a) Qual é
o reagente limitante? (b) Qual é a massa de ferro que pode ser
produzida? (c) Qual é a massa de reagente em excesso que sobra
quando todo o reagente limitante é consumido?
(a) Fe2O3 (b) 35,0 g (c) 33,1 g
Rendimentos teórico e percentual
reagentes
produto
principal
subproduto
dificuldade de separação
Rendimentos teórico e percentual
• A quantidade de produto prevista a partir da estequiometria
considerando os reagentes limitantes é chamada de rendimento
teórico.
• O rendimento percentual relaciona o rendimento real (a
quantidade de material recuperada no laboratório) ao rendimento
teórico:
Rendimentos teórico e percentual
• Exemplo: O titânio é um metal forte e leve, resistente à corrosão, e
é usado na construção de foguetes, aviões, motores a jato e aros
de bicicletas. É preparado pela reação do cloreto de titânio(IV)
com o magnésio fundido, entre 950 °C e 1150 °C:
TiCl4(g) + Mg(l) → Ti(s) + MgCl2(l)
Em uma certa operação industrial efetuou-se a reação de 3,54 x 107 g
de TiCl4 com 1,13 X 107 g de Mg. (a) Determine o rendimento teórico
para obtenção de Ti. (b) Calcule a porcentagem de rendimento para o
caso de serem efetivamente obtidos 7,91 X 106 g de Ti.
Rendimentos teórico e percentual
• Exercício: O processo industrial de produção do vanádio metálico
usado em ligas de aço baseia-se na reação do óxido de vanádio(V)
com cálcio a altas temperaturas:
Ca + V2O5 → CaO + V
Em determinado processo 1,54 X 103 g de V2O5 reagem com 1,96 X 103
g de Ca. (a) Calcule o rendimento teórico para o produto V. (b) Calcule
a porcentagem de rendimento no caso de serem obtidos 803 g de V.
Reações sequenciais
• Exemplo: Em altas temperaturas, o carbono reage com água para
produzir uma mistura de monóxido de carbono, CO, e hidrogênio
H2:
∆
C + H2O → CO + H2
O monóxido de carbono é então isolado do H2 e usado para separar o
níquel do cobalto para formação de um composto organometálico, o
tetracarbonilníquel(0), Ni(CO)4:
CO + Ni → Ni(CO)4
Qual a massa de Ni(CO)4 pode ser obtida através da geração de CO
utilizando 75,0 g de carbono? Assuma 100% rendimento.
Reações sequenciais
• Exercício: Ácido fosfórico, H3PO4, é um composto muito
importante usado na produção de fertilizantes. Ele também está
presente nos refrigerantes de cola. O H3PO4 pode ser preparado
através de um processo que envolve duas etapas:
P4 + O2 → P4O10
P4O10 + H2O → H3PO4
Tendo um total de 272 g de fósforo para reagir com oxigênio em
excesso, temos a formação de pentóxido de fósforo, P4O10, com
rendimento de 89,5%. Na reação envolvendo a segunda etapa, um
rendimento de 96,8% de H3PO4 é alcançado. Qual a massa de H3PO4 é
obtida?