Química e Física dos Materiais II
Ano lectivo 2013/2014
Materiais proteicos
Departamento de Química e Bioquímica
Materiais proteicos
Os materiais de origem proteica encontram-se nos museus e galerias
de arte por todo o lado, uma vez que, em geral, estão presentes em
todos os objectos de origem animal.
São os constituintes de materiais aparentemente muito diversos como
a esponja, o osso e o marfim, a seda, a lã e o cabelo , o cabedal e o
pergaminho.
Embora possam apresentar aspectos muito diversos os materiais
proteicos são formadas a partir de um pequeno conjunto de
compostos químicos ligados uns aos outros e que são os aminoácidos.
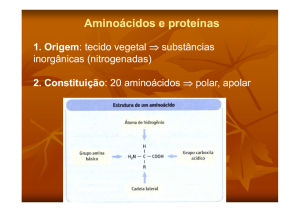
Amino-ácidos
Um aminoácido é uma molécula orgânica
formada por átomos de carbono, hidrogénio,
oxigénio e azoto, unidos entre sí de maneira
característica.
Alguns aminoácidos também podem conter
átomos de enxofre.
Os aminoácidos são divididos em quatro
partes: o grupo amina (NH2), grupo ácido
carboxílico (COOH), o átomo de hidrogénio
da posição alfa e um radical característico de
cada aminoácido, ligados ao mesmo átomo
de carbono, o chamado carbono α (alfa).
Os aminoácidos têm esterioisomeria
Em todos os aminoácidos, excepto a glicina, o carbono
alfa é assimétrico, o que lhes confere a atividade
óptica, ou seja, as suas soluções têm a capacidade de
desviar o plano de polarização quando um feixe de luz
polarizada passa através deles. Se o desvio do plano de
polarização é para a direita (sentido horário), o
composto é chamado de dextrógiro, enquanto que se
desvia para o sentido anti-horário (para a esquerda ) é
chamado de levógiro.
Um aminoácido pode, em princípio, existir nas duas
formas enantiomérico (uma dextro e a outra levo), mas
na natureza encontra-se apenas uma delas.
Estruturalmente, cada aminoácido pode apresentar as
duas formas possíveis (os dois enantiómeros)
desigados por configuração D ou configuração L,
dependendo da orientação relativa no espaço dos 4
grupos diferentes ligados ao carbono alfa. Todos os
aminoácidos naturais têm a forma L
L- gliceraldeído
Aminoácidos naturais
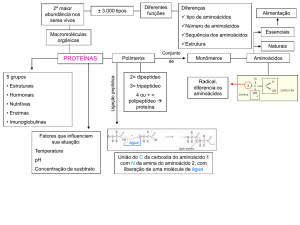
Ligação peptídica
Uma ligação peptídica é uma ligação química que ocorre entre duas
moléculas, em que o grupo carboxilo de uma molécula reage com o
grupo amina de outra molécula, com formação de uma molécula de água
( H2O ).
Uma ligação peptídica pode ser quebrada por hidrólise ( adição de água ).
Péptidos e proteínas
Uma cadeia de aminoácidos designa-se por péptido. Estas podem ser
formadas por dois aminoácidos (dipeptídos), três aminoácidos (tripeptídos),
quatro aminoácidos (tetrapeptídos), ou muitos aminoácidos (polipeptídos). O
termo proteína é utilizado quando o polipeptído é formado por centenas ou
milhares de aminoácidos.
A maioria das proteínas dobra-se (enrola-se) em 3 únicas estruturas
tridimensionais. A forma em que uma proteína se enrola naturalmente é conhecida
como a sua conformação nativa. Esta é dependente do tipo de aminoácidos que
possui, do tamanho da cadeia e da configuração espacial da cadeia polipeptídica.
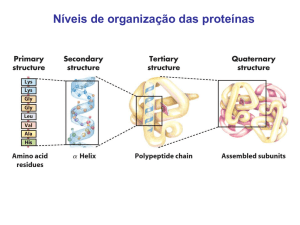
São definidas as seguintes estruturas:
Estrutura primária - É dada pela sequência de
aminoácidos ao longo da cadeia polipeptídica.
É o nível estrutural mais simples e mais
importante, pois todo o arranjo espacial da
molécula é sua consequência. É específica
para cada proteína. É formada por uma longa
cadeia de aminoácidos, com uma extremidade
terminal amina e outra extremidade
carboxilato. É resultante apenas das ligações
peptídicas.
Em proteínas, a estrutura secundária é consequência das ligações de
hidrogénio entre o grupo amida do esqueleto peptidico e os grupos carboxilo .
Um motivo comum na estrutura secundária de
proteínas é a alfa-hélice (α-hélice) que é uma
conformação em que a cadeia peptídica se encontra
enrolada em espiral, e em que cada grupo NH doa uma
ligação de hidrogénio para o grupo C = O do
aminoácido.
A folha pregueada, ou configuração beta, é uma
estrutura achatada e rígida, também formada por
pontes de hidrogénio entre as unidades peptídicas.
Neste caso, as ligações esbelecem-se entre cadeias
polipeptídicas diferentes, distendidas e paralelas, ou
entre segmentos distantes e distendidos de uma
mesma cadeia. As pontes de hidrogénio são
perpendiculares ao eixo das cadeias, e os grupos R dos
aminoácidos projetam-se para cima e para baixo do
plano da folha pregueada. Quando o número de
cadeias associadas é grande, resulta uma estrutura
flexível, mas não elástica.
A estrutura terciária resulta do enrolamento da hélice ou da
folha pregueada, sendo estabilizada por pontes de hidrogénio
e pontes dissulfureto. Esta estrutura confere a actividade
biológica às proteínas.
A estrutura terciária descreve o enrolamento final de uma
cadeia, por interações de regiões com estrutura regular ou de
regiões sem estrutura definida, podendo haver interacções de
segmentos distantes de estrutura primária, por meio de
ligações não covalentes.
Ao contrário da estrutura secundária que é determinada pelo
relacionamento estrutural de curta distância, a estrutura
terciária é caracterizada pelas interações de longa distância
entre aminoácidos, Cria interações locais entre os
aminoácidos que ficam próximos uns dos outros.
mioglobina
A estrutura quaternária de algumas proteínas resulta
de estas terem duas ou mais cadeias polipeptídicas. É
devida ao mesmo tipo de interações que deram origem
à estrutura terciária.
hemoglobina
Resumo das estruturas tridimensionais das proteínas
Alteração das proteínas
Quando as proteínas se encontram sob a sua forma natural activa, designamse por proteínas nativas.
A desnaturação corresponde à perda da estrutura nativa devido à acção de
vários agentes (calor, ácidos ou bases, oxidantes, redutores, solventes,
detergentes, agitação, etc.). Este processo pode ocorrer numa extensão
variável.
A desnaturação destrói as estruturas secundária, terciária e quaternária.
A estrutura primária mantém-se.
Desnaturação da clara do ovo por acção
do calor
Bibliografia
Mills, J. S.; White R., The
Organic Chemistry of Museum
Objects, Butterworth and Co,
London (1987).
Solomons, G.; Fryhle, C.,
Organic Chemistry, 7.a edição,
Wiley, New York (2000)
Nota: todas as imagens foram
retiradas da wikipedia