CURSINHO ETWB 2012
Componente Curricular: Química
Professora: Ricardo Honda
Data: Terça-feira, 06/03/2012
Tema da aula: Funções inorgânicas
“As substâncias compostas são agrupadas de acordo com suas propriedades químicas. Ácidos, bases, sais e
óxidos podem ser classificados de acordo com sua solubilidade na água. Esse critério determina a classificação
das substâncias em eletrólitos (soluções condutoras de eletricidade) e não eletrólitos (soluções não condutoras de
eletricidade)”.
Dissociação x Ionização
Trabalhando na Universidade de Uppsala (Suécia), Arrhenius realizou numerosas experiências
relacionadas com a passagem de corrente elétrica através de soluções aquosas e, com base nessas experiências,
formulou a hipótese de que tais soluções deveriam conter partículas carregadas: os íons. A partir disso, ele
estabeleceu a teoria da dissociação iônica, que lhe possibilitou, em 1903, a conquista do Prêmio Nobel.
De acordo com Arrhenius, determinadas substâncias, quando dissolvidas em água, são capazes de dar
origem a íons positivos, os cátions, e a íons negativos, os ânions.
Inicialmente, ele testou a condutividade elétrica dos compostos iônicos, utilizando duas soluções aquosas:
uma de sal de cozinha (NaCl) e outra de soda cáustica (NaOH). Arrhenius constatou a passagem de corrente
elétrica em ambos os casos e associou esse fato à existência de íons livres nas soluções. A esse fenômeno
denominou dissociação iônica.
Veja, por exemplo, como ocorre a dissociação iônica do NaCl em água.
A água é uma substância formada por moléculas polares, cujo polo negativo está situado no átomo de
oxigênio e o polo positivo, nos átomos de hidrogênio.
O resultado dessas interações será a
obtenção de uma solução iônica. As moléculas
de água que envolvem os íons são
denominadas água de solvatação.
A equação que representa esse fenômeno pode ser dada por:
Ao testar a condutividade de substâncias moleculares, como o açúcar (C12H22O11) e o ácido clorídrico
(HCl) em solução aquosa, Arrhenius observou os seguintes fatos:
Como a solução aquosa de açúcar não conduz corrente elétrica, ele concluiu que nessa solução não
existem íons. Nesse caso, o açúcar somente se dissolveu na água.
A condução de corrente elétrica pela solução aquosa de ácido clorídrico levou-o a concluir que nela
existem íons livres. Como o HCl é um composto formado por moléculas, os íons devem ter sido formados
mediante a quebra dessas moléculas pela água.
Esse fenômeno é denominado ionização e pode ser representado pelas equações:
Aula 9
Página 1
Na verdade, essas equações são uma representação simplificada. O fenômeno da ionização ocorre, de
fato, através da reação entre as moléculas de HCl e de H2O.
Normalmente, omitimos a participação da água como reagente ao escrevermos uma equação de
ionização.
IMPORTANTE
A função da água na dissociação iônica consiste na separação dos íons já existentes no aglomerado
iônico (retículo cristalino). No fenômeno de ionização, a água atua como reagente, constituindo-se no fator
determinante para a formação de íons.
Resumindo:
Conceito de ácido, base e sal pela teoria de Arrhenius
Estudos posteriores levaram Arrhenius a identificar os íons presentes nessas soluções; a partir daí, ele
elaborou as seguintes definições:
+
Ácidos são substâncias que, em solução aquosa, sofrem ionização liberando como cátions somente H :
Bases ou hidróxidos são substâncias que, em solução aquosa, sofrem dissociação iônica liberando como único
tipo de ânion os íons OH (hidroxila):
Os hidróxidos dos metais são compostos iônicos e, em solução aquosa, sofrem dissociação iônica.
Observação:
O hidróxido de amônio (NH4OH), que não é um hidróxido de metal, resulta da ionização em água da amônia
(NH3), que é um composto molecular.
Sal é toda substância que, em solução aquosa, sofre dissociação, produzindo pelo menos um cátion diferente do
+
H e pelo menos um ânion diferente do OH :
Utilizando esses conceitos, podemos relacionar, de maneira genérica, a capacidade de conduzir corrente
elétrica das substâncias iônicas e moleculares. Observe o quadro a seguir:
Os óxidos e o ambiente
Efeito estufa
A Terra recebe constantemente energia do Sol, principalmente na forma de luz ou radiações visíveis.
Parte dela é absorvida pela superfície terrestre, enquanto outra parte é refletida pela própria superfície, na forma
de radiações infravermelhas (não visíveis). Uma quantidade dessas radiações infravermelhas, por sua vez, é
absorvida pela atmosfera, e o restante é emitido de volta para o espaço.
Aula 9
Página 2
Essa distribuição da energia solar é natural e permite que a superfície da Terra apresente temperatura
média de 15 ºC. Qualquer alteração na quantidade
de energia envolvida nesse processo acarretará
mudanças no nosso clima. O gás carbônico (CO2),
presente no ar, tem a propriedade de absorver
radiações infravermelhas. Ele age como um
“cobertor” e evita que essas radiações escapem
para o espaço.
No entanto, a concentração de CO2 na
atmosfera tem aumentado de maneira significativa
e, segundo previsões científicas, ela pode dobrar
nos próximos anos. Esse aumento afetaria o clima
do mundo, podendo provocar o derretimento do
gelo das calotas polares e elevar o nível dos
oceanos de 5 a 6 metros, o que inundaria várias
regiões costeiras e produziria um aumento de até 5
ºC na temperatura da superfície da Terra.
Dessa maneira, pode-se concluir que, quanto maior for a concentração de CO2 na atmosfera, maior será a
absorção de energia de radiações infravermelhas, o que acarretará maior aquecimento da Terra e aumento
descontrolado do efeito estufa.
É importante ressaltar que outros gases, como o CH4, o CFC e o N2O, encontrados na atmosfera, também
contribuem para o efeito estufa; porém, o CO2 é o principal responsável, contribuindo aproximadamente com 55%
deste fenômeno.
Chuva ácida
O termo chuva ácida foi usado pela primeira vez para descrever a precipitação ácida que ocorreu sobre a
cidade de Manchester, no início da Revolução Industrial.
As chuvas ácidas são de três tipos e ocorrem em ambientes diferentes.
• Em ambientes não poluídos e na ausência de relâmpagos – essa chuva é formada pela reação do gás carbônico
(CO2) com a água, que origina o ácido carbônico (H2CO3):
CO2 (g) + H2O (l) → H2CO3 (aq)
Como o CO2 está presente na atmosfera, toda chuva é ligeiramente ácida; porém, este tipo de chuva não
é considerado nocivo.
• Em ambientes com relâmpagos ou grande quantidade de veículos dotados de motor de explosão – nessas
condições, o nitrogênio (N2) reage com o oxigênio (O2), formando os óxidos de nitrogênio (NOx), principalmente o
NO2:
N2 + 2 O2 → 2 NO2
Os óxidos de nitrogênio (NOx) reagem com a água da chuva e originam um tipo de chuva ácida capaz de
provocar grande impacto ambiental. Uma reação que certamente ocorre pode ser representada por:
2 NO2 (g) + H2O (l) → HNO2 (aq) + HNO3 (aq)
Em ambientes poluídos — a partir da combustão de derivados do petróleo, que contêm enxofre como
impureza, forma-se o SO2, que se transforma parcialmente em SO3:
S + O2 → SO2
SO2 + ½ O2 → SO3
Esses óxidos dissolvem-se e reagem com a água da chuva, formando ácidos que também causam sérios
problemas ambientais:
O trióxido de enxofre (SO3) também é
produzido na queima do carvão usado em
usinas termoelétricas.
Essas chuvas ácidas podem cair em
áreas afastadas dos centros urbanos, que não
suportam acidez elevada, provocando sérios
problemas ao meio ambiente.
Aula 9
Página 3
EXERCÍCIOS DE CLASSE
1. (FUVEST 2012) – Observa-se que uma solução aquosa saturada de HCl libera uma substância gasosa. Uma
estudante de química procurou representar, por meio de uma figura, os tipos de partículas que predominam nas
fases aquosa e gasosa desse sistema – sem representar as partículas de água. A figura com a representação
mais adequada seria
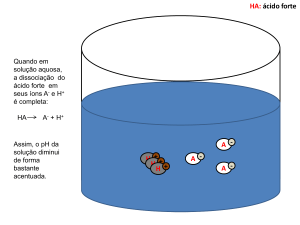
2. (FUVEST 2010) – As figuras a seguir representam, de maneira simplificada, as soluções aquosas de três
ácidos, HA, HB e HC, de mesmas concentrações. As moléculas de água não estão representadas.
Considerando essas representações, foram feitas as
seguintes afirmações sobre os ácidos:
I. HB é um ácido mais forte do que HA e HC.
II. Uma solução aquosa de HA deve apresentar maior
condutibilidade elétrica do que uma solução aquosa de
mesma concentração de HC.
III. Uma solução aquosa de HC deve apresentar pH maior do
que uma solução aquosa de mesma concentração de HB.
Está correto o que se afirma em
a) I, apenas.
b) I e II, apenas.
c) II e III, apenas.
d) I e III, apenas.
e) I, II e III.
EXERCÍCIOS COMPLEMENTARES
1. (UNICAMP) – A queima de combustíveis de origem fóssil conduz à formação de compostos derivados do
enxofre. Estes compostos são lançados na atmosfera, precipitando na forma de chuvas ácidas, fenômeno que
causa sérios danos ao meio ambiente. Escreva as equações de formação de pelo menos um destes ácidos, a
partir do enxofre.
2. (FUVEST) – Os automóveis movidos à gasolina, mesmo que utilizem uma relação ar/combustível adequada,
produzem substâncias poluentes tais como hidrocarboneto não queimado (HC), CO e NO. Atualmente, os
automóveis são equipados com catalisadores que promovem as transformações dos referidos poluentes gasosos,
conforme as seguintes equações:
2 CO + O2 → 2 CO2
2 NO + 2 CO → N2 + 2 CO2
HC + oxigênio → dióxido de carbono + água
O gráfico ao lado dá a porcentagem de poluentes
transformados (Y), em função da porcentagem de oxigênio (X)
presente na mistura do combustível com ar.
Logo, se a porcentagem de oxigênio na mistura for
I. X1, a porcentagem de HC transformado será menor que a de
CO transformado.
II. X2, a soma das quantidades de HC, CO e NO, nos gases de
escape, será menor do que aquela obtida se a porcentagem de oxigênio for X1 ou X3.
III. X3, restará menos CO, para transformar NO em N2, do que se a porcentagem de oxigênio for X1.
É, pois, correto o que se afirma
a) em I apenas.
Aula 9
b) em II apenas.
c) em III apenas.
d) em II e III apenas.
e) em I, II e III.
Página 4