Nome
Nº
Disciplina
Professor
Química 2
Regina
Natureza
Código / Tipo
Apostila
Ap/I
Série
2a
Trimestre / Ano
3o / 2008
Tema
Ensino
Turma
Médio
NOTA
Data.
31/10/08
Valor da avaliação
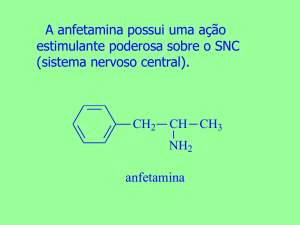
Isomeria óptica
----------
Todos os isômeros possuem propriedades físicas diferentes, tais como PF, PE e densidade,
mas os isômeros ópticos não possuem esta diferença, ou seja, as propriedades físicas dos isômeros
ópticos são as mesmas. Então o que faz eles serem diferentes? É possível diferenciá-los?
Sim, é possível diferenciá-los, mas apenas quando eles estão frente à luz polarizada.
Luz polarizada
É um conjunto de ondas eletromagnéticas que se propagam em apenas uma direção. Uma
lâmpada incandescente é um exemplo de fonte de luz não polarizada, pois a luz é emitida em todas
as direções.
É possível polarizar a luz, bastando utilizar um polarizador, que terá a função de direcionar
apenas uma direção da luz.
luz não polarizada luz polarizada
Esta seta de duas pontas, , significa a propagação da onda eletromagnética (luz polarizada) vista
de frente.
Enantiômeros, enantiomorfos, antípodas ópticos ou moléculas quirais:
são isômeros ópticos capazes de desviar a luz polarizada em um mesmo ângulo, só que em
sentidos opostos e são imagens especulares um do outro. Caso o isômero óptico provoque o giro da
luz polarizada para a direita, o enantiômero será denominado dextrógiro (D+). Se o enantiômero
provocar o giro da luz polarizada para a esquerda, o composto será denominado levógiro (L–).
O par de enantiômeros não são superponíveis pois se assemelham às mãos direita e
esquerda no seguinte aspecto : são imagens especulares uma da outra e não são sobreponíveis.
O fato de um composto provocar o "giro" da luz polarizada faz com que ele possua atividade
óptica. Atividade óptica só é possível em moléculas assimétricas, ou seja, moléculas que possuem
carbono quiral (ou estereocentro ou carbono assimétrico) que é o carbono que possui os 4
(quatro) ligantes diferentes).
O carbono quiral é marcado
com um asterísco (*). Este
carbono possui 4
ligantes diferentes.
Diasteroisômeros ou diastereômeros
são isômeros ópticos que diferem dos enantiomorfos pelo fato de desviarem a luz polarizada
em ângulos diferentes e não são imagens especulares um do outro.
Mistura racêmica
É uma mistura de isômeros ópticos, ou seja, é uma mistura de 50% de levógiro e 50% de
dextrógiro. Esse tipo de mistura é opticamente inativa por compensação externa, ou seja, a luz
polarizada não é desviada (desvio nulo), pois uma molécula (enantiomorfo) cancela o desvio da
2
outra. Somente os pares enantiomorfos podem formar misturas racêmicas entre si. Os
diastereoisômeros não formam tal mistura.
Regra de van’t Hoff
A quantidade de isômeros opticamente ativos pode ser calculada a partir da quantidade de
carbonos quirais existentes em uma molécula pela fórmula:
sempre a metade do número de isômeros ópticos ativos.
2c*.O número de misturas racêmicas é
Exemplo:
2 estereocentros ou 2 carbonos quirais
IOA =Isômero pticamente Ativo
IOA = 2c*. Para a molécula dada, temos:
IOA = 22 = 4 . A molécula apresenta 4 isômeros ópticos ativos ─ 2 dextrógiros e 2 levógiros ─ e 2
misturas racêmicas (2c*/2).
Composto Meso
Esse composto é opticamente inativo por compensação interna, isto é, um dos átomos de
carbono assimétrico da molécula cancela o desvio do plano de vibração da luz polarizada provocado
pelo outro átomo de carbono assimétrico da molécula. O composto meso ocorre em moléculas que
possuem 2 carbonos assimétricos iguais (com os mesmos ligantes mas diferentes entre si ).
Exemplo : Ácido tartárico
O
OH
OH
O
OH
C
C
C
│
│
│
OH — C
│
H — C
O
O
—H
— OH
H — C
│
OH — C
— OH
H —C
— OH
—H
│
H —C
— OH
│
│
│
C
C
C
OH
Ácido tartárico dextrógiro
– opticamente ativo
Molécula assimétrica
O
OH
Ácido tartárico levógiro –
opticamente ativo
Molécula assimétrica
3
O
OH
Ácido tartárico meso
– opticamente inativo
Molécula simétrica
O ácido tartárico forma-se durante a fabricação do vinho. Quando puro apresenta-se como
cristais incolores e transparentes, com sabor ácido e solúvel em água e álcool etílico. É utilizado na
fabricação de bebidas efervescentes, em fotografia, na indústria têxtil, como seqüestrante e
acidulante em alimentos.
Bibliografia
Livro de Química Orgânica – autor: Martha Reis, ed. FTD
Parte do texto e as figuras desta página foram produzidos por Miguel A. Medeiros e foram extraídos da página
http://www.quiprocura.net/isomeria/optica.htm
4