B)ISOMERIA ÓPTICA:
-CONCEITO E HISTÓRIA:estuda o comportamento das substâncias
quando submetidas a um feixe de luz polarizada,que pode ser obtida a
partir da luz natural(não-polarizada).
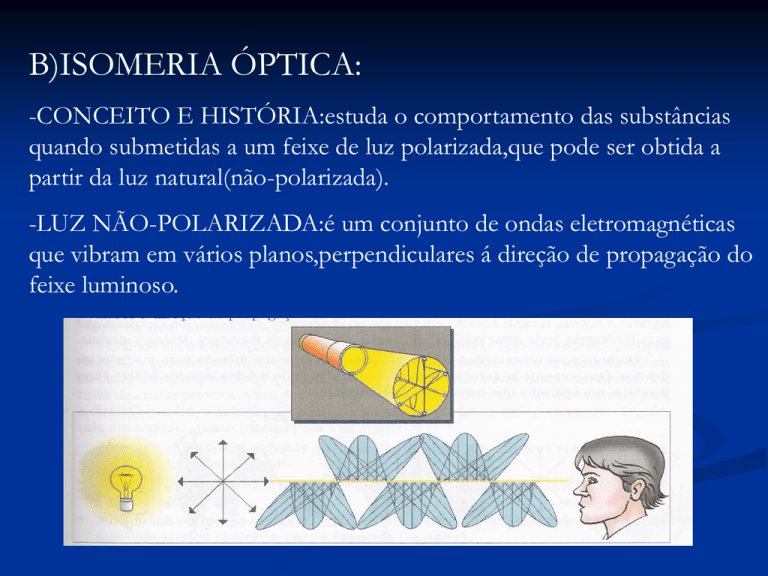
-LUZ NÃO-POLARIZADA:é um conjunto de ondas eletromagnéticas
que vibram em vários planos,perpendiculares á direção de propagação do
feixe luminoso.
-LUZ POLARIZADA:é um conjunto de ondas eletromagnéticas
que vibram ao longo de um único plano,denominado plano de
polarização.Esse tipo de luz foi descoberto em 1808 pelo físico
francês Malus,quando ele fez incindir um feixe de luz natural
sobre um cristal transparente de uma variedade do carbonato de
cálcio(espato da islândia).Essa propriedade é característica de
várias substâncias,tanto naturais quanto sintéticas,que são
denominadas polarizadores.
Em 1815,o físico francês Jean-Batiste Biot percebeu que alguns
líquidos orgânicos e algumas soluções aquosas de substâncias
orgânicas(óleos de limão,cânfora em álcool,caldo de cana
etc.)tinham a propriedade de desviar o plano de luz
polarizada(plano de polarização).Biot verificou em alguns materiais
provocavam um desvio no sentido horário e outros,no sentido antihorário em relação ao observador.Ele relacionou esse fenômeno
com a assimetria da estrutura desses materiais.
Biot não conseguiu criar um método para medir esses desvios.Mas,em
1829,o físico escocês Willian Nicol inventou um aparelho que
denominou polarímetro.Apesar de Nicol ter descoberto uma maneira
de medir o desvio sofrido,ele não conseguiu explicar por que isso
ocorria.Em 1846,,o químico francês Louis Pasteur conseguiu estabelecer
uma relação entre a assimetria estrutural e a capacidade de as substâncias
desviarem-se no plano de polarização,que ocorreu durante seus estudos
do processo de produção de vinho.
Durante o processo de fermentação do suco de uva destinado á
produção de vinho,formam-se dois ácidos que se depositam nas
paredes dos barris.Pasteur descobriu que os cristais desses ácidos
apresentavam comportamento diferente,quando submetidos á
luz polarizada.O ácido tartárico desvia a luz para a direita,sentido
horário; e o outro racêmico(do latim racemus=cacho de uvas),era
inativo,isto é ,não provoca desvio;os dois ácidos apresentam a
mesma fórmula molecular e as mesmas propriedades,mas tem
atividade ópticas diferentes.
Estudando os cristais dos sais de sódio e do amônio do ácido tartárico,Pasteur
percebeu que eles eram assimétricos,apresentando de cada lado uma face diferente;os
racêmicos também não eram simétricos,mas alguns tinham uma face diferente para a
direita e outros para a esquerda,de modo que os dois tipos se comportavam como um
par de objeto-imagem em relação ao outro.Pasteur separou cuidadosamente os dois
tipos de cristais que compunham o racêmico e dissolveu-os separadamente em
água.Analisando essas soluções,verificou que ambas eram opticamente ativas:uma
desvia para a direita e a outra para a esquerda(em mesmo ângulo).Isso concluiu que o
ácido racêmico não é uma substância pura,mas uma mistura formada por:
-50% de um tipo de ácido tartárico,que desviava o plano de polarização para a
direita(dextrógiro);
-50% de um outro tipo de ácido tartárico,que provocava um desvio de mesmo valor
para a esquerda(levogiro).
Ele percebeu que deveria existir outro motivo para explicar a atividade óptica,além da
assimetria dos cristais,pois ela continuava existindo mesmo em solução.A diferença
entre substâncias de mesma fórmula molecular,mas com atividades ópticas
diferentes,denominadas isômeros ópticos,só foi esclarecida com o modole tetraédrico
do carbono,roposto em 1874 por Le bel e Van’t Hoff.Se átomo de carbono ocupar o
centro de um tetraedro e seus vértices estiverem ocupados por quatro ligantes
diferentes,pode–se admitir a existência de duas moléculas diferentes e
assimétricas.
CONCEITO DE SIMETRIA:dizemos que uma estrutura é
simétrica quando ela apresenta pelo menos um plano de
simetria,isto é,quando pode ser dividida em duas metades
idênticas.Uma estrutura simétrica,quando colocada diante de um
espelho plano,produz uma imagem idêntica a ela.Estruturas que
não admitem nenhum plano de simetria são denominadas
assimétricas;quando colocadas diante de um espelho plano,as
estruturas assimétricas produzem imagens diferentes de si
próprias.uma característica importante dessas estruturas é que
elas não são sobreponíveis.
-ASSIMETRIA MOLECULAR E A ISOMERIA ÓPTICA:
A condição necessária para a ocorrência de isomeria óptica é que a molécula
da substância seja assimétrica.O caso mais importante de assimetria molecular
ocorre quando há,na estrutura da molécula,pelo menos um carbono
assimétrico ou quiral (do grego cheiral=mão).Um átomo de carbono é
considerado assimétrico,quando ele apresenta quatro grupos ligantes
diferentes entre si,esse fato é indicado por um asterisco(*).
A presença de um carbono assimétrico(quiral)em uma molécula garante a
existência de duas estruturas não-sobreponíveis,que correspondem a duas
substâncias denominadas isômeros ópticos.Esses isômeros têm a capacidade de
desviar o plano da luz polarizada de mesmo ângulo,mas em sentidos opostos,e
são denominados opticamente ativos.
EXEMPLO:ácido láctico,encontrado no leite azedo e nos músculos.
Esses isômeros são quimicamente e fisicamente iguais;a única
maneira de saber se um isômero óptico é dextrógiro(d) ou levogiro(l)
consiste em utilizar um polarímetro;é impossível obter tal informação
pela simples análise da fórmula estrutural do isômero.Dois isômeros
opticamente ativos [(d) e (l)],que apresentam o mesmo ângulo de
desvio,são denominados antípodas ópticos ou enantiomorfos e sua
mistura em qunatidades equimolares resulta numa mistura
opticamente inativa,denominada mistura racêmica,conhecida
também por isômero racêmico[(dl) ou (r) ].
QUANTIDADE DE CARBONOS ASSIMÉTRICOS E
NÚMERO DE ISÔMEROS ÓPTICOS
-Moléculas com um carbono quiral (C*): possui 2 isômeros
opticamente ativos(IOA) e 1 isômero opticamente inativo(IOI).
-Moléculas com vários carbonos assimétricos
diferentes:expressões matemáticas propostas por Van’t Hoff e
Le Bel.
-Moléculas com carbonos assimétricos iguais:nesses casos não podem aplicar
as expressões matemáticas de Van’t Hoff e Le Bel para determinar o seu número
de isômeros.Exemplo: àcido tartárico(2,3-dihidroxi-butanóico).
-Moléculas cíclicas:a isomeria óptica também ocorre em
compostos cíclicos,em função da assimetria molecular.Embora
nessas moléculas não existam carbonos assimétricos,para
determinar o número de isômeros deve-se considerar a sua
existência.
-Moléculas assimétricas: na maioria dos processos
biológicos,somente um dos isômeros ópticos é ativo.Por exemplo,
o isômero dextrógiro do LSD causa alucinações,ao passo que o
isômero levogiro não produz nenhum efeito.No final da década de
50,um medicamento chamado Talidomida foi prescrito como
tranqüilizante para gestantes em muitos países;ele produziu efeitos
trágicos,originando crianças sem membros ou com membros
deformados;a Talidomida apresenta isomeria óptica,e o
medicamento continha uma mistura racêmica,foi descoberto
posteriormente que o isômero(l)era o responsável por tais
deformações.Existem outros casos de isomeria óptica que
envolvem estudos particularizados das suas estruturas e que não
são considerados importantes para o nosso curso.











