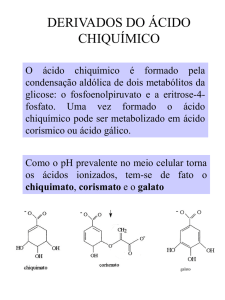
Química dos Produtos Naturais
Biossíntese dos amino-ácidos
aromáticos
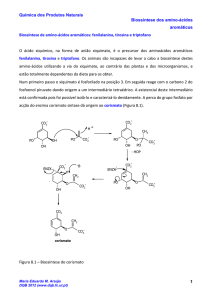
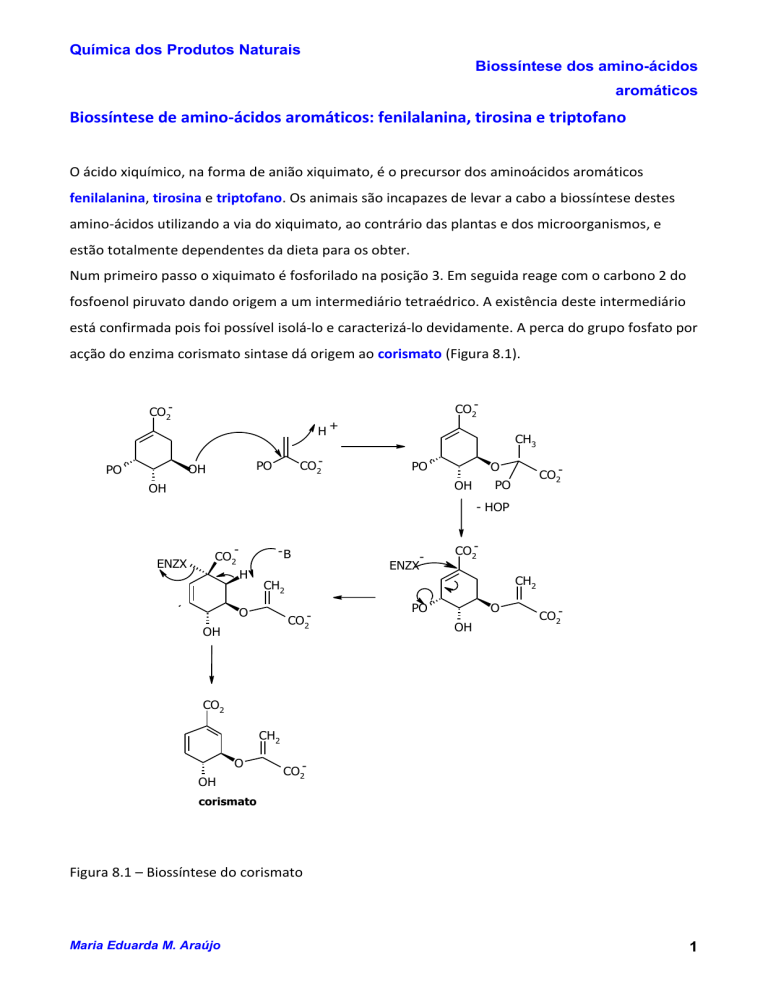
Biossíntese de amino-ácidos aromáticos: fenilalanina, tirosina e triptofano
O ácido xiquímico, na forma de anião xiquimato, é o precursor dos aminoácidos aromáticos
fenilalanina, tirosina e triptofano. Os animais são incapazes de levar a cabo a biossíntese destes
amino-ácidos utilizando a via do xiquimato, ao contrário das plantas e dos microorganismos, e
estão totalmente dependentes da dieta para os obter.
Num primeiro passo o xiquimato é fosforilado na posição 3. Em seguida reage com o carbono 2 do
fosfoenol piruvato dando origem a um intermediário tetraédrico. A existência deste intermediário
está confirmada pois foi possível isolá-lo e caracterizá-lo devidamente. A perca do grupo fosfato por
acção do enzima corismato sintase dá origem ao corismato (Figura 8.1).
CO2-
H+
CO2-
PO
OH
PO
CO2CH3
PO
O
OH
CO2-
PO
OH
- HOP
ENZX
CO2
-B
H
ENZX
-
CO2CH2
CH2
O
CO2-
OH
PO
O
OH
CO2-
CO2
CH2
O
OH
CO2-
corismato
Figura 8.1 – Biossíntese do corismato
Maria Eduarda M. Araújo
1
Química dos Produtos Naturais
Biossíntese dos amino-ácidos
aromáticos
O corismato é transformado em triptofano por adição de amónia e de ribose. O processo é
complexo e está resumidamente descrito na Figura 8.2.
CO2HO
CO2 -
antranilato
sintase
NH3
O
antranilato
fosfo-ribosil
transferase
NH2
CO2 NH
PO
O
CO2-
corismato
OH
HO
OP
OH
-CO2
antranilato
fosfo-ribosil
isomerase
O
O
-H2O
-
OH
OP
N
H
N
H
H
OH
O
OH
CO2-
N
H
H
+ NH3
triptofano
Figura 8.2 – Biossíntese do triptofano
A biossíntese dos aminoácidos fenilalanina e tirosina passa por um outro intermediário derivado
do corismato: o prefenato (Figura 8.3).
Maria Eduarda M. Araújo
2
Química dos Produtos Naturais
Biossíntese dos amino-ácidos
aromáticos
O
CO2-
CO2-
O
O
HO
CO2-
CO2-
CO2H
OH
CO2H
prefenato
OH
Figura 8.3 – Formação do prefenato
A transformação do prefenato nos dois aminoácidos fenilalanina e tirosina pode ocorrer por dois
processos diferentes: consoante o organismo em causa: é possível dar-se primeiro a reacção de
aminação seguida de redução e aromatização do anel ou então estes processos podem ocorrer pela
ordem inversa (Figura 8.4).
CO2-
CO2 -
CO2-
CO 2
H
+ NH3
prefenato
aminotransferase
O
OH
OH
prefenato
NAD+
CO2CO2O
H
+ NH
3
CO2H
piruvato
aminotransferase
+ NH
OH
3
tirosina
fenilalanina
Figura 8.4 – Biossíntese da fenilalanina e da tirosina
Maria Eduarda M. Araújo
3
Química dos Produtos Naturais
Biossíntese dos amino-ácidos
aromáticos
Formação dos derivados Aril-C3, Aril-C1 e Aril-C2
A fenilalanina e a tirosina podem sofrem em algumas espécies um desaminação estereoespecífica
com eliminação de amoníaco originando o ácido cinâmico. Este pode sofrer uma grande variedade
de transformações dando origem a uma classe de metabolitos designada por fenilpropanóides. Do
ácido cinâmico provêm também os compostos do tipo Aril-C1 e Aril-C2.
A Figura 8.5 representa de uma maneira esquemática a formação destes compostos.
Maria Eduarda M. Araújo
4
Química dos Produtos Naturais
Biossíntese dos amino-ácidos
aromáticos
O
OH
O
O
OH
oxidação
oxidação
Fenilalanina
ácido cinâmico
O
SCoA
O
HO
OH
OH
ácido p-coumárico
oxidação
O
OH
OH
ácido cafeico
redução
(OH)x
OH
OH
+ H2O
-CO2
-CoAsH
O
ácido o-coumárico
COMe
MeO
MeO
OH
O
O
coumarina
(OH)x
alcool coniferilo
OH
eugenol
outros derivados
da coumarina
Ari-C2
O
COSCoA
O
O
(OH)x
safrol
OMe
anetol
exemplos representativos
Ari-C1
Fenilpropanóides
Aril-C3
Figura 8.5 – Derivados do ácido cinâmico
Maria Eduarda M. Araújo
5