Química dos Compostos de
Coordenação
Prof. Dr. Élcio Barrak
Universidade Federal de
Itajubá
Luiggi Dell’Amore Priolli
Renan Rosa Martines
Tiago Elias Castelo de Oliveira
Yuri Lagoeiro Alvarenga
16973
16980
15985
16986
Complexos Metálicos
• Definição
• Compostos de coordenação
• Moléculas ligantes
2/21
3/21
Uso dos Compostos de Coordenação
Tornar solúveis espécies insolúveis em água
Hemoglobina e o transporte de oxigênio
EDTA e envenenamento por chumbo
Compostos de coordenação no tratamento do câncer
4/21
Teoria de Werner
5/21
6/21
Ligação Metal-Ligante
• A ligação entre um ligante e um íon metálico é
um exemplo de interação entre uma base de
Lewis e um ácido de Lewis.
• A formação das ligações metal-ligante pode
alterar profundamente as propriedades que
observamos para o íon metálico.
7/21
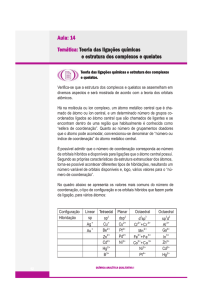
Cargas, Números de Coordenação e
Geometrias
• Carga: a carga de um complexo é a soma das
cargas do metal central e de seus ligantes
circundantes.
• Número de coordenação: é o número de átomos
diretamente ligados ao átomo metálico em um
complexo.
8/21
Ligantes com mais de um Átomo
Doador
• Ligantes monodentados: possuem um único
átomo doador e são capazes de ocupar apenas
um sítio em uma esfera de coordenação.
• Ligantes polidentados: podem ter dois ou mais
átomos doadores, podendo coordenar-se
simultaneamente a um íon metálico,
consequentemente ocupando dois ou mais sítios
de coordenação. Estes também são chamados de
agentes quelantes.
9/21
• Efeito Quelato: as constantes de formação
geralmente maiores para os ligantes
polidentados em comparação com os
monodentados é conhecida como efeito quelato.
• Os agentes quelantes são geralmente usados
para prevenir uma ou mais reações possíveis de
um íon metálico sem removê-lo da solução.
10/21
Exemplos de agentes quelantes,
“ox”, “en”, EDTA
11/21
Aplicações
• Os complexos derivados da porfina são chamados de
porfirínicos e contêm diferentes íons metálicos; e têm
diferentes grupos substituintes ligados aos átomos de
carbono na periferia dos ligantes.
• As clorofilas são porfirinas que contêm Mg(II) e são
componentes-chave na conversão de energia solar em
formas que podem ser usadas pelos organismos vivos.
• Um método de tratar envenenamento por chumbo é
administrar Na4[EDTA]. O EDTA quela-se ao chumbo,
permitindo que ele seja removido do corpo pela urina.
12/21
Nomenclatura de Química de
Coordenação
13/21
Se o complexo for um ânion, seu nome termina em –ato. O composto
recebe o nome hexacianoferrato(II) de potássio, por exemplo, e o íon
recebe o nome de íon tetraclorocobaltato(II).
14/21
Isomerismo
15/21
Cor e Magnetismo
• É importante se estudar cores e propriedades
magnéticas dos complexos de metais de
transição para o desenvolvimento de modelos
modernos para a ligação metal-ligante.
16/21
Cor
• A cor de um complexo depende do elemento em
particular, de seu estado de oxidação e dos
ligantes unidos ao metal.
• Para que um composto tenha cor ele deve
absorver luz visível. A luz consiste em radiação
eletromagnética com comprimento de onda
variando de aproximadamente 400 até 700 nm.
• Um composto absorverá radiação quando aquela
radiação possuir a energia necessária para
mover um elétron de seu estado de energia mais
baixo para um mais excitado.
17/21
•
Um objeto tem cor específica quando:
1) Ele reflete ou transmite luz daquela cor
2) Ele absorve luz da cor complementar.
18/21
Magnetismo
• Muitos complexos de metais de transição exibem
paramagnetismo simples. Neles, os íons
metálicos individuais possuem certo número de
elétrons desemparelhados.
19/21
Teoria do Campo Cristalino
A Teoria de Campo cristalino é um dos modelos que explica
a estrutura eletrônica e as cores de íons complexos.
Ligação ente ligantes e um íon metálico, onde supõe-se
que o único efeito dos ligantes seja criar um campo
eletrostático em torno dos orbitais “d” do íon metálico.
Energia de desdobramento de campo cristalino (∆q):
É a diferença de energia entre os grupos de orbitais.
A série espectroquímica relaciona os ligantes em ordem
de suas habilidades de desdobrar as energias dos orbitais
“d” em complexos octaédricos.
Cl- < F- < H2O < NH3 < en < NO2- (ligado por N) < CN20/21
Referências Bibliográficas
• T. L. Brown, H. E. LeMay Jr., B. E. Bursten e J.
R. Burdge. Química: A Ciência Central, 9ª. ed..
São Paulo: Pearson, 2005.
21/21