Aula: 14
Temática: Teoria das ligações químicas
e estrutura dos complexos e quelatos
Teoria das ligações químicas e estrutura dos complexos
e quelatos.
Verifica-se que a estrutura dos complexos e quelatos se assemelham em
diversos aspectos e será mostrada de acordo com a teoria dos orbitais
atômicos.
Há na molécula ou íon complexo, um átomo metálico central que é chamado de átomo ou íon central, e um determinado número de grupos coordenados ligados ao átomo central que são chamados de ligantes e se
encontram dentro de uma região que habitualmente é conhecida como
“esfera de coordenação”. Quanto ao número de grupamentos doadores
que o átomo pode acomodar, convencionou-se denominar de “número ou
índice de coordenação” do átomo metálico central.
É possível admitir que o número de coordenação corresponda ao número
de orbitais híbridos e disponíveis para ligações que o átomo central possui.
Segundo as próprias características da estrutura extranuclear dos átomos,
torna-se possível acontecer diferentes tipos de hibridações, resultando um
número variável de orbitais disponíveis e, logo, vários valores para o “número de coordenação”.
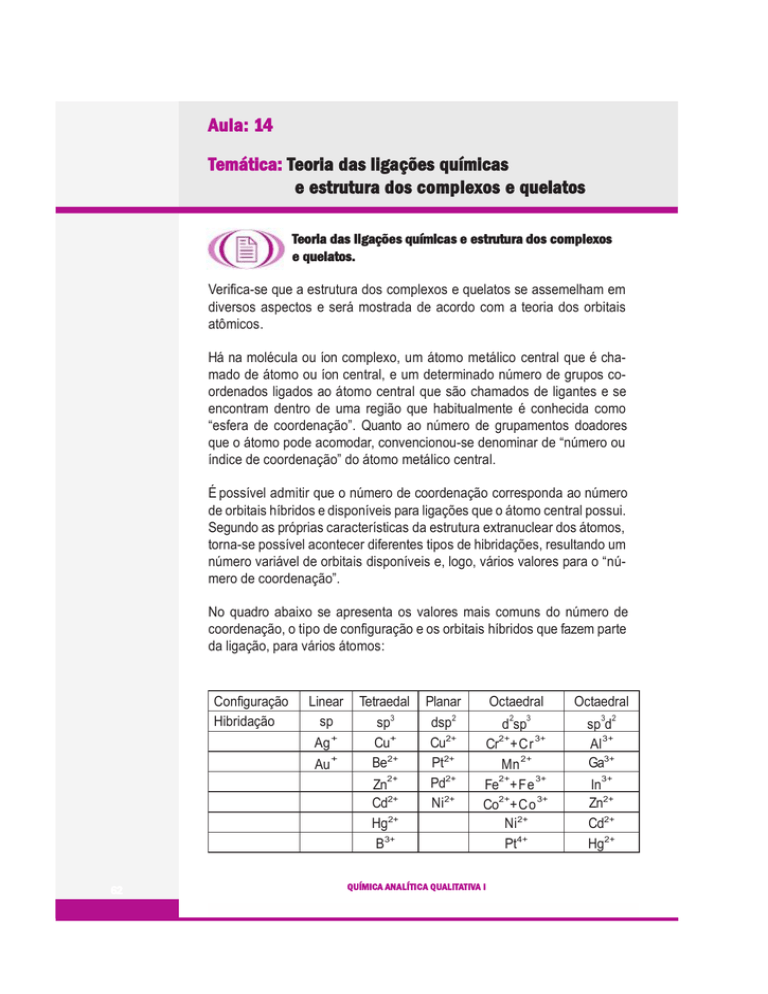
No quadro abaixo se apresenta os valores mais comuns do número de
coordenação, o tipo de configuração e os orbitais híbridos que fazem parte
da ligação, para vários átomos:
Configuração
Hibridação
Linear
sp
Ag +
Au
+
Tetraedal
sp3
Cu+
Be2+
2+
Zn
Cd2+
Hg2+
B3+
62
Planar
dsp2
Cu2+
Pt2+
Pd2+
Ni2+
Octaedral
2
3
d sp
2+
3+
Cr +Cr
2+
Mn
2+
3+
Fe +Fe
2+
3+
Co +Co
Ni2+
Pt4+
QUÍMICA ANALÍTICA QUALITATIVA I
Octaedral
3 2
sp d
3+
Al
Ga3+
3+
In
Zn2+
Cd2+
Hg2+
Verifica-se que as ligações entre os ligantes e o átomo central, nos íons
complexos, são predominantemente coordenadas, ao invés de covalentes,
uma vez que os cátions metálicos já são deficientes em elétrons, ou seja,
possuem caráter eletropositivo. Devido a isto, a maioria dos cátions metálicos tende a atrair moléculas polares e íons carregados negativamente,
que possuam pares isolados de elétrons. Esta atração é tão forte que, a
não ser os cátions dos elementos dos grupos IA e IIA da classificação periódica, os demais se encontram em solução, como cátions complexos.
Portanto, no lugar de cátions comuns, surgem íons complexos formados do cátion metálico e de moléculas do solvente. É o caso dos cátions
[Al(H2O)6] 3+, [Fe(H2O)6] 2+, [Cu(H2O)4] 2+, por exemplo, quando o solvente
é a água. Na situação de outros solventes, como amônia líquida, ácido
acético glacial, éter, acetona etc., um cátion sofreria uma solvatação, de
modo semelhante ao que acontece com a água (hidratação).
Expõe-se que os grupos coordenados ou ligantes, que podem preencher a
esfera de coordenação de um íon metálico, podem ser de diversos tipos.
Apresenta-se no quadro abaixo os mais comuns, do tipo monodentado, ou
seja, típicos formadores de complexos.
Grupo
NH3
H2O
CN–
–
OH
SCN–
Denominação
AMINO
AQUO
CIANO
HIDROXI
TIOCIANATO
Grupo
F–
CI–
CO
NO2–
Denominação
FLUOR
CLORO
CARBONILO
NITRO
OXO
2–
O
Para esclarecer a estrutura de íons complexos, de acordo com a teoria
dos orbitais atômicos. Temos, como exemplo, o complexo de cobalto com
amônia: [Co(NH3)6] 3+:
3d
4s
4p
Átomo de Co:
,
,
Íon Co3+:
,
,
Íon complexo:
,
,
Tipo de hibridação: d2sp3
QUÍMICA ANALÍTICA QUALITATIVA I
63
No exemplo acima o átomo de cobalto (Co = 27) possui uma configuração
eletrônica 1s2, 2s2, 2p6, 3s2, 3p6, 3d7, 4s2. Transformando-se num íon trivalente, o cobalto perde os dois elétrons do orbital 4s e um elétron de um dos
orbitais 3d, adquirindo outra configuração. No caso do íon de cobalto se
combinar com as seis moléculas de amônia, existe um rearranjo dos elétrons nos orbitais 3d. Dessa forma, existe um pareamento de elétrons dos
orbitais 3d, de modo a deixar livres dois orbitais para o processo de hibridação. Originam-se, portanto, 6 orbitais híbridos representados por d2sp3,
porque são provenientes da combinação de dois orbitais d, um s e três p.
Expõe-se que as informações mostradas para explicar a união dos
ligantes ao átomo ou íon central baseiam-se no conceito de orbital
atômico. Contudo, outras teorias como a dos orbitais moleculares, a
da atração eletrostática e a do campo cristalino têm sido desenvolvidas para esclarecer a estrutura dos complexos.
Na teoria dos orbitais atômicos há certa dificuldade para se explicar os
conceitos relativos à distribuição de elétrons e ao número de oxidação e
polaridade dos átomos ou íons envolvidos na ligação.
Existem duas teorias principais que tentam explicar a reorganização dos
elétrons nas moléculas: A Teoria da Ligação de Valência (TLV) e a Teoria
dos Orbitais Moleculares (TOM).
Desenvolvida por Linus Pauling, a teoria da ligação de valência considera
que átomos em moléculas se comportam como átomos isolados, exceto
para um ou mais elétrons, elétrons de valência, da camada externa de
um átomo que permanece na camada externa de outro átomo. A teoria
é capaz de explicar, de maneira satisfatória, as estruturas e propriedades
magnéticas de complexos metálicos.
No caso da teoria dos orbitais moleculares descreve-se mais precisamente a interação dos átomos que formam as moléculas e a distribuição dos
elétrons dentro dos átomos. A teoria também considera que uma nova série de orbitais é formada (orbitais moleculares) quando átomos interagem
durante a formação de ligação.
A teoria do campo cristalino (TCC) explica a interação de ligantes com o
íon ou metal de transição central.
Esta teoria tem o objetivo de explicar a ligação entre um íon central e os
ligantes do seguinte modo: um íon com um determinado valor para o seu
número de oxidação pode receber um número de ligantes compatível com
a relação entre o raio do metal e o raio do ligante e alcançar uma configu64
QUÍMICA ANALÍTICA QUALITATIVA I
ração que torna mínima a repulsão entre os mesmos. Portanto, verifica-se
que a estabilidade final do íon complexo resulta mais da atração entre o
metal e os ligantes do que da repulsão entre os ligantes.
A TCC, estabelecida em 1929, trata a interação de íons metálicos e ligantes como um fenômeno puramente eletrostático onde os ligantes são
considerados como sendo pontos de cargas nas vizinhanças dos orbitais
moleculares do átomo central. Esta consideração se deve, originalmente,
à teoria do campo cristalino, desenvolvida por meio da consideração do
modo como os níveis energéticos atômicos dos íons, em um cristal, eram
afetados pelas suas vizinhanças iônicas.
Expõe-se que o desenvolvimento e extensão desta teoria podem ser consideras de natureza parcialmente covalente entre as ligações, os ligantes
e o átomo metálico central, principalmente por meio da aplicação da teoria
dos orbitais moleculares. A TCC, acompanhando estas alterações, é freqüentemente chamada de teoria do campo de ligantes.
Verifica-se pela teoria do campo cristalino o efeito dos ligantes sobre os orbitais d do íon metálico e estabelece uma teoria unificada para explicar as cores, as propriedades magnéticas e estabilidade dos complexos e quelatos.
Com relação às características, sem duvida as mais notáveis propriedades
físicas dos complexos ou compostos de coordenação são suas cores e
suas propriedades magnéticas. Verifica-se que estas propriedades, e algumas diferenças em suas estabilidades, podem ser explicadas por meio
da teoria do campo cristalino. Esta teoria foi inicialmente traçada para
explicar as cores dos sólidos, particularmente o rubi, nas quais os íons
Cr3+ são responsáveis pela cor. A variante mais completa desta teoria é
chamada de teoria do campo de ligantes.
Na teoria do campo cristalino, cada posição de um ligante (uma base de
Lewis) é representada por um ponto de carga negativo. A estrutura do
complexo é então expressa em termos de interações eletrostáticas, o
campo, entre estes pontos de cargas e os elétrons e núcleos do íon metálico central.
Determina-se a geometria espacial de um complexo pelo número de ligantes que ele apresenta, isto é, o seu número de coordenação. Este faz
menção ao fato dos ligantes se coordenarem (ligarem por coordenação)
aos metais quando da formação dos complexos.
Sabe-se que existem complexos com número de coordenação de 2 até
9, sendo os mais comuns os de número de coordenação 2, 4 e 6, que
apresentam as seguintes geometrias espaciais: linear (2), tetraédrica (4),
QUÍMICA ANALÍTICA QUALITATIVA I
65
quadrada plana (4) e octaédrica (6). Exemplos: [Cu(NH3)4]2+ = complexo
tetraédrico; [Fe(CN)6] 4– = complexo octaédrico.
Verifica-se que a estrutura cíclica dos quelatos, envolvendo o íon metálico e os ligantes doadores de elétrons, fornece aos referidos compostos
uma estabilidade muito grande, concedendo, em muitos casos, a titulação
direta do cátion metálico com o agente quelante, em presença de um indicador apropriado.
Observa-se que o número de agentes quelantes é muito elevado e, dentre
os mais comuns, citam-se os seguintes: etilenodiamina, 8-hidroxiquinolina, dimetilglioxima, sais sódicos do etilenodiaminotetraacético (EDTA) e
vários outros.
O EDTA é um dos mais importantes agentes quelantes, devido às diversas
utilidades que possui, tanto na química analítica, como na indústria e em
outros ramos da atividade humana. O quelato é formado pela união do íon
EDTA com um cátion metálico bivalente (Ca2+, Mg 2+, Zn2+ etc.).
Nesta aula conhecemos a teoria das ligações químicas e
estrutura dos complexos e quelatos. Até a próxima aula!
66
QUÍMICA ANALÍTICA QUALITATIVA I












