Química dos Compostos
de Coordenação
Alunos:
João Guilherme Nitsch
Liziara de Mello Valerio
Lucas Rodrigues Abbruzzini
14300
13907
13792
Prof. Dr. Élcio Barrak
Universidade Federal de Itajubá
Sumário
Complexos metálicos
Ligantes com mais de um átomo doador
Nomenclatura de química de coordenação
Isomerismo
Cor e magnetismo
Teoria do campo cristalino
Complexos Metálicos
Definição: Uniões de um íon metálico central
ligado a um grupo de moléculas ou íons
vizinhos;
Os compostos que têm complexos são
conhecidos como compostos de coordenação;
As moléculas que circundam um complexo são
chamadas de ligantes;
Teoria de Werner
Propõe que os íons metálicos exibem tanto
valências primárias quanto secundárias.
Exemplos:
Form. original
Cor
Form. Moderna
CoCl3 .
CoCl3 .
CoCl3 .
CoCl3 .
6
5
4
4
NH3
NH3
NH3
NH3
Laranja
Roxo
Verde
Violeta
[Co(NH3)6]Cl3
[Co(NH3)5Cl]Cl2
trans-[Co(NH3)4Cl2]Cl
cis-[Co(NH3)4Cl2]Cl
Ligação Metal-ligante
A ligação entre um ligante e um íon
metálico é um exemplo de interação entre
uma base de Lewis e um ácido de Lewis.
A formação das ligações metal-ligante
podem alterar profundamente as
propriedades que observamos para o íon
metálico.
Cargas, Números de Coordenação e
Geometrias
Carga: a carga de um complexo é a soma
das cargas do metal central e de seus
ligantes circundantes.
Número de coordenação: é o número de
átomos diretamente ligados ao átomo
metálico em um complexo.
Ligantes com mais de um
Átomo Doador
Ligantes monodentados: possuem um único
Ligantes polidentados: podem ter dois ou mais
átomo doador e são capazes de ocupar apenas
um sítio em uma esfera de coordenação.
átomos doadores, podendo coordenar-se
simultaneamente a um íon metálico,
conseqüentemente ocupando dois ou mais sítios
de coordenação. Estes também são chamados
de agentes quelantes.
Efeito Quelato: as constantes de
formação geralmente maiores para os
ligantes polidentados em comparação com
os monodentados é conhecida como efeito
quelato.
Os agentes quelatos são geralmente
usados para prevenir uma ou mais das
reações costumeiras de um íon metálico
sem removê-lo da solução.
Estruturas de três agentes quelantes,
“ox”, “en”, EDTA
Os complexos derivados da porfina são
chamados de porfirinas; e contêm
diferentes íons metálicos e têm diferentes
grupos substituintes ligados aos átomos
de carbono na periferia dos ligantes.
As clorofilas são porfirinas que contêm
Mg(II) e são componentes-chave na
conversão de energia solar em formas que
podem ser usadas pelos organismos vivos.
Curiosidade
Um método de tratar envenenamento por
chumbo é administrar Na2[Ca(EDTA)]. O
(EDTA) quela-se ao chumbo, permitindo
que ele seja removido do corpo pela urina.
Nomenclatura de Química de
Coordenação
Regras que governam a nomenclatura de
complexos:
Ao dar nome aos sais, o nome do ânion é dado
antes do nome do cátion seguido da palavra
‘de’. Por exemplo: NaCl – cloreto de sódio
Em um íon ou molécula complexa, os ligantes
recebem os nomes antes do metal, em ordem
alfabética e o número de ligantes não é
considerado. Por exemplo:
[Co(NH3)5Cl] – Pentaminclorocobalto (III)
Os nomes dos ligantes aniônicos terminam com
a letra “o”, enquanto os ligantes neutros
ordinários possuem o nome das moléculas. Por
exemplo: NH3 - Amino
H2O – Aqua
Os prefixos gregos (di, tri, tetra, penta, hexa)
são usados para indicar o número de cada tipo
de ligante quando mais de um estiver presente.
Se o ligante por si só já contém um prefixo
desse tipo usa-se (bis, tris, tetrakis etc.).
[Co(en)3]Br3 brometo de tris(etilenodiamin)
cobalto(III)
Se um complexo for um ânion, seu nome
termina em –ato. Por exemplo:
[CoCl4]-2 tetraclorocobaltato (II)
O número de oxidação do metal é dado entre
parênteses em números romanos após o nome
do metal. Por exemplo:
[(Ni(NH3)6]Br2 brometo de hexaminníquel (II)
Isomerismo
Os isômeros são compostos com a
mesma composição, mas em diferentes
arranjos de átomos e por isso com
diferentes propriedades.
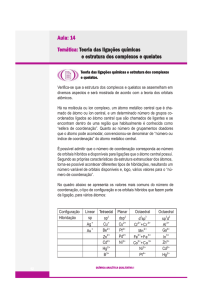
Número de Coordenação = 2
Íons complexos nos quais o íon metálico central forma
apenas duas ligações com ligantes são lineares (sp).
São lineares, pois formam apenas duas ligações com
ângulo de 180°.
[
H
H
H
H
N
Ag
N
]
H
H
Número de Coordenação = 4
Apresentam
dois tipos de geometria, a
tetraédrica e a quadrada plana.
Na quadrada plana podem ocorrer isômeros
geométricos, que diferem quanto à absorção,
solubilidade em água, ponto de fusão e reatividade
química. Os dois tipos são:
Cis: ligantes semelhantes estão o mais próximo possível
Trans: mantém esses grupos o mais afastado possível
Número de Coordenação = 6
A geometria
octaédrica é característica,
estando equidistante do íon metálico central.
Neste número de coordenação também ocorre
isomeria geométrica cis e trans.
Isomerismo estrutural
1) Isomerismo de ligação.
Ocorre quando um ligante é capaz de
coordenar-se ao íon metálico por um de dois
átomos doadores.
2) Isomerismo de esfera de coordenação.
Diferem dos ligantes diretamente ligados ao
metal, em oposição a estar fora da esfera de
coordenação na rede sólida
Esteroisomerismo
São isômeros com os mesmos arranjos de
ligação química mas diferentes arranjos
espaciais dos ligantes.
1) Isomerismo geométrico
Diferem um do outro nas posições relativas
dos átomos doadores na esfera de
coordenação. Os mais comuns são os
isômeros cis e trans. Diferem um do outro
nas propriedades físicas e químicas.
2) Isomerismo óptico
São imagens especulares não-superponíveis
uma da outra. São quirais.
Cor e Magnetismo
É importante se estudar cores e
propriedades magnéticas dos complexos
de metais de transição para o
desenvolvimento de modelos modernos
para a ligação metal-ligante.
Cor
A cor de um complexo depende do elemento em
particular, de seu estado de oxidação e dos
ligantes unidos ao metal.
Para que um composto tenha cor ele deve
absorver luz visível. A luz consiste em radiação
eletromagnética com comprimento de onda
variando de aproximadamente 400 até 700 nm.
Um composto absorverá radiação quando aquela
radiação possuir a energia necessária para
mover um elétron de seu estado de energia
mais baixo para um mais excitado.
1)
2)
Um objeto tem cor específica quando:
Ele reflete ou transmite luz daquela cor
Ele absorve luz da cor complementar.
Magnetismo
Muitos complexos de metais de transição
exibem paramagnetismo simples. Neles ,
os íons metálicos individuais possuem
certo número de elétrons
desemparelhados.
Teoria do Campo Cristalino
A Teoria de Campo cristalino é um dos modelos que explica
a estrutura eletrônica e as cores de íons complexos.
Ligação ente ligantes e um íon metálico, onde supõe-se
que o único efeito dos ligantes seja criar um campo
eletrostático em torno dos orbitais “d” do íon metálico.
Energia de desdobramento de campo cristalino (∆q):
É a diferença de energia entre os grupos de orbitais.
A série espectroquímica relaciona os ligantes em ordem
de suas habilidades de desdobrar as energias dos orbitais
“d” em complexos octaédricos.
Cl- < F- < H2O < NH3 < en < NO2- (ligado por N) < CN-
A energia necessária para adicionar um quarto
elétron a um orbital t2 de mais baixa energia é
chamada de energia de emparelhamento de spin.
Os elétrons “d” a seguir preferencialmente se
emparelham nos orbitais de mais baixa energia,
produzindo um complexo de spin baixo.
Quando os elétrons ocupam orbitais d de energia
mais alta de preferência a emparelharem-se no
conjunto de orbitais de mais baixa energia, têmse um complexo de spin alto.
Complexo de spin alto:
Maior número de elétrons não emparelhados. São previstos
quando a energia de desdobramento do campo cristalino, ∆q
é um número pequeno.
Complexo de spin baixo:
Menor número de elétrons emparelhados. São previstos
quando a energia de desdobramento do campo cristalino, ∆q
é um número grande.
Esse modelo explica a cor dos íons complexos. A
energia de desdobramento determina o comprimento de
onda da luz absorvida por um complexo, portanto, sua cor.
Com esse conhecimento foio possível organizar a
série espectroquímica, considerando que, quando o ∆q
diminui, o comprimento de onda aumenta, e maior é a
tendência à formação de complexos de spin alto.
Uso dos Compostos de
Coordenação
Tornar solúveis espécies insolúveis em água;
Hemoglobina e o transporte de oxigênio;
EDTA e envenenamento por chumbo;
Compostos de coordenação no tratamento do câncer.
Referências Bibliográficas
T. L. Brown, H. E. LeMay Jr., B. E. Bursten
e J. R. Burdge. Química: A Ciência Central,
9ª. ed.. São Paulo: Pearson, 2005.