Capítulo 24
Química dos Compostos de
Coordenação
Luis Cláudio Maldonado 14411
Thaysa Almeida Martins 14424
Compostos de coordenação
Complexos metálicos são espécies que são uniões de
um íon metálico central ligado a um grupo de moléculas
ou íons vizinhos.
Os compostos que contêm complexos são conhecidos
como compostos de coordenação.
Os ligantes são íons ou moléculas que circulam o íon
metálico central, normalmente são ânions ou moléculas
polares e têm no mínimo um par de elétrons de valência.
Teoria de Werner
→ Werner propôs que os íons metálicos exibem
tanto valências primárias quanto secundárias.
→ O metal central e os ligantes unidos a ele
constituem a esfera de coordenação.
→ A teoria de Werner explica o fato de haver duas
formas distintas de arranjar os ligantes em um
composto (cis e trans).
→ Ligação metal-ligante
Um complexo metálico é uma espécie química
distinta que tem propriedades físicas e
químicas diferentes do íon metálico e dos
ligantes a partir dos quais é formado.
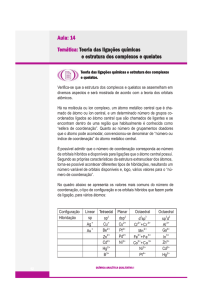
→ Cargas, número de coordenação e geometrias
A carga de um complexo é a soma das cargas do metal
central e de seus ligantes circundantes.
Complexos tetracoordenados têm duas geometrias
comuns – tetraédrica e quadrática plana;
→ tetraédrica é comum das duas, estando particularmente
presente entre os metais que não são de transição;
→ a quadrática plana é característica de íons de metais
de transição com oito elétrons d no nível de valência.
Complexos hexacoordenados têm geometria octaédrica
Ligantes monodentados possuem um único átomo
doador e ocupam somente um sítio em uma esfera de
coordenação.
Ligantes polidentados têm dois ou mais íons metálicos
ocupando dois ou mais sítios de coordenação. São
também conhecidos como quelantes.
Bidentado: etilenodiamina
Polidentado: EDTA
Efeito Quelato → constantes de ligação são
maiores para os ligantes polidentados.
[Ni(H2O)6]2+(aq) + 6NH3(aq) ↔ [Ni(NH3)6]2+(aq) + 6H2O(l) Kf = 1,2 x 109
[Ni(H2O)6]2+(aq) + 3en(aq) ↔ [Ni(en)3]2+(aq) + 6H2O(l) Kf = 6,8 x 1017
•
Esse efeito é importante na bioquímica e na
biologia molecular. A estabilização termodinâmica
adicional ajuda a estabilizar complexos metálicos
quelantes biológicos, como parafinas, e pode
levar a alterações de oxidações do íons metálicos,
enquanto também mantém a integridade estrutural
do complexo.
Agente quelantes como EDTA são usados em produtos
de consumo, incluindo muitos alimentos como molhos
de salada e sobremesas congeladas, para complexar
traços de íons metálicos que catalisam as reações de
decomposição.
São também usados na medicina para remover íons
Hg2+, Pb2+ e Cd2+ que são prejudiciais à saúde.
São comuns na natureza: musgos e liquens eliminam
agentes quelantes para capturar íons metálicos das
pedras que habitam.
Os agentes quelantes mais importantes encontrados na
natureza são os derivados da molécula de porfina
Esses complexos são chamados porfirinas. Dois dos
mais importantes compostos são os grupo HEME e a
clorofila.
o grupo heme está presente na mioglobina, encontrada
nas células do músculo esquelético – particularmente
em focas, baleia e toninhas – e também na
hemoglobina, proteína que transporta oxigênio no
sangue humano.
A clorofila é um componente-chave na conversão da
energia solar em formas que podem ser usadas pelos
organismos vivos, processo chamado fotossíntese.
Batalha pelo ferro nos sistemas vivos
O ferro tem baixa solubilidade em água, daí sua
dificuldade de assimilação pelo organismo.
Sua suplementação, no entanto, através de
pesquisas não se mostrou útil, pois a maior
quantidade de ferro no organismo torna-o mais
disponível para a bactéria, fazendo-a causar
mais dano à célula.
Nomenclatura de química de coordenação
1 – nos sais dá-se o nome do ânion antes do nome do cátion
seguido da palavra “de”;
2 – em um íon ou molécula complexa, os ligantes recebem os
nomes antes do metal e são relacionados em ordem
alfabética, independentemente da carga;
3 – os nomes dos ligantes aniônicos terminam com a letra “o”,
enquanto os neutros ordinários possuem o nome das
moléculas;
4 – os prefixos gregos são usados para indicar o número de
cada tipo de ligante quando mais de um estiver presente;
5 – se um complexo for um ânion, seu nome termina em –ato;
6 – o número de oxidação do metal é dado entre parênteses
em algarismos romanos.
Isomerismo
O que são isômeros?
São compostos que possuem a mesma composição,
mas um arranjo diferente de átomos.
Diferem em uma ou mais propriedades físicas ou
químicas. Ex.: solubilidade, cor, velocidade de
reação com algum reagente, etc..
Classificados em dois tipos:
Isômeros estruturais (ligações diferentes)
Estereoisômeros (mesmas ligações, diferentes
arranjos espaciais)
Isomerismo Estrutural
Classificado em dois tipos:
Isomerismo de ligação: mesmo ligante, mas
diferente átomo coordenado. Ex.: [Co(NH3)5NO2]2+
Isomerismo de esfera de coordenação: diferem
dos ligantes diretamente ligados ao metal, em
oposição a estar fora da esfera de coordenação na
rede sólida. Ex.: [CrCl3(H2O)6]
Estereoisomerismo
Classificados em dois tipos: Geométrico e Óptico
Isomerismo geométrico: diferem um do outro nas
posições relativas dos átomos doadores na esfera de
coordenação. Ex.: [Pt(NH3)2Cl2]
Obs.: Como todos os vértices de um tetraedro são
adjacentes entre si, o isomerismo cis-trans não é
observado em complexos tetraédricos.
Isomerismo Óptico: também chamados de
enantiômeros, são imagens especulares que não
podem ser superpostas entre si. As moléculas ou
íons que não são superponíveis com suas imagens
especulares são chamadas de quirais.
São capazes de desviar a luz polarizada.
Caso o isômero óptico provoque o giro da luz
polarizada para a direita, o enantiômero é
denominado dextrógiro (D,+). Caso o enantiômero
provoque o giro da luz polarizada para a esquerda, o
composto é denominado levógiro (L,-).
Cor
Para que um composto tenha cor, ele deve
absorver luz visível. A luz visível consiste em
radiação eletromagnética com comprimentos de onda
variando de aproximadamente 400 até 700 nm. A luz
branca pode ser dispersada em um espectro de
cores, cada uma das quais com uma faixa
característica de comprimentos de onda. A energia de
uma radiação magnética é inversamente proporcional
ao seu comprimento de onda:
E = h. ƒ = h. (c/λ)
Um composto absorverá radiação visível
quando aquela radiação possuir a energia necessária
para mover um elétron de seu estado de energia mais
baixo (fundamental) para um estado excitado. Assim,
as energias específicas de radiação que uma
substância absorve determina as cores que ela exibe.
Magnetismo
Muitos complexos de metais de transição
exibem paramagnetismo simples. Em tais compostos,
os íons metálicos individuais possuem certo número
de elétrons desemparelhados. É possível determinar
o número de elétrons desemparelhados por íon
metálico a partir do grau de paramagnetismo. Os
compostos sem elétrons desemparelhados são
diamagnéticos.
Teoria do Campo Cristalino
A teoria do campo cristalino (TCC) explica com
sucesso muitas propriedades dos compostos de
coordenação, inclusive suas cores e magnetismo.
Nesse modelo a interação entre o íon metálico e o
ligante é vista como elestrostática.
Campo cristalino octaédrico
O modelo cristalino ajuda a explicar as cores
observadas nos complexos de metais de transição. A
diferença de energia entre os orbitais d é da mesma
ordem de grandeza da energia de um fóton de luz
visível. Dessa forma, é possível para um complexo de
metal de transição absorver luz visível, que excita um
elétron dos orbitais d de mais baixa energia para os
orbitais d de mais alta energia. Essa transição que
envolve a excitação de um elétron de um conjunto de
orbitais d para outro é chamada de transição d-d.
Série espectroquímica
Cl- < F- < H2O < NH3 < en < NO2- (ligado por N) < CN-
Referências Bibliográficas
Química: A Ciência Central. 9ª edição.
Brown, Theodore L.; LeMay, H. Eugene
Jr.; Bursten, Bruce E.; Burdge, Julia R.
http://www.quiprocura.net/isomeria/optica.
html
www.3dchem.com/inorganics/Nien32+.jpg
www.chm.bris.ac.uk/motm/edta/cr-edta.gif