Cápitulo 24
Engenharia de Produção
•Gustavo Reis Bortolini 16998
•Ken Barnabé
17008
•Professor: Élcio Barrak
01/24
•
•
•
•
•
•
02/24
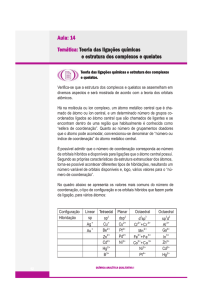
A estrutura dos complexos
Quelatos
Nomenclatura
Isomeria
Cor e Magnetismo
Teoria do Campo Cristalino
Definição: É a união de um íon metálico central com um grupo de moléculas ou íons
vizinhos, que são denominados agentes complexantes ou ligantes.
A esse conjunto dá-se o nome de esfera de coordenação do complexo, e numa fórmula
química ela fica entre colchetes.
Íon metálico central
A união entre o íon metálico e o ligante pode
ser entendida como o compartilhamento de
um par de elétrons.
Esfera de coordenação de um íon metálico
Os compostos que contém complexos são conhecidos como compostos de
coordenação
03/24
[Ag(NH3)2]+
Ag+ é o íon metálico
NH3 é o íon ligante
A carga de um complexo é a soma algébrica das cargas do íon metálico central e dos
ligantes.
04/24
• Exemplo de Geometrias
05/24
• Quando um íon metálico se liga a uma substância que possui
dois ou mais doadores de pares de elétrons, o composto
resultante será um quelato, substância mais estável que o
complexo.
[Cu(NH3)4]+2 é um complexo
[Cu(NH2CH2CH2NH2)2 ]+2 é um quelato
06/24
• Exemplos:
Ligante monodentado
Ligante polidentado
Nota-se a grande diferença das constantes de formação.
Sendo o complexo polidentado (quelante) mais estável que o monodentado.
07/24
• Utilização:
• Impede reações comuns de íons metálicos
• Usados na indústria alimentícia (Minerais, Quelatos)
• Usado na medicina para tratar envenenamentos
08/24
09/24
• Isômeros são dois ou mais compostos que tem a
mesma fórmula química, mas arranjos diferentes de
átomos
• Possuem diferentes propriedades físicas ou químicas,
como: cor, solubilidade ou velocidade de reação
10/24
11/24
Isômeros de Ligação
• É um tipo de isomeria estrutural, ou seja, o ligante pode se
coordenar ao metal de duas maneiras diferentes.
No primeiro exemplo o ligante NO2- é denominado “nitro”, já no segundo caso o ligante é
o ONO- que é denominado nitrito
12/24
Isômeros na Esfera de Coordenação
•
•
•
•
•
Diferem pelos ligantes que estão diretamente unidos ao metal.
Exemplo: CrCl3(H2O)6 , que existe em três formas.
[Cr(H2O)6]Cl3
Violeta
[Cr(H2O)5Cl]Cl2·H2O
Verde
[Cr(H2O)4Cl2]Cl·H2O
Verde
• No segundo e no terceiro compostos, parte das moléculas de água foi
deslocada da esfera de coordenação pelos íons de cloro, ocupando sítios
na rede cristalina do sólido.
13/24
• Forma mais importante de Isomerismo.
• Estereoisômeros possuem as mesmas ligações
químicas mas diferem nos arranjos espaciais.
14/24
Isômeros Geométricos
• Possuem distribuição espacial diferente. Ocorre caso existam ligações
duplas ou cadeia fechada ou se os ligantes estiverem ligados a carbonos
diferentes
•
Obs.: Como todos os vértices de
um tetraedro são adjacentes entre si
o isomerismo cis-trans não é
observado em complexos tetraédricos.
15/24
Isômeros Ópticos
• São capazes de desviar a luz polarizada.
• Também chamados “enantiômeros”, são imagens especulares que não
podem ser superpostas entre si.
Se o plano da luz rodar sentido horário (rodar para a direita), o isômero é dito
dextrógiro, simbolizado pela letra “D”.
Se o plano da luz rodar sentido anti-horário (rodar para a esquerda), o
isômero é dito levógiro, simbolizado por “L”.
• Quando os dois isômeros estão em quantidades iguais, a mistura é
racêmica, que é ausente de atividade ótica.
16/24
• Exemplos de Isomeria Óptica.
17/24
18/24
Para que um composto tenha cor, ele deve absorver luz visível.
A luz absorvida fornece energia para excitar os elétrons para
estados de mais alta energia
[Ti(H2O)6]3+
510 nm
A energia de uma radiação magnética é inversamente proporcional ao seu
comprimento de onda:
E = h ƒ = h (c/λ)
19/24
O magnetismo ocorre devido
a elétrons desemparelhados
•Hipótese da teoria do campo cristalino: a interação entre o
ligante e o metal é eletrostática.
•A teoria do campo cristalino descreve a ligação em complexos
de metais de transição.
• Ambos os elétrons na ligação vêm do ligante e são doados
para um orbital vazio hibridizado no metal.
• A carga é doada do ligante para o metal.
•A formação de um complexo é uma reação ácido-base de
Lewis.
20/24
Energia
Energia de desdobramento de campo cristalino
[CoF6]³Spin Alto
[Co(CN)6] ³Spin Baixo
21/24
•Ligação
ente ligantes e um íon metálico, onde supõe-se que o
único efeito dos ligantes seja criar um campo eletrostático em
torno dos orbitais “d” do íon metálico.
•Energia de
desdobramento de campo cristalino (∆q):
É a diferença de energia entre os grupos de orbitais (é de
mesma grandeza que um fóton de luz visível).
•A série espectroquímica relaciona os ligantes em ordem
crescente de energia de desdobramento
Cl¯ < F¯ < H2O < NH3 < en < NO2¯ (ligado por N) < CN¯
Aumento do ∆q
22/24
• A energia necessária para adicionar um quarto elétron
a um orbital t2 de mais baixa energia é chamada de
energia de emparelhamento de spin.
• Os elétrons “d” a seguir preferencialmente se
emparelham nos orbitais de mais baixa energia,
produzindo um complexo de spin baixo.
• Quando os elétrons ocupam orbitais d de energia mais
alta de preferência a emparelharem-se no conjunto de
orbitais de mais baixa energia, têm-se um complexo de
spin alto.
23/24
•Química: A Ciência Central. 9ª edição. Brown, Theodore L.; LeMay, H. Eugene Jr.; Bursten,
Bruce E.; Burdge, Julia R.
•http://www.algosobre.com.br/quimica/isomeria.html
•Princípios de Química, 3ª edição. Atkins, Peter; Jones Loretta.
•Química Geral, Volume 3. Feltre, Ricardo.
•Wikipedia http://en.wikipedia.org/wiki/Quimica
"O homem é um pedaço do universo cheio de vida."
24/24
Ralph Waldo Emerson