PUCRS/2010-1
RESOLUÇÃO – QUÍMICA
01. Alternativa Correta: (D) Assunto: Propriedades da Matéria
Classificação: média dificuldade Devemos considerar que na queima de uma vela ocorre a reação química de combustão, na qual o combustível, o pavio da vela, reage com o oxigênio do ar liberando energia térmica, vapor de água e gás carbônico, monóxido de carbono e partículas de carbono, se a combustão for incompleta. A parafina da vela serve para prolongar a queima do pavio, pois sem a parafina, o pavio se queimaria rapidamente, tendo uma vida útil muito baixa.
Na chama do fogão só há queima de gases, portanto ela não gera resíduos.
02. Alternativa Correta: (C) Assunto: Oxidação e Redução
Classificação: média dificuldade Observe o esquema abaixo: O volume ocupado pelos produtos é maior do que o ocupado pelos reagentes porque forma‐se um gás nos produtos.
O oxigênio necessário à combustão é obtido a partir da decomposição do clorato de potássio. 03. Alternativa Correta: (B) Assunto: Reações Químicas
Classificação: média dificuldade
A reação da alternativa (B) é uma dupla‐troca onde temos a formação de um produto gasoso. O ácido carbônico formado decompõem‐se em água e gás carbônico.
CaCO3 = calcário
H2SO4 = ácido sulfúrico
CaSO4 = sulfato de cálcio
H2CO3 = H2O + CO2 (ácido instável)
04. Alternativa Correta: (B) Assunto: Concentração de íons em solução
Classificação: fácil O cloreto de cálcio possui a fórmula CaCl2. Isto significa que, em solução, a proporção de íons cálcio para os íons cloreto é de 1:2. Logo, se a concentração de íons cloreto é 0,6 mol/litro a de íons cálcio será a metade, isto é, 0,3 mol/litro.
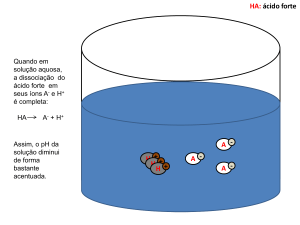
05. Alternativa Correta: (C) Assunto: Efeitos Coligativos nas Soluções Aquosas
Classificação: média dificuldade O abaixamento da temperatura de solidificação do solvente de uma solução deve‐se ao número de partículas de soluto dissolvidas. Quanto maior o número de partículas de soluto dissolvidas mais acentuado é o efeito coligativo. Esta questão trata do efeito denominado crioscopia e o número de partículas em solução depende do número de íons formados pelos sais citados pois a concentração é igual para todas as soluções.
Vejamos:
Nitrato de potássio – KNO3
‐1
+
KNO3 → K + NO3 (2 íons)
Sulfeto de potássio – K2S
+
‐2
K2S → 2 K + S (3 íons)
Fosfato de potássio – K3PO4
+
‐3
K3PO4 → 3 K + PO4 (4 íons)
06. Alternativa Correta: (E) Assunto: Propriedades dos Isômeros Geométricos
Classificação: difícil Os isômeros geométricos por apresentarem distribuições espaciais diferentes possuem propriedades físicas (ponto de fusão, ponto de ebulição, solubilidade, etc.) diferentes.
A desidratação ocorre mais facilmente no ácido maléico (cis) porque as carboxílas estão no mesmo plano o que facilita a formação do anidrido de ácido.
07. Alternativa Correta: (A) Assunto: Estequiometria
Classificação: média dificuldade Segundo a reação de formação da ferrugem :
2 Fe + 1,5 O2 → Fe2O3
112g + 48g = 160g
Podemos concluir que nos 160g de ferrugem temos 48g de oxigênio e somente 112g de ferro. Logo,
560g .............. 100%
112g .............. x%
x = 112 x 100 / 560 = 20%
08. Alternativa Correta: (D) Assunto: Ligações intra e intermoleculares
Classificação: média dificuldade Analisando cada um dos materiais citados nas afirmativas podemos afirmar que:
Cromo é metal de transição – ligação metálica.
Hidrocarboneto – substância apolar – o tipo de atração entre moléculas é van der Waals, dipolo instantâneo.
A hidroxila presente no grupo funcional dos álcoois une‐se a outras moléculas através de ligações de hidrogênio. I.
II.
09. Alternativa Correta: (B) Assunto: Propriedades Físicas das Funções Orgânicas
Classificação: fácil Analisando cada uma das afirmações, identificamos:
I. Ácido carboxílico;
II. Aldeído;
III. Fenol ou ácido fênico;
IV. Anilina ou fenilamina;
V. Amida.
Somente as espécies químicas ácidas apresentam pH < 7, logo somente a I e a III correspondem ao que foi pedido.
10. Alternativa Correta: (E) Assunto: Velocidade das Reações
Classificação: média dificuldade A ordem de uma reação é determinada a partir da soma expoentes das concentrações dos reagentes determinadas experimentalmente.
Analisando os valores das concentrações notamos que à medida que dobra a concentração a velocidade quadruplica. Isto implica que a concentração do reagente esteja elevada ao quadrado. Molecularidade corresponde ao número mínimo de moléculas reagentes. Na reação da questão é igual a 1.