ENZIMAS
ENZIMAS
As enzimas são proteínas globulares solúveis
sintetizadas pelos organismos vivos com a
finalidade específica de catalisar as reações
bioquímicas, que, de outro modo, não ocorreriam
sob as condições fisiológicas habituais.
• Com exceção de moléculas de RNA com
propriedades catalíticas chamadas de
RIBOZIMAS, todas as Enzimas são
PROTEÍNAS
Características das Enzimas
• Apresentam alto grau de especificidade;
• São produtos naturais biológicos;
• Reações seguras;
• São altamente eficientes acelerando a velocidade das
reações (108 a 1011 + rápida);
• reduz a energia de ativação;
• Não são tóxicas.
As enzimas...
• Aceleram reações químicas
H2O2
Catalase
Ex: Decomposição do H2O2
H2O +
O2
• Não são consumidas na reação
H2O2
Catalase
E+S
H2O + O2
E+P
• Atuam em pequenas concentrações
1 molécula de Catalase
decompõe
5 000 000 de moléculas de
H2O2
pH = 6,8 em 1 min
Número de renovação = n° de moléculas de substrato
convertidas em produto por uma única molécula de enzima
em uma dada unidade de tempo.
• Emil Fischer (1894): alto grau de especificidade das
enzimas originou Chave-Fechadura , que
considera que a enzima possui sitio ativo complementar
ao substrato.
• Koshland (1958): Encaixe Induzido, enzima e o
substrato sofrem conformação para o encaixe. O
substrato é distorcido para conformação exata do estado
de transição.
NOMENCLATURA E
CLASSIFICAÇÃO
• 1955 - Comissão de Enzimas (EC) da União Internacional de
Bioquímica (IUB) nomear e classificar.
• Cada enzima código com 4 dígitos que caracteriza o tipo de
reação catalisada:
•1° dígito - classe
•2° dígito - subclasse
•3° dígito - sub-subclasse
•4° dígito - indica o substrato
FATORES QUE
INFLUENCIAM A
ATIVIDADE
ENZIMÁTICA
• pH;
• temperatura;
• concentração das enzimas;
• concentração dos substratos;
• presença de inibidores.
• ação do cofator
pH
• O efeito do pH sobre a enzima deve-se às variações no
estado de ionização dos componentes do sistema à medida
que o pH varia.
• Enzimas grupos ionizáveis existem em diferentes
estados de ionização.
Temperatura
• temperatura causa dois efeitos:
- a velocidade de reação aumenta;
- a estabilidade da proteína decresce devido a
desativação térmica.
A temperatura ótima para que
a enzima atinja sua atividade
máxima, é a temperatura
máxima na qual a enzima
possui uma atividade
constante por um período de
tempo.
Concentração de Enzimas
• Desvios da linearidade ocorrem:
• Presença de inibidores na solução de enzima;
• Presença de substâncias tóxicas;
• Presença de um ativador que dissocia a enzima;
• Limitações impostas pelo método de análise.
• Recomenda-se:
• Enzimas com alto grau de pureza;
• Substratos puros;
• Métodos de análise confiável.
Concentração de Substratos
•
[S] varia durante o curso da reação à medida que S é convertido
em P.
• Medir Vo = velocidade inicial da reação.
vo
Vmax
[S]
Presença de Inibidores
• Inibidor é qualquer substância que reduz a velocidade de
uma reação enzimática.
INIBIDORES
REVERSÍVEIS
IRREVERSÍVEIS
COFATOR
• Moléculas pequenas
• Não proteicas
• Termo estáveis
• Derivadas de Vitamina B1 e B6, nucleotídeos
ATIVIDADE
ENZIMÁTICA
Determinação da Atividade
Enzimática
• As enzimas são medidas através de suas
atividades catalíticas e seus resultados expressos
em termos de quantidade de atividade presente em
determinado volume ou massa da amostra
- Quantidade do produto formado
- Quantidade do substrato consumido
Determinação da Atividade
Enzimática
• Comissão Enzimas da União Internacional de Bioquímica
- Unidade Internacional (UI) – é a quantidade de enzima
que catalisa a transformação de 1 micromol de
substrato/min.
APLICAÇÕES
DIAGNÓSTICAS
Enzimologia Clínica
É a aplicação da ciência das enzimas ao
diagnóstico e tratamento das doenças.
DISTRIBUIÇÃO DAS ENZIMAS DE IMPORTÂNCIA DIAGNÓSTICA
ENZIMA
FONTES PRINCIPAIS
PRINCIPAIS APLICAÇÕES
CLÍNICAS
ALT
Fígado, músculo esquelético,
coração
Doença hepática parenquimatosa
ALDOLASE
Músculo esquelético, coração
Doenças musculares
AMILASE
Glândulas salivares, pâncreas,
ovários
Doenças pancreáticas
Fosfatase ácida
Próstata, hemácias
Carcinoma da próstata
AST
Fígado, músculo esquelético,
coração, rim, hemácias
Infarto do miocárdio, doença
hepática parenquimatosa,
doença muscular
Colinesterase
Fígado
Envenenamento por inseticida
organofosforado, doenças
hepáticas parenquimatosa
Creatino quinase
Músculo esquelético, cérebro,
coração, músculo liso
Infarto do miocárdio, doenças
musculares
Fosfatase alcalina
Fígado, osso, mucosa intestinal,
placenta, rim
Doenças ósseas, doenças
hepatobiliares
LD
Coração,fígado,músculo
esquelético, hemácias,
plaquetas, linfonodos
Infarto do miocárdio, hemólise,
doenças hepáticas
parenquimatosa
Enzimas x Laboratório Clínico
• Aplicação diagnóstica
• Aplicação prognóstica
• Acompanhamento das diversas patologias
Métodos para Determinação das Atividades
Enzimáticas
Métodos que analisam:
• Consumo de substrato
• Produto formado
• Variação de absorção da coenzima que participa da
reação enzimática
Erros na Coleta da Amostra
• Uso de Anticoagulantes
• Hemólise
• Estase venosa
• Coagulação
• Lipemia
Erros na Conservação da Amostra
• Realizar o mais breve possível
• Conservar à 4°C
• Evitar congelamento da amostra
Determinação da Atividade Enzimática
Importante
• Estabilidade do reagentes
• Pipetagem
• Limpeza da vidraria
• Controle de qualidade das análises
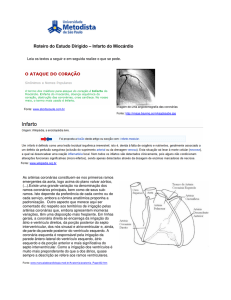
Enzimas nas Doenças Cardíacas
AST – GOT - TGO ( Aspartato aminotransferase)
• Encontrada em concentrações elevadas no
músculo cardíaco, fígado e músculos
esqueléticos
• Em menor concentração nos rins e pâncreas
• Aumenta em lesões do parênquima hepático
• Eleva mais de 10 vezes na hepatite virótica aguda
• Na cirrose alcoólica ativa se eleva
moderadamente
AST-GOT-TGO
• Catalisa especificamente a transferência do
grupo amina do ácido aspártico para
cetoglutarato
AST
L-Aspartato + cetoglutarato
Oxalacetato + L-Glutamato
MDH
Oxalacetato + NADH
Malato + NAD
Aspartato Aminotransferase
AST – TGO
Valores elevados são encontrados:
•
•
•
•
•
•
•
Hepatite virótica crônica ativa
Mononucleose infecciosa
Hepatite aguda na fase de recuperação
Disfunção hepática induzida por drogas
Tumor hepático metastático
Obstrução extra hepática
Infarto do miocárdio
Aspartato Aminotrasferase
AST –TGO
Fatores Interferentes:
•
•
•
•
•
•
Exercícios
Anticoncepcionais orais
Anti-hipertensivos
Isoniazida
Agentes colinérgicos
Drogas hepatotóxicas
Enzimas nas Doenças Cardíacas
Creatinoquinase (CK- CPK)
• pH ótimo: 6,8 no sentido da formação de ATP e 9,0
no sentido da fosforilação da creatina
• Encontrada no músculo cardíaco, na musculatura
esquelética e no cérebro
• Aumentos podem ocorrer numa faixa de 60 a 100%
com infarto agudo do miocárdio
Creatinoquinase (CK- CPK)
Valores elevados são encontrados:
• Infarto agudo do miocárdio
• Miosites
• Distrofia muscular
• Exercício intenso
• Doença vascular cerebral
• Convulsões
• Alcoolismo crônico
Diagnóstico do Infarto do Miocárdio
Isoenzimas de Creatinoquinase (CK)
• CK-BB (CK1)
• CK-MB (CK2)
• CK-MM (CK3)
Isoenzimas de Creatinoquinase (CK)
CK-BB (CK1)
• Encontrada no cérebro e pulmão
• Eleva-se após embolia pulmonar, carcinoma de
próstata e de pulmão
• Não é comum a elevação em distúrbios cerebrais
Isoenzimas de Creatinoquinase (CK)
CK-MB(CK2)
• Fração híbrida de cadeias M e B
• Encontrada predominantemente no músculo cardíaco
• Determinação bastante específica para diagnóstico de
infarto agudo do miocárdio
• Aumenta de 3 a 6 horas após a ocorrência do infarto
com valor máximo em 12-24 horas
• Retorna ao normal em 24-48 horas
Isoenzimas de Creatinoquinase (CK)
CK-MM(CK3)
• Compreende + de 95% da CK dos músculos
esqueléticos
• Cerca de 70-75% da enzima do miocárdio
Níveis elevados:
• Lesão, hipóxia do músculo esquelético (exercício
intenso, traumatismo, inflamação)
Isoenzimas de Creatinoquinase (CK)
Drogas que causam aumento no soro:
•
•
•
•
•
Ampicilina
Anfotericina B
Alguns anestésicos
Lítio
Lidocaína
Desidrogenase Láctica
LDH – LD - DHL
• pH ótimo: 8,8 a 9,8 no sentido da formação de
ácido pirúvico e 7,4 a 7,8 no sentido da
formação de ácido láctico
• Encontrada no coração, hemácias, músculo
esquelético, rim, cérebro, pulmões e tecido
linfóide
• Não é indicador específico de doença hepática
e cardíaca
Desidrogenase Láctica
Valores elevados LD total:
• Anemia megaloblástica
• Carcinoma
• Infarto do miocárdio e pulmonar, cirrose
• Leucemia
• Hepatite aguda
• Icterícias obstrutivas
• Doenças do parênquima renal
Infarto Agudo do Miocárdio
Importância
• Cerca de 50% óbitos no mundo
• 1/3 faixa etária de 35 a 65 anos
• Prevalência nos países industrializados
• Evolução diagnóstica com marcadores mais
sensíveis e específicos
• Compreender a “Janela Diagnóstica”
Desidrogenase Láctica
Isoenzimas de LD
•
•
•
•
•
LD1: coração, hemácias e rins
LD2: coração e sistema retículo endotelial
LD3: pulmão e outros tecidos
LD4: placenta e pâncreas
LD5: fígado e músculos esqueléticos
Aplicação Clínica do Fracionamento da LD
Doenças
Infarto A. Miocárdio
Doenças Hepáticas
SNC
Doenças Malígnas
Distrofia Muscular
Anemia Megaloblástica
Anemia Aplástica
↑ acentuado
LD5
↑ moderado
↑ leve
LD1
LD4
LD2 e LD3
LD2, LD3 e LD4
LD1, LD2 e LD3
LD2
LD1
LD1,2,3,4e5
Desidrogenase Láctica
Fatores Interferentes
• Hemólise
• Álcool, anestésicos, aspirina ↑
• Ácido ascórbico ↓
Marcadores Clássicos
• AST – década de 50 (substituído por CK)
• LD – década de 70 (mais sensível que AST), porém
com janela diagnóstica tardia
• CK-MB com CK total mais indicada
• CK total aumenta de 65 a 100% no IAM
• Troponina
Troponina
• São proteínas estruturais envolvidas no processo de
contração das fibras musculares esqueléticas e
cardíacas.
• O complexo troponina é composto por três
proteínas:troponina T, troponinaI e troponina C
• As troponinas T (cTnT) e I (cTnI) são marcadores
bioquímicos mais específicos e sensíveis para o
diagnóstico de lesão isquêmica do miocárdio.
Troponina
• Elevação dos níveis de cTnI no soro ocorre entre 4 e
6 horas após início da dor precordial
• Atinge um pico em 12 horas e permanece elevada
por 3 a 10 dias após um evento isquêmico único
• A isoenzima CK-MB só se eleva após lesão
isquêmica irreversível
• As troponinas são liberadas mesmo em situação de
isquemia reversível
Mioglobina
• A mioglobina é uma proteína constituinte das
células dos músculos esquelético e cardíaco.
• Proteína liberada para a circulação
precocemente após lesão isquêmica da fibra
miocárdica.
• Concentrações elevadas são observadas 1 a 2
horas após o início da dor, atingindo o pico em
12 horas e, em geral, normalizando 24 horas
após um episódio único.
Mioglobina
• Elevação de mioglobina circulante não é
específica de lesão cardíaca, ocorrendo no
trauma da musculatura esquelética e na
insuficiência renal.
Importância da coleta seriada de amostras
• Devem ser coletadas amostras seriadas, em geral, na admissão,
3, 6 e 9 horas.
• Dosagens seriadas de cTnI, resultados do eletrocardiograma e
a condição clínica são necessários para o diagnóstico
diferencial entre infarto agudo do miocárdio e outras doenças
cardíacas.
• NACB - National Academy of Clinical Biochemistry propõe o
uso de dois marcadores para o diagnóstico de infarto agudo do
miocárdio: a mioglobina, como marcador precoce e uma das
troponinas (cTnT ou cTnI) como definitivo.
Características da dinâmica de elevação, pico e retorno aos
níveis basais dos marcadores cardíacos.
Marcador
Tempo de
alteração inicial
Tempo de pico de Tempo de retorno
elevação
ao normal
CK-MB
4-8 horas
12-24 horas
72-96 horas
Mioglobina
2-4 horas
8-10 horas
24 horas
cTnI
4-6 horas
12 horas
3-10 dias
cTnT
4-6 horas
12-48 horas
7-10 dias
CK-MB = isoenzima MB da creatina quinase; cTnI = troponina cardíaca I; cTnT = troponina
cardíaca T
Sensibilidade clínica estimada dos marcadores de isquemia miocárdica,
levando-se em conta o tempo após o início da dor precordial.
Marcador
2 a 8*
8 a 24*
24 a 72*
acima de
72*
Mioglobina
95%
75%
0%
0%
CK-MB
60%
95%
98%
50%
LD1
Troponina
(T ou I)
40%
85%
95%
90%
75%
95%
98%
98%
Enzimas de maior utilidade
Diagnóstica
Creatino Quinase – CK
Doenças do músculo esquelético
Distrofia muscular progressiva
Doenças musculares neurogênicas
• Doenças do coração
Infarto miocárdio
Outras doenças cardíacas
• Troponina
• Mioglobina