Cinética e regulação
enzimática
IST – FML
2º Semestre 2007/2008
Trabalho realizado por:
Miguel Amador nº58484
Joana Nunes nº58497
João Marques nº58513
Cinética Enzimática
Estrutura Enzimática
Constituição em Aminoácidos
influenciam
Mecanismos de Acção Enzimática
São difíceis de definir quantitativamente
Pelo que
é necessário
Determinar constantes da reacção catalisada
Cinética Enzimática
Cinética Enzimática
Estudo da velocidade de uma reacção química que ocorre na presença de
um enzima
Permite elucidar sobre:
•Os pormenores do mecanismo catalítico das enzimas
•O papel das enzimas no metabolismo
•Controle da actividade
•Mecanismos de inibição
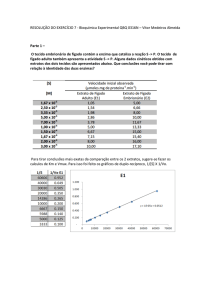
Velocidade vs. Concentração
A concentração de substrato influencia a velocidade de uma reacção
Estudo da relação entre a concentração e a velocidade:
. No inicio da reacção a quantidade de substrato é constante, já que a
quantidade de substrato é muito maior do que a de enzima.
.Determina-se a velocidade inicial de reacção, Vo ,para uma determinada
[S].
.Obtêm-se valores para várias concentrações de substrato, mantendo
constante a concentração de enzima.
Assim podemos traçar os valores num gráfico, em que exprimimos Vo
como função de [S]
Velocidade vs. Concentração
Dados:
•Para [S] baixas, Vo aumenta quase linearmente
•Para [S] maiores, Vo aumenta mais gradualmente
•Para [S] mais elevadas, atinge-se uma velocidade máxima, Vmáx.
Equação de Michaelis-Menten
Comportamento é explicado pela formação do complexo enzima-substrato ES
1. O enzima liga-se ao substrato reversivelmente formando o complexo ES
Reacção
rápida
2. O complexo ES dissocia-se em enzima livre e produto da reacção
Reacção
mais lenta
.A reacção 2, mais lenta, limita a velocidade global da reacção.
.A velocidade é proporcional à concentração do complexo ES.
.A cada momento o enzima existe na forma livre e no complexo ES.
.A velocidade máxima (Vmáx) da reacção ocorre quando todos os enzimas estão
associadas a moléculas de substrato.
Dedução da Equação Michaelis-Menten
A curva que representa a relação entre [S] e Vo tem forma idêntica para a maior
parte dos enzimas. Esta curva pode ser descrita algebricamente pela equação de
Michaelis-Menten.
A equação de Michaelis-Menten é
Hipótese: o passo limitante da velocidade das reacções enzimáticas é a desassociação
do complexo ES
Dedução da Equação Michaelis-Menten
Presuposto: não há transformação de produto em substrato
Reacções de formação e desassociação do complexo ES:
Vo pode ser considerado como a velocidade com que ocorre a quebra da ligação ES
Não é fácil determinar [ES]!
[ET] - concentração total da enzima
A concentração de enzima livre é, assim, [ET]-[ES]
Dedução da Equação Michaelis-Menten
.Passo 1
Velocidade de formação de ES
Velocidade de degradação de ES
.Passo 2
[ES] é constante, ou seja, a velocidade de degradação e formação de ES são iguais.
.Passo 3
Dedução da Equação Michaelis-Menten
.Passo 4
Obtemos Vo, substituindo [ES]
A velocidade é máxima quando [ES]=[ET]!
Equação de Michaelis-Menten
Análise da Equação Michaelis-Menten
A equação de Michaelis-Menten, que nos dá a relação quantitativa entre a
velocidade inicial V0, a velocidade máxima Vmáx e a quantidade inicial de
substrato [S], todas relacionadas pela constante de Michaelis Km
Km – unidades de concentração
No caso de V0 ser exactamente metade de Vmax:
Km corresponde à concentração de substrato para a qual V0 é metade da velocidade máxima
Análise da Equação Michaelis-Menten
A equação de Michaelis-Menten é muito útil para determinar os valores de Km e Vmáx das
reacções.
Os enzimas que exibem uma dependência hiperbólica de V0 em função de [S] diz-se que seguem
a cinética de Michaelis-Menten.
Enzimas cujo mecanismo obedeça às duas reacções anteriores podemos dizer que o valor de Km
está relacionado com a afinidade do enzima para o substrato, e logo é diferente de substrato para
substrato e de enzima para enzima.
O Vmáx é a velocidade máxima que a reacção pode alcançar, na situação virtual em que todos
os enzimas se encontram ligados ao substrato.
Equação de Lineweaver-Burk
Podemos transformar a equação de Michaelis-Menten, invertendo-a:
Esta forma da equação de Michaelis-Menten chama-se equação de Lineweaver-Burk
Equação de Lineweaver-Burk
Gráfico de 1/[V0] em função de 1/[S]
Obtém-se uma função
linear!
.Esta recta tem um declive Km/Vmáx
.A intersecção da recta no eixo 1/V0 corresponde ao valor 1/Vmáx
.A intersecção com o eixo 1/[S] corresponde a -1/Km
Permite uma determinação de Vmáx precisa!
Inibição enzimática
• Reversível
Competitiva
Anti-Competitiva
Mista
• Irreversível
Inibição Reversível Competitiva
• Há competição pelo centro activo do enzima
• O inibidor é estruturalmente semelhante ao
substracto
• A inibição pode ser contrariada adicionando
mais substracto ao meio
• O Km aumenta e o Vmax não se altera
Inibição Reversível Competitiva
Inibição Reversível Competitiva
Inibição Reversível Competitiva
Inibição Reversível Anti-Competitiva
• O inibidor liga-se a um local específico do
enzima (que não o centro activo)
• O inibidor liga-se apenas ao complexo ES,
formando o complexo ESI
• O Km diminui e o Vmax diminui
Inibição Reversível Anti-Competitiva
Inibição Reversível Anti-Competitiva
Inibição Reversível Anti-Competitiva
Inibição Reversível Mista
• O inibidor liga-se a um local específico do
enzima (que não o centro activo)
• O inibidor liga-se tanto ao enzima livre
como ao complexo ES
• Vmax diminui
• Km pode aumentar, diminuir ou manter-se
Inibição Reversível Mista
Inibição Reversível Mista
Inibição Reversível Mista
Inibição Reversível
Vmax aparente
Km aparente
Sem inibição
Vmax
Km
Inibição
competitiva
Vmax
αKm
Inibição AntiCompetitiva
Vmax/α’
Km/α’
Inibição Mista
Vmax/α’
αKm/α’
Quando α = α’, a Inibição Mista tem o nome de
Inibição Não Competitiva
Inibição Irreversível
• O inibidor combina-se permanentemente ao
enzima de uma das seguintes formas:
Ligação covalente
Destruição de um grupo funcional essencial ao
funcionamento do enzima
Ligação não covalente particularmente estável
Hexocinase
• A hexocinase fosforila a glucose para glucose-6-fosfato
• Reacção ocorre com consumo de ATP juntamente
com um ião Mg2+
• O Km para a glucose é 0.1mM, e a concentração de
glucose na célula é 4mM
• A hexocinase é regulada alostericamente pelo
produto da sua própria reacção
Hexocinase
• A hexocinase é uma enzima do tipo indutivo
Hexocinase
• Fosforilação impede a saída de glucose da célula
Hexocinase
• Reacção catalisada pela hexocinase
Hexocinase
• No fígado também existe uma hexocinase, mas com
menor afinidade para com a glucose
• Esta só está activa quando a concentração de
glucose no sangue é muito elevada
• Quando a concentração de glucose no sangue é baixa,
o fígado não compete com outros tecidos
• No fígado, a glucose é convertida em glicogénio
Hexocinase
• A fosforilação
• A conversão
da glucose é reversível!
da glucose-6-fosfato em
glucose ocorre no fígado durante a
gluconeogénese.
Enzimas Reguladores
• Enzimas que aumentam ou diminuem a sua
actividade em reacção a determinados factores.
• Fazem normalmente parte de sequências
metabólicas.
Permitem regular a actividade de toda a
sequência metabólica e possibilitam à célula
ajustar-se às suas necessidades energéticas e
biomoléculares.
Tipos de Moduladores
Mecanismos que regulam a actividade enzimática:
•Variação da concentração de substrato
•Variação de pH e temperatura
•Inibição enzimática
•Modulação alostérica
•Modulação covalente
Modulação alostérica
Ocorre em enzimas que possuem um local de modulação alostérico
Heterotropismo
(o modulador é
diferente do substrato)
Homotropismo
(o modulador é
igual ao substrato)
Modulador alostérico
Positivo
(activam o enzima)
Negativo
(inibe o enzima)
A ligação entre o modulador e o enzima é não-covalente e o local de modulação é
especifico para cada modulador, no caso dos enzimas heterotrópicos
Modulação alostérica
Induz:
Modificações conformacionais
na estrutura espacial do
enzima
Modifica a afinidade do
enzima para com os seus
substratos
Modulação alostérica
Um modelo muito comum de
regulação alostérica é a inibição
por retroalimentação, onde o
próprio produto da reacção
actua como modulador da
enzima que a catalisa.
Cinética
•Não seguem a cinética de
Michaelis-Menten
•Comportamento sigmóide
•[S] para a qual V0=Vmáx/2 não
corresponde ao Km
O comportamento sigmóide é explicado pela interacção entre as subunidades das
proteínas, já que mudanças estruturais numa subunidade são transferidas para as
adjacentes, através de interacções não covalentes entre elas.
Cinética
Enzimas homotrópicas pequenas variações na concentração
do modulador podem provocar grande variações na actividade
do enzima.
Enzimas heterotrópicasÉ dificil generalizar a forma como
se comportam . Apresentam uma grande variabilidade no
comportamento.
Cinética
Modulação covalente
Grupos adicionados ou retirados do enzima através
de modificações covalentes
•Fosforilação
•Adenilação
•Urinilação
•ADP-ribosilação
•Metilação
Fosforilação
Ligação de um grupo Fosforil a determinados resíduos de
aminoácidos
•É catalisada por quinases
•É um processo reversível
•Fosfatase remove os grupos fosforil adicionados
Fosforilação
O grupo fosforil:
Influencia a polaridade
dos aminoácidos
Permite o estabelecimento
de pontes hidrogeniónicas
Importantes para a estrutura e
conformação da molécula
Adenilação
É adicionado um grupo Adenil à tirosina
Uridilação
É adicionado um grupo uridil à tirosina
ADP-Ribosilação
É acresentada uma ADP-Ribose, com incidência nos resíduos
Arginina, Glutamina, Cisteína e Histidina alterada (diftamida-a)
Metilação
É adicionado um grupo metil em resíduos de glutamato
Zimogénios
A regulação enzimática pode passar ainda pela existência de
um precursor, sem capacidade catalítica, que, no caso das
proteases, são chamados zimogénios.
Zimogénio
Clivagem proteolítica
Enzima activa