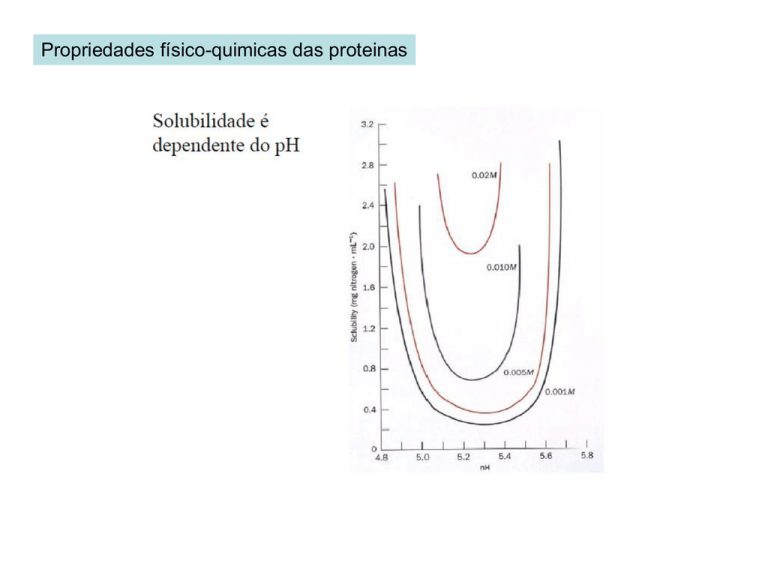
Propriedades físico-quimicas das proteinas
Massa molar (em Da ou Kda)
Exercicio:
Considere que em uma coluna empacotada com gel Sephadex-50 (1500-30.000) foram eluídas
várias proteínas de massa molar conhecida, além de dextrana azul e glicose (dados listados
abaixo). Nessa mesma coluna foi analisada uma mistura de enzimas oriunda de um meio
fermentado pré-concentrado por ultrafiltação contra uma membrana de corte de 5 kDa. O extrato
mostrou 2 picos no cromatograma que corresponderam aos volumes de eluição de 58 e 75 mL.
Qual a massa molar das 2 enzimas presentes no extrato?
Massa molar (kDa)
Volume de eluição (mL)
Albumina
66
54,1
Anidrase Carbônica
29
61,2
Citocromo c
12,4
78,2
Aprotinina
6,5
88,6
Dextrana azul
2.000
52,0
Glicose
180
95,0
Substância
Carga
Exercicio:
Em qual ordem as proteínas listadas a seguir deverão eluir em uma coluna de CM-celulose
percolada a pH 7,0: fibrinogênio, hemoglobina, lisozima, pepsina e ribonuclease A?
Pontos isoelétricos de algumas proteínas
Proteína
Ponto
isoelétrico
Pepsina
<1,0
Albumina do ovo
4,6
Albumina do soro sanguíneo
humano
4,9
Tropomiosina
5,1
Insulina bovina
5,4
Fibrinogênio humano
5,8
Gama-globulina
6,6
Colágeno
6,6
Mioglobina de cavalo
7,0
Hemoglobina humana
7,1
Ribonuclease A bovina
7,8
Citocromo c
10,6
Histona bovina
10,8
Lisozima
11,0
Salmina de salmão
12,1
Relações estrutura de proteínas versus função
Estabilidade de proteinas:
1) Estabilidade termodinâmica (se relaciona com a estrutura)
Resistência a desnaturação (temp, pH, SDS, ureia, agitação e pressão,
concentração proteica)
2) Estabilidade cinética (se relaciona com a funcionalidade)
1.
2.
3.
4.
Proteinas de organismos termófilos normalmente apresentam
estabilidade térmica maior que organismos mesófilos
composição aminoácidos (Ile, Arg, Glu, Lys e Pro são maiores que
de Ser, Ans, Gln, Thr e Met )
pontes salinas
Hidrofobicidade
Ligações de hidrogenio.
Proteínas são moléculas tridimensionais.
A forma da molécula é determinante de sua função
A Lipase gástrica é uma
proteína solúvel em meio
aquoso.
A Citocromo C oxidase é uma
proteína integral da membrana
interna de mitocôndrias
Para entender a relação estrutura versus função de uma proteína, como exemplo
veremos a mioglobina, proteína armazenadora de O2 nos músculos dos mamíferos.
A mioglobina da baleia cachalote é uma proteína de forma globular, de 153 aminoácidos,
contendo um grupo prostético heme. A proteína é bastante solúvel em meio aquoso.
O interior da molécula é forrado com cadeias laterais de aminoácidos apolares, formando
um ambiente hidrofóbico.
grupo heme
grupo heme
Mioglobina da baleia cachalote
Modelo simplificado
(somente o “esqueleto” -N-C-C- da proteína)
Modelo com cadeias laterais dos aminoácidos
A forma globular da mioglobina, formando um bolsão hidrofóbico em torno do
heme, é fundamental para o desempenho da função de armazenamento de O2.
Heme
Heme
Fe2+ + O2
X
(Fe3+)2O3
polar
Em um meio aquoso, o Fe2+ combina-se com O2
de maneira irreversível, com oxidação do Fe2+ a
Fe3+, formando óxido de ferro.
Fe2+ + O2
OO
O O2 liga-se ao átomo de Fe
do
heme. ao átomo de Fe do heme.
2 liga-se
Mutações nas globinas que levam a trocas
de aminoácidos no bolsão do heme por
outros mais polares podem ser letais, pois
afetam a interação da proteína com o O2.
Fe2+.O2
apolar
No meio apolar proporcionado pela mioglobina, a
ligação do Fe2+ ao O2 é reversível e não envolve
oxidação do Fe.
Por que a mioglobina é solúvel em água ?
As cadeias laterais de aminoácidos
polares, carregados ou não, voltam-se
para o meio aquoso e fazem contacto
(pontes de H) com as moléculas de
água do meio.
Aminoácidos apolares voltados
para o interior da molécula.
proteína
Mioglobina da baleia cachalote
água
As cadeias laterais de aminoácidos
polares podem fazer pontes de H entre si e com moléculas de água
do meio, solubilizando proteínas.
(+)
(+)
(=)
(+)
A água é um dipolo
permanente, devido
à diferença de
eletronegatividade
de seus átomos.
(=)
(+)
Ponte de H formada
entre duas moléculas
de água
Ligação de H ou ponte de H: ambos os
termos têm o mesmo significado
Alguns tipos de pontes de H
entre aminoácidos e a água
Aminoácidos
polares
Corte
transversal da
membrana
interna da
mitocôndria
Aminoácidos
apolares
A Citocromo C oxidase é uma proteína de membrana.
Proteínas de membrana possuem uma região de aminoácidos hidrofóbicos apolares,
cujas cadeias laterais projetam-se para “fora” e interagem com a porção lipídica de
membrana celulares. Outras regiões dessas proteínas ricas em aminoácidos
hidrofílicos polares projetam-se para os meios aquosos extra- ou intracelular, e
podem formar “canais” hidrofílicos que atravessam a membrana, interconectando os
meios separados por ela.
.
Níveis organizacionais das proteínas
aminoácido
É o esqueleto covalente (fio do
colar), formado pela seqüência dos
átomos (-N-C-Ca-)n na proteína.
Estrutura primária: é a sequência dos
aminoácidos na cadeia polipeptídica;
mantida por ligações peptídicas
Para entender a estrutura 3D das proteínas, vamos “dissecá-la” em
níveis organizacionais para facilitar o estudo:
x4
Estrutura secundária:
• Enovelamento de partes da
cadeia polipeptídica
• Formada somente pelos
átomos da ligação peptídica,
através de pontes de H.
• Ex: alfa-hélices e folhas beta.
Estrutura terciária:
• Enovelamento de uma cadeia
polipeptídica como um todo.
• Ocorrem ligações entre os
átomos dos radicais R de
todos os aminoácidos da
molécula
Estrutura quaternária:
• Associação de mais de uma
cadeia polipeptídica
• No modelo, um tetrâmero
composto de 4 cadeias
polipeptídicas
Como resultado da ressonância da
ligação peptídica, ela é mais rígida
que uma ligação simples,
colocando todos os átomos
participantes no mesmo plano
espacial.
A ligação peptídica é uma amida.
O
-C
NH2
As distâncias interatômicas na
ligação peptídica são menores que
as de uma ligação amida comum.
Assim, o esqueleto covalente de
uma proteína, representado pela
seqüência linear dos átomos (-NC-Ca-)n, apresenta restrições de
mobilidade que são importantes
determinantes do enovelamento
da molécula.
O
O
C
C
N
H
N
H
Esse fato evidencia ressonância eletrônica,
com uma nuvem de elétrons oscilando entre o
C e o N. Isso atribue à ligação simples C – N
um carácter parcial (50%) de dupla ligação
A figura mostra duas ligações peptídicas –
CO – N -, com os átomos alinhados no plano
determinado pela ressonância da ligação.
Carbono a
O único ponto de rotação possível da cadeia
peptídica é em torno do Ca, entre as ligações
peptídicas, definindo dois ângulos de rotação:
Y- (psi ) – ângulo de rotação entre o Ca e o C
F (fi) – ângulo de rotação entre o Ca e N
Gráfico de Ramachandran
Na década de 1950, o físico Ramachandran fez uma
teoria sobre os ângulos possíveis de torção da ligação
peptídica. Sua teoria previa que somente nas áreas
sombreadas no gráfico abaixo poderia ocorrer um
enovelamento estável das proteínas.
Observe no gráfico que nas regiões
A
B
C
D
Posteriormente, com a determinação
indicadas pelos círculos vermelhos, em que
experimental dos ângulos Y e F (pontos no
Ramachandram
previu que não seria
gráfico) em diversas proteínas, a sua teoria
possível
existir estruturas estáveis, até hoje
foi comprovada.
não se descobriu nenhuma proteína.
Nas regiões de A a F ocorrem algumas
formas tridimensionais típicas de proteínas
2
A
1
B
C
Folha b paralela Folha b antiparalela
D
3
E
F
E
Colágeno
tripla hélice
4
a-hélice
(esquerda)
a-hélice
(direita)
Anel
F
Enzimas
1. Definição
2. O que é cinética enzimática?
Ramo da bioquímica que estuda as enzimas em ação:a sua atividade catalítica
procurando saber:
- que tipo de reações pode catalisar,
- com que substratos pode interatuar
- como se modifica essa atividade quando se fazem variar as condições em que
é ensaiada (pH, a temperatura, o tempo de incubação, as concentrações dos
substratos, de cofatores ou de outras substâncias (inibidores ou ativadores)
Classificação das Enzimas:
considera tipo de
reação e substratos
Nomenclatura oficial das enzimas é
dada pela Enzyme Comission da
International Union for Biochemistry
and Molecular Biology (IUBMB) :
ATPase (Adenosinatrifosfatase): EC 3.6.1.3
- é uma hidrolase.........................3
- atua num anidrido......................3.6
- o anidrido contém fosfato..........3.6.1
- esse anidrido é ATP..................3.6.1.3
Números identificam o tipo
de reação e o tipo de
substrato alvo
1. Óxido-redutases
( Reações de óxidoredução).
Transferência de elétrons
Se uma molécula se
reduz, há outra que se
oxida.
2. Transferases
(Transferência de grupos
funcionais)
•grupos aldeído
•gupos acila
•grupos glucosil
•grupos fosfatos (quinases)
3. Hidrolases
(Reações de hidrólise)
•Transformam polímeros em
monômeros.
Atuam sobre:
•Ligações éster
•Ligações glicosídicas
•Ligações peptídicas
•Ligações C-N
4. Liases
(Adição a ligações
duplas)
•Entre C e C
•Entre C e O
•Entre C e N
5. Isomerases
(Reações de
isomerização)
6. Ligases
(Formação de laços
covalentes com gasto
de ATP)
•Entre C e O
•Entre C e S
•Entre C e N
•Entre C e C
3. Como fazer um estudo cinético de uma enzima?
Para que pode servir o estudo cinético de uma
enzima?
•
o valor da atividade catalítica de uma determinada enzima é diretamente
proporcional à quantidade de enzima presente nesse meio.
•
O estudo cinético de uma enzima é importante para caracterizar essa
enzima, desta maneira distinguindo-a funcionalmente das demais enzimas
inclusive das que podem catalisar a mesma reação (isoenzimas).
•
Pode acontecer que estas enzimas sejam funcionalmente indistinguíveis
mas em alguns casos um estudo cinético sistemático pode mostrar
algumas diferenças como por exemplo no valor do Km em relação a um ou
mais substratos, na especificidade, ativação ou inibição por certos efetores,
nos valores de pH ótimo, etc.
•
Exemplo: hexoquinase cerebral e a glicoquinase hepática - tem valores de
Km muito distintos em relação ao substrato glicose e apenas a primeira é
inibida pela glicose-6-P.
•
Os estudos in vitro da atividade das enzimas foram e são de extraordinária
relevância no esclarecimento das vias metabólicas dos seres vivos e da
sua regulação.
Exercicios para proxima aula:
1)A tabela a seguir mostra alguns resultados tipicos para uma purificaçao de proteina. A proteina sendo
purificada é a enzima lactato desidrogenase, que catalisa uma reaçao entre o ácido latico e o NAD+
para fornecer NADH e piruvato. A purificaçao de uma enzima é monitorada por comparaçao com a a
tividade especifica da enzima em vários pontos na purificaçao. A atividade especifica é uma medida da
atividade da enzima dividida pela massa de proteina na amostra. Quanto maior o numero mais pura a
amostra. Qual a etapa foi mais eficaz na purificação da enzima? Qual etapa foi a mais onerosa em termos de recuperação da enzima?
Etapa de purificaçao
Atividade total da enzima
(micromol de produto/min)
Atividade especifica (micromol
de
produto/min/mg
de
proteina)
Homogenato cru
100.000
0,15
Sobrenadante 20.000 g
75.000
0,24
Precipitaçao por sal
36.000
0,75
Cromatografia de troca ionica
12.000
3,4
Cromatografia de filtraçao em
gel sephadex
500
90
2.) Distinga estrutura secundária e terciária de uma proteína. Dê exemplos.
3.) Descreva a-hélice e folha b pregueada. Aponte as diferenças essenciais entre estas formas de
estrutura secundária, encontradas em peptídeos.
4) Duas proteínas, apesar de terem diferenças quanto a alguns de seus aminoácidos, são capazes
de desempenhar a mesma função. Explique como isto é possível.










