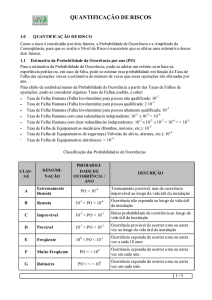
Constantes de acidez (Ka)
Constante de acidez (a 25 °C)
Ka
Fórmula
100% ionizado em água[2,3]
HClO4
Ácido perclórico
≃1010[4]
100% ionizado em água[2]
HI
Ácido iodídrico
≃1010[4]
100% ionizado em água[2]
HBr
Ácido bromídrico
≃109[4]
HClO3
Ácido clórico
100% ionizado em água[3]
100% ionizado em água[2,3]
HCl
Ácido clorídrico
≃107[4]
2 x 106[1]
100% ionizado em água[2,3]
HNO3
Ácido nítrico
≃103[4]
100% ionizado em água[2,3]
H2SO4
Ácido sulfúrico
≃103[4]
HOOCCOOH
Ácido oxálico
5,4 x 10-2[4]
1,7 x 10-2[4]
H2SO3
Ácido sulfuroso
1,23 x 10-2[3]
1,3 x 10-2[4]
HSO4Ião hidrogenossulfato
1,2 x 10-2[2,3]
HClO2
Ácido cloroso
1,0 x 10-2[2]
+3
Fe(H2O)6
Ião ferro (III) hidratado
6,0 x 10-3[4]
7,5 x 10-3[2]
H3PO4
Ácido fosfórico
7,1 x 10-3[4]
7,11 x 10-3[3]
7,1 x 10-4[3]
5,1 x 10-4[4]
HNO2
Ácido nitroso
4,6 x 10-4[2]
4,5 x 10-4[1]
6,8 x 10-4[3]
HF
Ácido fluorídrico
6,7 x 10-4[4]
3,5 x 10-4[1,2]
C9H8O4
Ácido acetilsalicílico
3,0 x 10-4[1]
HCOOH
Ácido metanóico (fórmico)
1,8 x 10-4[1,2,3]
C6H8O6
Ácido ascórbico (vitamina C)
8,0 x 10-5[1]
6,6 x 10-5[4]
6,5 x 10-5[1]
Ácido benzóico
C6H5COOH
6,3 x 10-5[2]
6,28 x 10-5[3]
1,8 x 10-5[1,2,4]
CH3COOH
Ácido acético (etanóico)
1,75 x 10-5[3]
Al(H2O)6+3
Ião alumínio hidratado
1,4 x 10-5[4]
1,0 x 10-7[4]
H2S
Ácido sulfídrico
9,5 x 10-8[3]
H2CO3
Ácido carbónico
4,4 x 10-7[4]
6,2 x 10-8[4]
HSO3Ião hidrogenosulfito
6,6 x 10-8[3]
6,3 x 10-8[4]
H2PO4Ião di-hidrogenofosfato
6,32 x 10-8[3]
3,5 x 10-8[1]
HClO
Ácido hipocloroso
3,0 x 10-8[2]
Ácido
www.fq.pt
Página 1 de 2
Ácido
Constante de acidez (a 25 °C)
Fórmula
Ácido cianídrico
Ião amónio
Fenol
HCN
NH4+
C6H5OH
Ião hidrogenocarbonato
HCO3-
Ião hidrogenossulfureto
HS-
Ião hidrogenofosfato
HPO4-2
Ka
7,2 x 10-10[2]
6,2 x 10-10[3]
4,9 x 10-10[1]
5,70 x 10-10[3,4]
1,3 x 10-10[2]
4,69 x 10-11[3]
4,7 x 10-11[4]
1,3 x 10-13[4]
1,3 x 10-12[3]
4,5 x 10-13[4]
7,1 x 10-13[3]
Bibliografia:
[1] J. Magalhães, Elementos 11º ano, Santillana, Carnaxide, 2008.
[2] D. Reger, S. Goode, E. Mercer, Química: Princípios e Aplicações, Fundação Calouste Gulbenkian, Lisboa, 2010.
[3] N. Maciel, M. M. Gradim, M. J. Campante, Eu e a Química 11º ano, Porto Editora, Porto, 2004.
[4] T. S. Simões, M. A. Queirós, M. O. Simões, Química em Contexto – Livro de Actividades, Porto Editora, Porto, 2004.
www.fq.pt
Página 2 de 2



![atividade_ead_fisica_2011_01[1].](http://s1.studylibpt.com/store/data/001980717_1-555397ea5ab7392905883cc82bf6109b-300x300.png)


![[2,0 pontos] O gráfico abaixo refere](http://s1.studylibpt.com/store/data/001485536_1-12e174feb085fe96219820b9710f5662-300x300.png)